ビッグデータを用いた時系列トータルシミュレーションによって新しい病態・バイオマーカーを発見
近年、神経変性疾患の超早期病態※1に注目が集まっている。神経変性疾患の多くは、異常な構造を持つタンパク質が細胞の内側外側に蓄積もしくは沈着(凝集)することが病理学的特徴として知られている。一方、神経変性疾患の概ね10%程度は、遺伝子変異が原因で生じおり、その病態が異常タンパク質凝集の前の時期から起きているのではないかということが、国際的には10年近く前から議論されており、これらの遺伝性変性疾患のマウスモデルを用いた研究から、異常タンパク質凝集前の超早期病態の存在が疑われている。
最近では、アルツハイマー病に対する複数の抗体医薬品が承認されたことで話題を呼んだが、これらは基本的に異常タンパク質の沈着凝集の除去を作用基盤としているため、異常タンパク質凝集前の超早期病態には効果がないことが想定され、凝集後の病態を抑制するのみでは効果は限定的になると予想される。
私達の研究グループでは、アルツハイマー病、前頭側頭葉変性症、ハンチントン病、脊髄小脳失調症の病態に対する網羅的なタンパク質解析(プロテオーム解析)、遺伝子発現解析(トランスクリプトーム解析)を20年前から開始し(Tagawa et al, J Neurochem 2004; Tagawa et al, J Neurosci 2007; Qi et al, Nature Cell Biol 2007; Enokido et al, J Cell Biol 2010など)、さらに2010年度-2015年度・新学術領域「シナプス・ニューロサーキットパソロジーの創成」および2010年度-2015年度・脳科学研究戦略推進プログラム課題Eにおいて、これらの疾患での異常タンパク質凝集前の『超早期病態』を世界に先駆けて提唱し、その本体を研究してきた(Tagawa et al, Hum Mol Genet 2015; Fujita et al, Sci Rep 2016; Tanaka et al, Nature Commun 2020; Homma et al, Life Sci Alliance 2021など)。
これらの研究は、生後1ヶ月以後の疾患モデルマウスあるいはヒト死後脳をサンプルに用いた解析であったが、今回の研究では、さらに時間的に繰り上げて、受精直後のES細胞に相当するiPS細胞から解析を始め、受精から発生段階、誕生から発症、そして個体死に至る全過程の解析(トータルシミュレーション)を試みた。そして、研究対象とする疾患を、私達がこれまでも研究してきた、また希少疾患でもある、脊髄小脳失調症1型に定めた。その結果、予想外の早期にサイトカイン関連分子のネットワーク変化が認められ、中でもISG15の上昇はアタキシン1の凝集病態のトリガーになりうること、そして血液バイオマーカーにもなりうることが明らかになった。
このシミュレーションのメソッドは、アルツハイマー病など、患者数の多いコモン疾患にも応用が可能である。また、今回はスパコンを用いた一定のアルゴリズムによる探索的研究を行ったが、次の段階でAIと組み合わせることで、予測的研究へと強化することが可能となる。
最近では、アルツハイマー病に対する複数の抗体医薬品が承認されたことで話題を呼んだが、これらは基本的に異常タンパク質の沈着凝集の除去を作用基盤としているため、異常タンパク質凝集前の超早期病態には効果がないことが想定され、凝集後の病態を抑制するのみでは効果は限定的になると予想される。
私達の研究グループでは、アルツハイマー病、前頭側頭葉変性症、ハンチントン病、脊髄小脳失調症の病態に対する網羅的なタンパク質解析(プロテオーム解析)、遺伝子発現解析(トランスクリプトーム解析)を20年前から開始し(Tagawa et al, J Neurochem 2004; Tagawa et al, J Neurosci 2007; Qi et al, Nature Cell Biol 2007; Enokido et al, J Cell Biol 2010など)、さらに2010年度-2015年度・新学術領域「シナプス・ニューロサーキットパソロジーの創成」および2010年度-2015年度・脳科学研究戦略推進プログラム課題Eにおいて、これらの疾患での異常タンパク質凝集前の『超早期病態』を世界に先駆けて提唱し、その本体を研究してきた(Tagawa et al, Hum Mol Genet 2015; Fujita et al, Sci Rep 2016; Tanaka et al, Nature Commun 2020; Homma et al, Life Sci Alliance 2021など)。
これらの研究は、生後1ヶ月以後の疾患モデルマウスあるいはヒト死後脳をサンプルに用いた解析であったが、今回の研究では、さらに時間的に繰り上げて、受精直後のES細胞に相当するiPS細胞から解析を始め、受精から発生段階、誕生から発症、そして個体死に至る全過程の解析(トータルシミュレーション)を試みた。そして、研究対象とする疾患を、私達がこれまでも研究してきた、また希少疾患でもある、脊髄小脳失調症1型に定めた。その結果、予想外の早期にサイトカイン関連分子のネットワーク変化が認められ、中でもISG15の上昇はアタキシン1の凝集病態のトリガーになりうること、そして血液バイオマーカーにもなりうることが明らかになった。
このシミュレーションのメソッドは、アルツハイマー病など、患者数の多いコモン疾患にも応用が可能である。また、今回はスパコンを用いた一定のアルゴリズムによる探索的研究を行ったが、次の段階でAIと組み合わせることで、予測的研究へと強化することが可能となる。
本研究において、私達は、「分子ネットワークの時間的変化」を因果関係に基づいてシミュレーションする手法を創出した。これを用いることで、発症のはるか以前(超早期)から、脳炎症に将来的に進行する病態 (ISG15, VEGFなどのサイトカインを中心とする分子ネットワーク変化)が生じていることを発見した。具体的には、他グループが報告した手法に沿ってiPS細胞を小脳神経細胞(プルキンエ細胞)に分化させ、この過程でサンプルを採取してmRNA発現変動をRNAシーケンスで測定した。併せて、脊髄小脳失調症1型の2種類のモデルマウス(mutant human Ataxin1 transgenic mouse, mutant Ataxin1 knockin mouse)を用いて他の研究グループが取得し公開されているRNAシーケンスデータを利用した。そして、今回新たに開発した時系列分子ネットワーク解析法であるiMADを用いて、タンパク質間相互作用のデータベースをもとに因果関係を持つ時間的つながりを抽出して、iPS細胞から発症後に至る分子ネットワークの変遷を図示した(図1)。
次にこの中で、初め(iPS細胞段階)から最後(マウス病態進展期、もしくは変性したプルキンエ細胞段階)までつながっている分子ネットワークを抽出した(図2)。その結果、Interleukin receptor 4、ISG15を含む炎症病態経路が超早期から変動して病態進展期につながっていることを発見した。
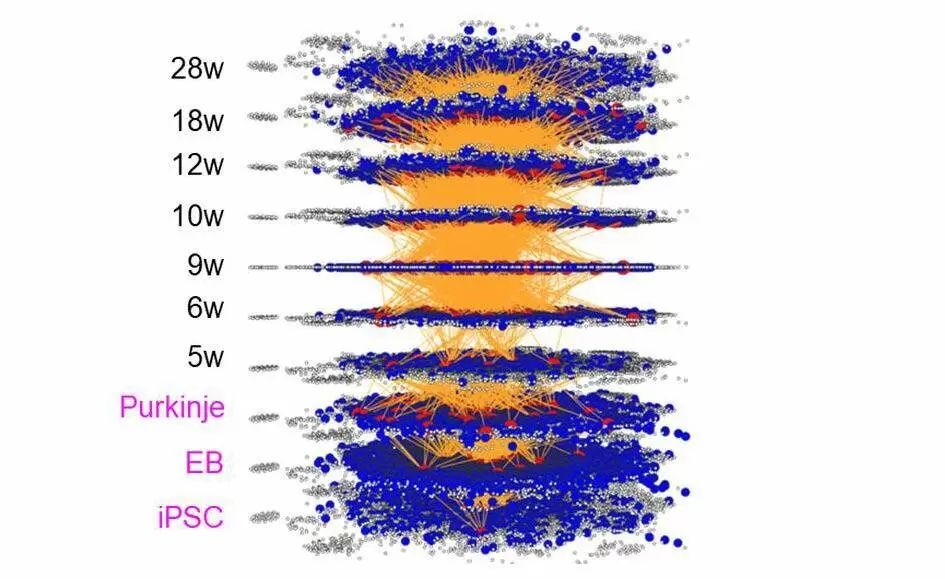
図1: 今回開発した、因果関係に基づく「分子ネットワークの時間的変化」のシミュレーション。IPS細胞の時期に起こった遺伝子発現変化が、発症さらにその後の病態進展につながっていくことが可視化できる。
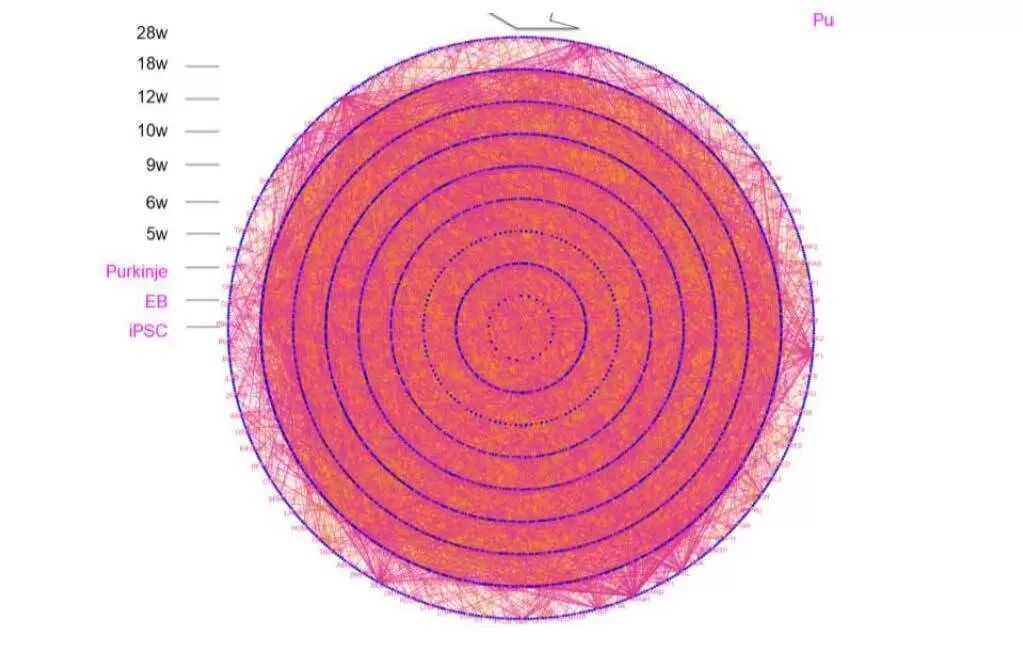
図2: 因果関係を持ってiPS細胞の時期から18週まで途絶えずに繋がっていくcytokineに関わる分子ネットワークを紫色のラインで示している。
脊髄小脳失調症1型におけるISG15の変化は初めての発見であったので、モデルマウス(mutant Ataxin1 knockin mouse)およびヒト患者死後脳を用いて、この分子の変動を確認した。また、患者さんの血液でISG15を測定して上昇を確認した。一方、ISG15はユビキチン・プロテアソーム系のタンパク質を抑制する働きがあり、ISG15上昇が上流変化となってユビキチン化したAtaxin1の分解を妨げ、神経細胞内の蓄積につながっている可能性も示した(図3)。さらに、血液中のISG15は脊髄小脳失調症1型患者で上昇傾向にあり、個々の患者では発症後の病態進行に伴って低下していく傾向があることも示した(図4)。
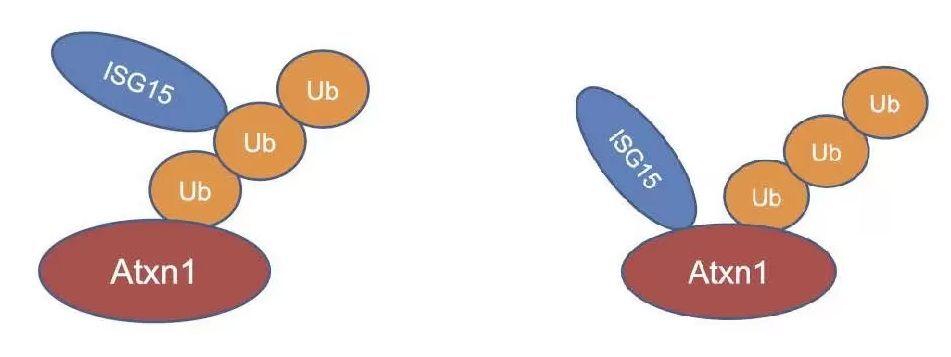
図3: ISG15はAtaxin-1タンパク質のユビキチン鎖に直接結合する(左)か、もしくはユビキチン化したAtaxin-1タンパク質の別な部位に結合して(右)、Ataxin-1タンパク質の分解を阻害すると考えられる。
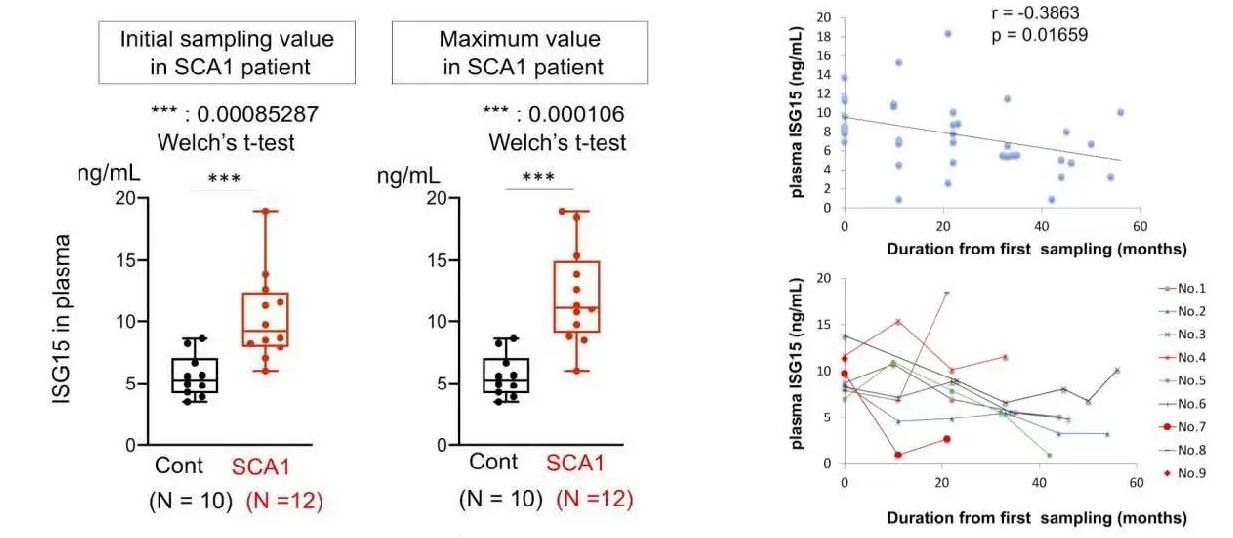
図4: 血漿中のISG15を正常者および脊髄小脳失調症1型患者で測定した(左)。患者群では有意に上昇している。一方、ISG15は発症後の病態進行に伴い徐々に低下する傾向にあった(右)。
本研究では、受精直後のES細胞に相当するiPS細胞から小脳神経細胞(プルキンエ細胞)への分化システムから得たデータと、モデルマウスのデータを統合的に解析を行い、受精から発症、そして個体死に至る全過程を解析(トータルシミュレーション)しようと試みた。そして、従来考えられていなかった発生段階から、将来の炎症病態につながる分子ネットワークが変動を始めていることを発見した。このトリガーになる分子として挙がったのは、ISG15, IL4 receptorなどの従来SCA1への関与の報告のなかった分子であった。ISG15は患者血液でも上昇しており、バイオマーカーとして使うことが期待できる。また、ISG15のタンパク質分解系への抑制作用が超早期に起きている上流病態である可能性を示した。
本研究で用いたシミュレーションのメソッドは、アルツハイマー病など、患者数の多いコモン疾患にも応用が可能である。また、今回はスパコンを用いた一定のアルゴリズムによる探索的研究を行ったが、次の段階でAIと組み合わせることで、予測的研究へと強化することが可能である。
また、今回の研究は、超早期病態が予想を超えて早い時期から起きている可能性を示したが、この結果は患者さんにとって失望するようなことではなく、どの時期にどのような分子を標的に治療をすれば大きな治療効果を得られるかの予測を示すことになり、治療開発へと繋がりうるものである。さらには、どのような分子をどの時期に標的にすれば、将来の発症を抑えるあるいは遅らせることができるかを予測することにもつながると考えられる。
発表論文
Homma, H., Yoshioka, Y., Fujita, K., Shirai, S., Hama, Y., Komano, H., Saito, Y., Yabe, I., Okano, H., Sasaki, H., Tanaka, H. & Okazawa, H. (2024)
Dynamic molecular network analysis of iPSC-Purkinje cells differentiation delineates roles of ISG15 in SCA1 at the earliest stage.
Commun. Biol. 9 April 2024, 7 (1), 413. doi: 10.1038/s42003-024-06066-z
Dynamic molecular network analysis of iPSC-Purkinje cells differentiation delineates roles of ISG15 in SCA1 at the earliest stage.
Commun. Biol. 9 April 2024, 7 (1), 413. doi: 10.1038/s42003-024-06066-z
関連リンク
- プレスリリース - 「 ビッグデータを用いた時系列トータルシミュレーションによって新しい病態・バイオマーカーを発見 」【岡澤均 教授】
- Springer Nature Research Communities - "How we can simulate temporal changes of molecular networks based on the cause-result relationship?"

