臨床研究法における臨床研究の利益相反管理について
臨床研究法における臨床研究の利益相反管理について
臨床研究法は、相次いで生じた研究不正事件を踏まえ、特定臨床研究※の実施に法的規制を課すことで研究不正を防止し、研究対象所をはじめとする国民の臨床研究に対する信頼を確保することを目的をとし、平成29年4月14日に公布、平成30年4月1日に施行されました。
参考:厚生労働省ウェブサイト「臨床研究法について」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
参考:厚生労働省ウェブサイト「臨床研究法について」
https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000163417.html
※特定臨床研究(臨床研究法が対象とする「臨床研究」)とは
・製薬企業等(医薬品製造業者又はその特殊関係者)から研究資金等(臨床研究の実施のための資金)を受け、医薬品等(医薬品、医療機器、再生医療等製品)を用いる臨床研究~臨床研究法第2条第2項第1号
・未承認・適用外の医薬品等を用いる臨床研究~同第2号
以下に該当するものは臨床研究法の適用対象外です
(GCP〔治験〕又は倫理指針〔その他の臨床研究〕に従って機関の承認を得てください)
・治験(治験届けが必要なもの、治験届けが不要なもの)
・医薬品、医療機器、再生医療等製品の製造販売後調査等であって、再審査、再評価、使用成績評価に係るもの
・医療機器の認証に係る基準適合性に関する情報の収集のために行う試験(JIS規格に規定するものに限る。)
・いわゆる「観察研究」※
※研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、
患者のために最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究
詳しくは、厚生労働省ウェブサイトの「臨床研究法の範囲について」をご覧ください
https://www.nrs.hosp.tohoku.ac.jp/wordpress/wp-content/uploads/2020/07/000646608.pdf
・未承認・適用外の医薬品等を用いる臨床研究~同第2号
以下に該当するものは臨床研究法の適用対象外です
(GCP〔治験〕又は倫理指針〔その他の臨床研究〕に従って機関の承認を得てください)
・治験(治験届けが必要なもの、治験届けが不要なもの)
・医薬品、医療機器、再生医療等製品の製造販売後調査等であって、再審査、再評価、使用成績評価に係るもの
・医療機器の認証に係る基準適合性に関する情報の収集のために行う試験(JIS規格に規定するものに限る。)
・いわゆる「観察研究」※
※研究の目的で検査、投薬その他の診断又は治療のための医療行為の有無及び程度を制御することなく、
患者のために最も適切な医療を提供した結果としての診療情報又は試料の収集により得られた情報を利用する研究
詳しくは、厚生労働省ウェブサイトの「臨床研究法の範囲について」をご覧ください
https://www.nrs.hosp.tohoku.ac.jp/wordpress/wp-content/uploads/2020/07/000646608.pdf
特定臨床研究を実施する場合には、利益相反(COI)申告者は、自身の所属機関に臨床研究法における利益相反自己申告書である【様式C】を提出し、助言・指導を受け確認結果を受領することが定められています。
本学統合研究機構事務部産学連携課総務係では、【様式C】の確認業務を行っております。
本学以外の研究責任(代表)医師の方は、所属医療機関にて【様式C】の確認を行い、【様式D】を入手したうえで、本学認定臨床研究審査委員会へ【様式A及びE】を提出してください。必要な手続き等の詳細は、下記の登録マニュアルをご確認ください。
医学部附属病院臨床試験管理センターウェブサイト:臨床研究法による臨床研究
http://www.tmd-ac.jp/medical/research2/index.html
本学統合研究機構事務部産学連携課総務係では、【様式C】の確認業務を行っております。
本学以外の研究責任(代表)医師の方は、所属医療機関にて【様式C】の確認を行い、【様式D】を入手したうえで、本学認定臨床研究審査委員会へ【様式A及びE】を提出してください。必要な手続き等の詳細は、下記の登録マニュアルをご確認ください。
医学部附属病院臨床試験管理センターウェブサイト:臨床研究法による臨床研究
http://www.tmd-ac.jp/medical/research2/index.html
【必読】臨床研究法における利益相反管理 登録マニュアル
臨床研究法における利益相反管理について、各役割の実施フローチャートや利益相反自己申告書の作成方法について記載されているマニュアルです。初回申請の方は必ずご一読をお願いいたします。
※マニュアルはver.3.0の厚労省の書式に対応した内容になっておりますのでご注意ください。
※マニュアルはver.3.0の厚労省の書式に対応した内容になっておりますのでご注意ください。
基準と様式
利益相反WEB申告システムへのリンク
本学が主施設となる臨床研究法における臨床研究の利益相反管理は、利益相反WEB申告システムを用いて行ってください。
利益相反WEB申告システムURL
https://ap-ura.tmd.ac.jp/coi/login_front.aspx
利益相反WEB申告システムURL
https://ap-ura.tmd.ac.jp/coi/login_front.aspx
各様式に関する説明
| 作成者 | 内容 | 提出先 | 書式 | |||
|---|---|---|---|---|---|---|
| 様式A | 管理基準 COI 管理基準 |
単施設の場合: 研究責任医師 多施設の場合: 研究代表医師 |
研究全体が一定の基準でCOI管理をするためにCOI管理基準をたてる 実際は厚労省推奨の基準を採用 |
認定臨床研究 審査委員会 |
厚労省の推奨書式あり | |
| 様式B | 申告基準 関係企業 報告書 |
研究に関係する企業を抽出し、当該企業との関わりの内容について整理するもの | 研究責任医師 | |||
| 様式C※ | 申告基準 COI 報告書 |
研究責任医師 研究分担医師 統計解析責任者 利益を得ることが明白な者 |
様式BのQ1に該当する企業(研究対象薬剤等を製造販売する企業)とのCOIの内容と管理計画を記載するもの | 所属機関 (産学連携課 総務係) |
||
| 様式D※ | COI管理 報告書 |
様式Cの作成者の所属機関 | 様式Cの内容の正確性を、所属機関が把握している情報を元に確認を行う | 研究責任医師 | ||
| 様式E | COI管理 計画書 |
単施設の場合: 研究責任医師 多施設の場合: 研究代表医師 |
様式B・Dの内容を整理したもの 様式E(Aも)は認定臨床研究審査委員会へ提出される |
認定臨床研究 審査委員会 |
||
※様式C・Dは企業等が製造販売等する薬剤等を対象とする場合のみ必要
※様式は随時アップデートされますので、作成時はお手持ちの様式のバージョンが最新になっているかを確認してください。
※様式は随時アップデートされますので、作成時はお手持ちの様式のバージョンが最新になっているかを確認してください。
利益相反に関する規定(臨床研究法より)
関係法令
利益相反管理に関しては、臨床研究法のほか、省令、通知、ガイダンス等で定められています。
- 臨床研究法の施行等に関するQ&A(統合版)について(令和元年11月13日厚生労働省医政局研究開発振興課/医薬・生活衛生局監視指導・麻薬対策課事務連絡)
- 臨床研究法における臨床研究の利益相反管理について、利益相反管理ガイダンス
- (平成30年11 月30日医政研発1130第17号厚生労働省医政局研究開発振興課長通知)
- 臨床研究法における利益相反管理ガイダンスに関するQ&A
- 臨床研究法における利益相反管理に関する標準業務手順書
- 臨床研究法においては、研究責任医師が利益相反管理の責任を負うことが定められています。
下図に示すように、研究責任医師は利益相反基準を作成し、当該基準に従って研究全体の利益相反の管理計画を作成し認定臨床研究審査委員に諮ることが求められます。
手順
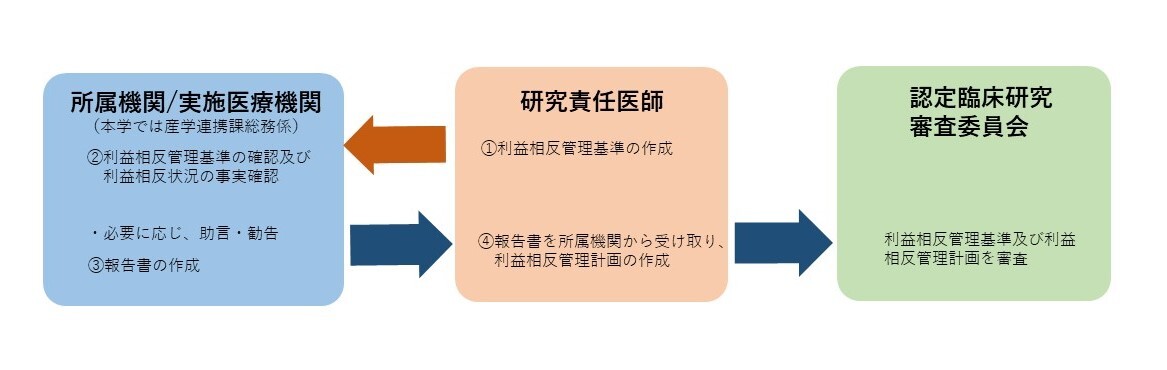
臨床研究法においては、研究責任医師が利益相反管理の責任を負うことが定められています。
下図に示すように、研究責任医師は利益相反基準を作成し、当該基準に従って研究全体の利益相反の管理計画を作成し認定臨床研究審査委員に諮ることが求められます。
下図に示すように、研究責任医師は利益相反基準を作成し、当該基準に従って研究全体の利益相反の管理計画を作成し認定臨床研究審査委員に諮ることが求められます。
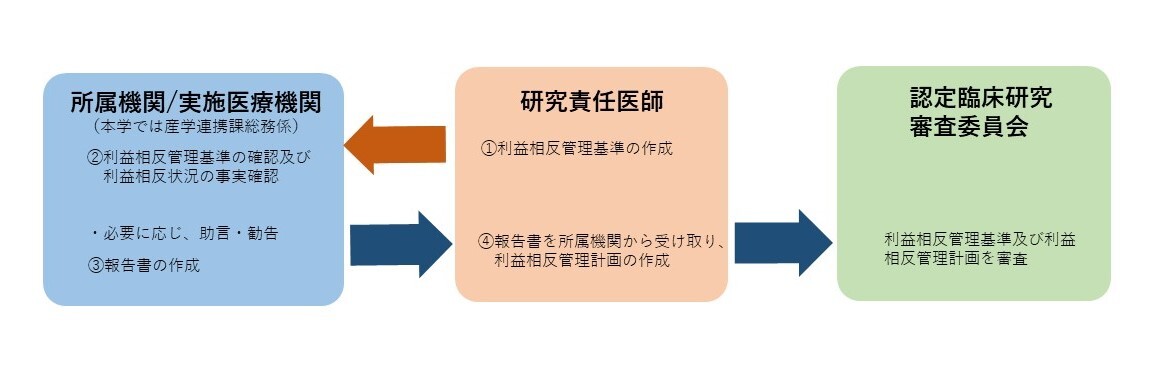
| ① | 研究責任医師または研究代表医師は、当該臨床研究の利益相反管理基準を作成し、当該臨床研究に関わる企業を確認する。 |
| ② | 研究責任医師・研究分担医師等は、当該臨床研究に関わる企業との利益相反状況を確認し、所属機関(産学連携課総務係)が事実確認する。 |
| ③ | 所属機関(産学連携課総務係)は、確認内容を研究責任医師へ報告する。 |
| ④ | 研究責任医師または研究代表医師は、所属機関の報告を確認し、当該研究の利益相反管理計画を作成し、当該研究の利益相反管理基準とともに認定臨床研究審査委員会に申請する。 |
利益相反申告が必要な者
利益相反申告の対象となるのは、
・研究責任医師
・研究分担医師
・統計解析責任者
・研究実施によって利益を得る事が明白な者
です。
対象者は研究責任医師の作成した利益相反管理基準に基づいて自己の利益相反状態を申告し、管理計画を立て、産学連携課総務係に確認することが求められます。
・研究責任医師
・研究分担医師
・統計解析責任者
・研究実施によって利益を得る事が明白な者
です。
対象者は研究責任医師の作成した利益相反管理基準に基づいて自己の利益相反状態を申告し、管理計画を立て、産学連携課総務係に確認することが求められます。
管理が必要となる利益相反
管理が必要となる利益相反は、①研究への企業関与 ②利益相反申告者と企業との関係、の2つです。
①研究への企業関与(規則21条1項1号)
研究責任医師(他施設共同研究の場合は研究代表医師)は、実施する臨床研究に関与する企業を抽出し、関係性を整理して利益相反管理計画を示す必要があります。
以下の要件1~5のいずれかに該当する場合は、企業関与「有り」となります。
1.医薬品等製造販売業者等が製造販売をし、又はしようとする医薬品等を用いる研究
2.医薬品等製造販売業者等からの当該臨床研究に対する研究資金等の提供を受ける場合
3.医薬品等製造販売業者等からの当該臨床研究に使用する物品(医薬品等を含む)、
施設等の無償又は相当程度に安価で提供・貸与を受ける研究
4.医薬品等製造販売業者から無償又は相当程度に安価な価格での役務及び特定役務を受ける研究
5.医薬品等製造販売業者等に在籍している者及び過去2年間在籍していた者が従事する研究
②利益相反申告者と企業との関係(規則21条1項2号)
利益相反申告者は、研究対象薬剤等の製造販売業者との関係を申告し、基準に従って管理計画を立て、産学連携課総務係の事実確認を受けることが必要となります。
下記事項について、本人及び生計を共にする配偶者、一親等親族の、当該年度と前年度についての申告が必要です。
1.1社からの寄附金が年間200万円以上(寄附金の管理者が報告する)
2.寄付講座所属
3.1社からの個人的利益が年間100万円以上(級と・講演・原稿・コンサル・ライセンス・贈答・接遇等による収入)
4.役員等への就任
5.株式保有・出資(株式については、公開株は5%以上、未公開株は1株以上、新株予約権は1個以上)
6.その他(寄附講座の受入・特許権を保有している等)
①研究への企業関与(規則21条1項1号)
研究責任医師(他施設共同研究の場合は研究代表医師)は、実施する臨床研究に関与する企業を抽出し、関係性を整理して利益相反管理計画を示す必要があります。
以下の要件1~5のいずれかに該当する場合は、企業関与「有り」となります。
1.医薬品等製造販売業者等が製造販売をし、又はしようとする医薬品等を用いる研究
2.医薬品等製造販売業者等からの当該臨床研究に対する研究資金等の提供を受ける場合
3.医薬品等製造販売業者等からの当該臨床研究に使用する物品(医薬品等を含む)、
施設等の無償又は相当程度に安価で提供・貸与を受ける研究
4.医薬品等製造販売業者から無償又は相当程度に安価な価格での役務及び特定役務を受ける研究
5.医薬品等製造販売業者等に在籍している者及び過去2年間在籍していた者が従事する研究
②利益相反申告者と企業との関係(規則21条1項2号)
利益相反申告者は、研究対象薬剤等の製造販売業者との関係を申告し、基準に従って管理計画を立て、産学連携課総務係の事実確認を受けることが必要となります。
下記事項について、本人及び生計を共にする配偶者、一親等親族の、当該年度と前年度についての申告が必要です。
1.1社からの寄附金が年間200万円以上(寄附金の管理者が報告する)
2.寄付講座所属
3.1社からの個人的利益が年間100万円以上(級と・講演・原稿・コンサル・ライセンス・贈答・接遇等による収入)
4.役員等への就任
5.株式保有・出資(株式については、公開株は5%以上、未公開株は1株以上、新株予約権は1個以上)
6.その他(寄附講座の受入・特許権を保有している等)
【参考】利益相反に関する様式
※本学が主施設の臨床研究は利益相反WEB申告システムをご利用ください
問い合わせ先
研究推進部産学連携課医療イノベーション推進室企画グループ
内線:82186 メールアドレス: sanren-soumu.adm@tmd.ac.jp
内線:82186 メールアドレス: sanren-soumu.adm@tmd.ac.jp

