「 脂質リガンド結合ヘテロ核酸による新規エクソン・スキッピング療法の開発 」【横田隆徳 教授、永田哲也 教授、長谷川樹里 大学院生】

横田 隆徳(ヨコタ タカノリ)大学院医歯学総合研究科 脳神経病態学分野(脳神経内科) 教授(左上)
永田 哲也(ナガタ テツヤ)統合研究機構 核酸・ペプチド創薬治療研究センター 教授(右上)
長谷川 樹里(ハセガワ ジュリ)大学院医歯学総合研究科 脳神経病態学分野(脳神経内科) 大学院生(下)
― デュシャンヌ型筋ジストロフィー(DMD)に対する新規治療薬開発へ期待 ―
「エクソン・スキッピング療法」の限界を超えて

ポイント
- デュシャンヌ型筋ジストロフィー(DMD)は遺伝性の筋疾患であり、エクソン・スキッピング療法※1という治療法が臨床で使われていますが、骨格筋での効果が限定的であり、また生命予後に関係する心臓への効果が無いこと課題です。
- 研究グループはDMDに対して現在、承認されているホスホロジアミデートモルホリノオリゴマー (PMO) ※2を元に新しい「脂質リガンド結合PMO/RNAヘテロ2本鎖核酸 (PMO/HDO)」を開発しました。
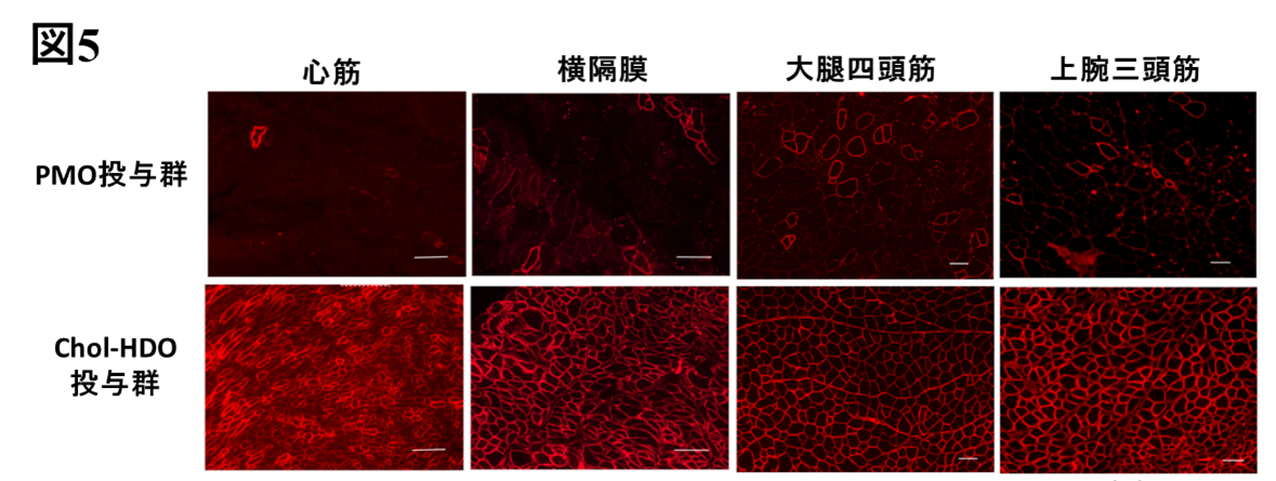
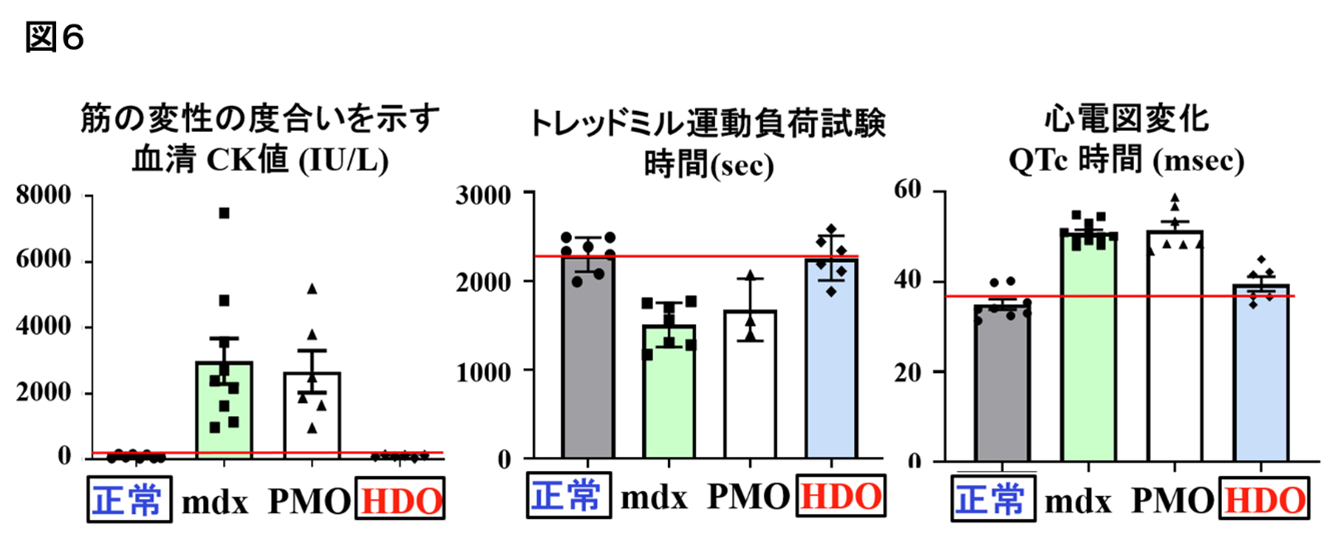
- DMDモデルマウスにこの核酸を投与したところ、欠損しているジストロフィンが、骨格筋や心筋での発現回復が大幅に改善され、運動・心機能や中枢神経症状が正常化しました。
- この新規のPMO/HDOはDMDに対する新規治療法としてだけでなく、スプライシング制御によって遺伝子発現の調整が可能な他の遺伝性疾患やがんに対する新たな医薬技術としても期待できます。
この研究は日本医療研究開発機構(AMED)の革新的バイオ医薬品創出基盤技術開発事業における研究課題「第3世代ヘテロ核酸の開発」、先端的バイオ創薬等基盤技術開発事業における研究課題「次世代血液脳関門通過性ヘテロ核酸の開発による脳神経細胞種特異的分子標的治療とブレインイメージング」、日本学術振興会(JSPS)「科研費助成事業(基盤研究(A) 19H01016 / JP22H00440)、(基盤研究(B) 16H05221)」、武田薬品工業との共同研究費の支援のもとでおこなわれたもので、この研究成果は、国際科学誌Nature Communications に、2024年9月26日にオンライン版で発表されました。
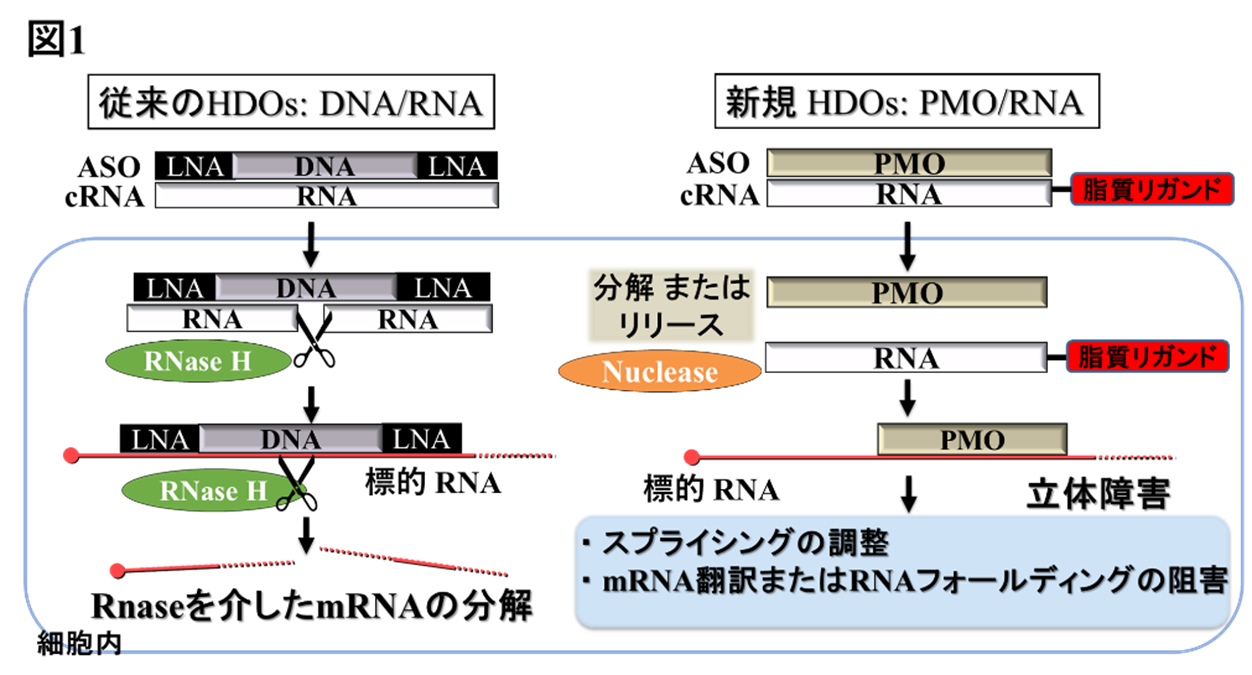
研究の背景
研究成果の概要
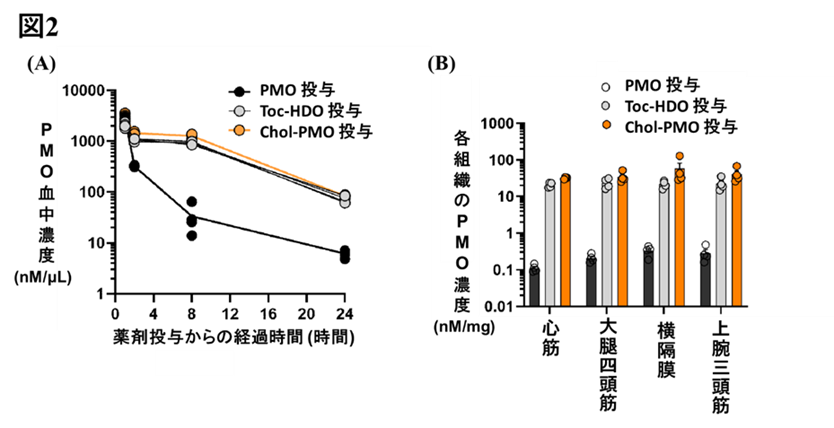
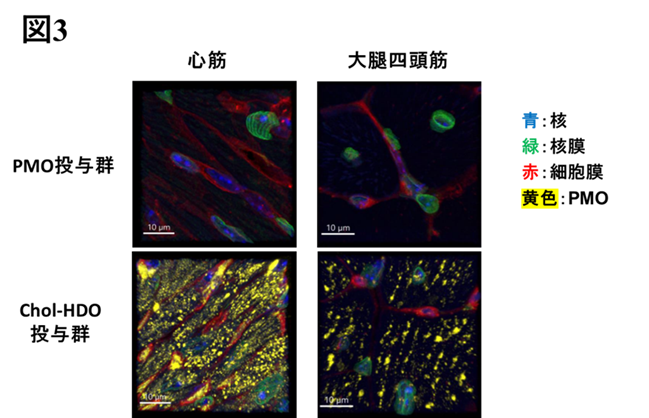
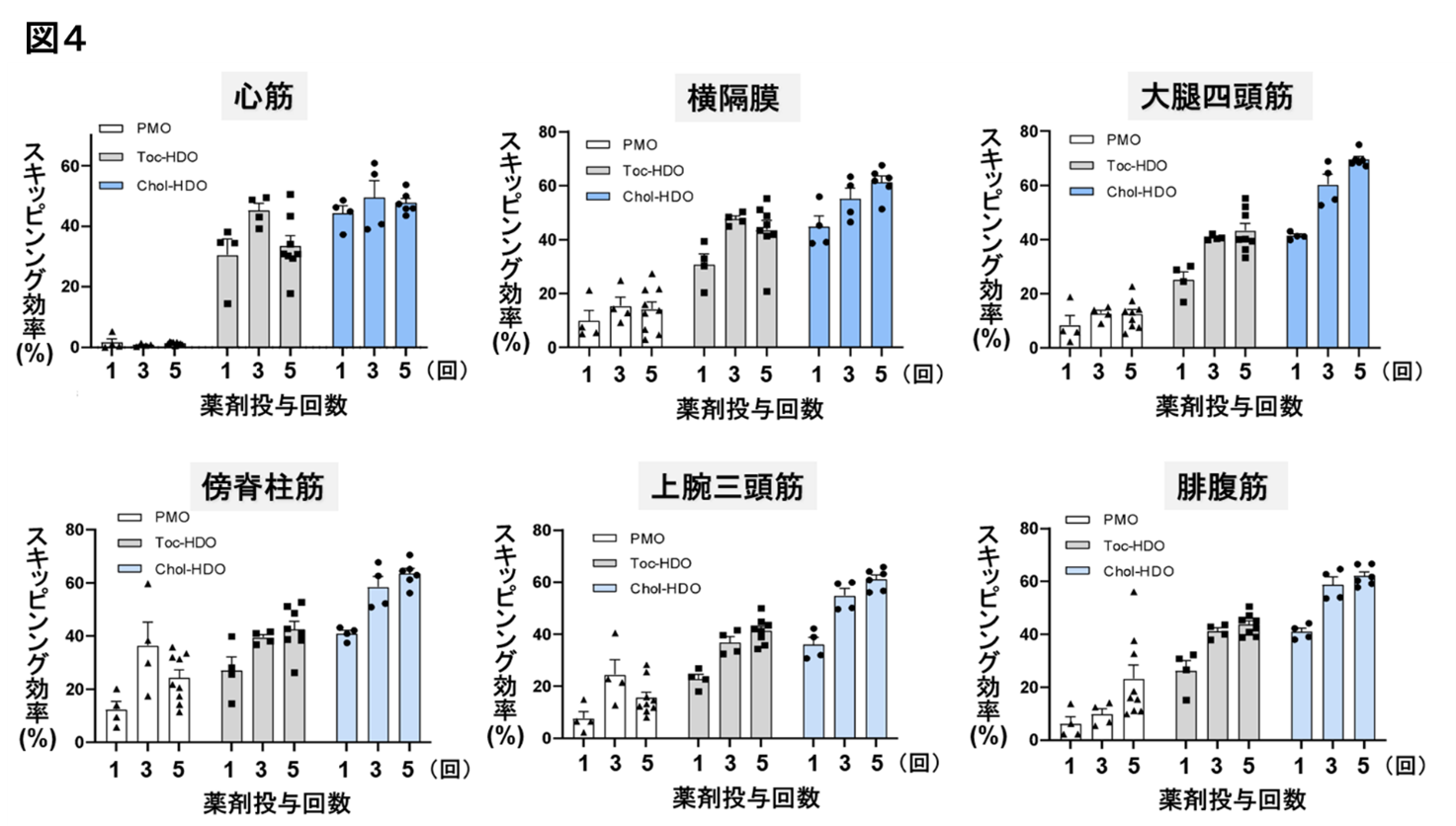
研究成果の意義
DMDは、近年では核酸医薬の新規開発が進んでいるものの、特に心筋への効果は依然として不十分です。今回の研究では、脂質リガンド結合HDOがmdxマウスの心臓でジストロフィンタンパクを劇的に発現させ、心機能障害が改善することが確認されました。従来のPMO薬では達成できなかったDMD患者の予後を改善させることが期待されます。また、このようなPMO/HDOの特性は、エクソン・スキッピング療法の対象となるDMDに限らず、エクソン・スキッピング療法の対象となる心臓、中枢神経系、骨格筋に影響を与える他の遺伝性疾患に対する治療薬としても有望な医薬技術となり得ます。
用語解説
※1 エクソン・スキッピング療法
デュシェンヌ型筋ジストロフィーの原因となるジストロフィン遺伝子の変異にはいくつかの種類があり、エクソンの欠失、重複、点突然変異といった一部のエクソンに異常があると、ジストロフィンの設計図であるmRNAに異常が生じてジストロフィンが作られない。エクソン・スキッピング療法は、成熟したmRNAになる前のmRNA前駆体に作用して、エクソンを認識させないようにして、正常よりも少し短いながら正常に機能するジストロフィンを作らせる治療法である。ジストロフィンタンパクの構造は、中央部がロッドドメインの繰り返し構造となっており、一部の構造がかけても機能して、運動機能、呼吸機能、心機能などの低下を抑えて症状の進行を遅らせることが期待されている。
※2 ホスホロジアミデートモルホリノオリゴマー (PMO)
DNAやRNAなどの核酸は生体内でヌクレアーゼにより分解されやすいため、化学修飾を施した核酸医薬が開発されているが、細胞毒性も問題となっている。PMOは核酸類似の人工化合物であり、モルフォリン環を持ち、ホスホロジアミデート結合をしていることでヌクレアーゼ耐性が高く、細胞毒性が低い利点がある。一方で電荷をもたないため、膜透過性が低く、組織移行性が低いことが課題である。
※3 アンチセンス核酸(ASO)
核酸医薬には、主にアンチセンス核酸(ASO)とsiRNAの作用様式があり、ゲノム遺伝子から転写されたmRNAやmRNA前駆体に作用する。ASOは様々な化学修飾が施された1本のDNA鎖を基本構造として標的のmRNA等とDNA/RNAハイブリッドを形成して標的RNAを分解、またはRNAのスプライシング制御等を行う。
※4 mdxマウス
mdxマウスはX染色体上のジストロフィン遺伝子のエクソン23に点突然変異を持ち、ジストロフィンタンパクが産生されないため、デュシェンヌ型筋ジストロフィーのモデルマウスとして知られている。
※5 in situ hybridization chain reaction (in situ HCR法)
蛍光標識されたヘアピン構造の合成DNA等を用いて、組織切片上で目的の核酸(今回はPMO)を可視化する方法。この手法により、組織内での目的核酸の局在を可視化でき、その分布を明らかにできる。
論文情報
掲載誌: Nature Communications
論文タイトル: Heteroduplex oligonucleotide technology boosts oligonucleotide splice switching activity of morpholino oligomers in a Duchenne muscular dystrophy mouse model
DOI: https://doi.org/10.1038/s41467-024-48204-5
研究者プロフィール

長谷川 樹里 (ハセガワ ジュリ) Juri Hasegawa
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
・研究領域
神経内科学、核酸医薬

東京医科歯科大学 統合研究機構
核酸・ペプチド創薬治療研究センター (TIDEセンター) 教授
脳神経病態学分野(脳神経内科)
・研究領域
神経内科学、核酸医薬

東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 教授
・研究領域
神経内科学、核酸医薬
問い合わせ先
<研究に関すること>
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野/核酸・ペプチド創薬治療研究センター
永田 哲也 (ナガタ テツヤ)
横田 隆徳 (ヨコタ タカノリ)
E-mail: tak-yokota.nuro[@]tmd.ac.jp t-naga.nuro[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

