「 中枢神経を標的とした核酸医薬の高い有効性と安全性を有する技術開発に成功 」【横田隆徳 教授】
― アルツハイマー型認知症などの神経難病治療の新たなる選択肢 ―

ポイント
- アンチセンス核酸医薬(ASO) ※1は、神経難病に対する新たな治療手段として期待されていますが、多くの疾患への応用には副作用のため投与量に制限があることが大きな障害となっています。
- 本研究グループは、核酸医薬の有効性を保ちつつ、神経系の副作用を著しく改善する新規の核酸化学修飾技術を見出しました。
- 本研究成果は、根治治療の難しい神経難病に対する高い有効性と安全性を兼ね備えた治療薬開発への応用が期待できます。
研究の背景
中枢神経の疾患を対象としたASOは、中枢神経組織の周囲の空間である髄腔内へ投与することが一般的です。一方で、ASOの開発段階で大きな障害として、髄腔内に投与した際に痙攣(けいれん)や意識障害、運動機能の異常といった副作用が出現することが挙げられます。この結果、特に有効性が高い有望な候補品が副作用のために投与量に制限が生じてしまい、結局十分な有効性を引き出せない問題が存在しました。さらに、核酸医薬は一人一人の遺伝子の異常に応じて薬物の設計が可能であるため、超希少疾患と呼ばれるような患者数が非常に少ない遺伝性疾患に関しても個別の創薬開発が注目されています。しかし、そのような個別化治療のための創薬開発には候補薬の選別に時間的・金銭的にも大きな制約が存在し、有効性と安全性の両立する候補品を見出すことは容易ではありませんでした。
以上から、中枢神経の疾患を標的とした核酸医薬の臨床応用には、有効性と安全性の両立を可能とする新たな技術の開発が望まれていました。そこで、本研究グループは大阪大学の大学院薬学研究科の小比賀聡教授らのグループが開発した新規の核酸化学修飾技術を用いて、中枢神経疾患を標的としたASOの有効性及び安全性の詳細な検証に着手しました。
研究成果の概要
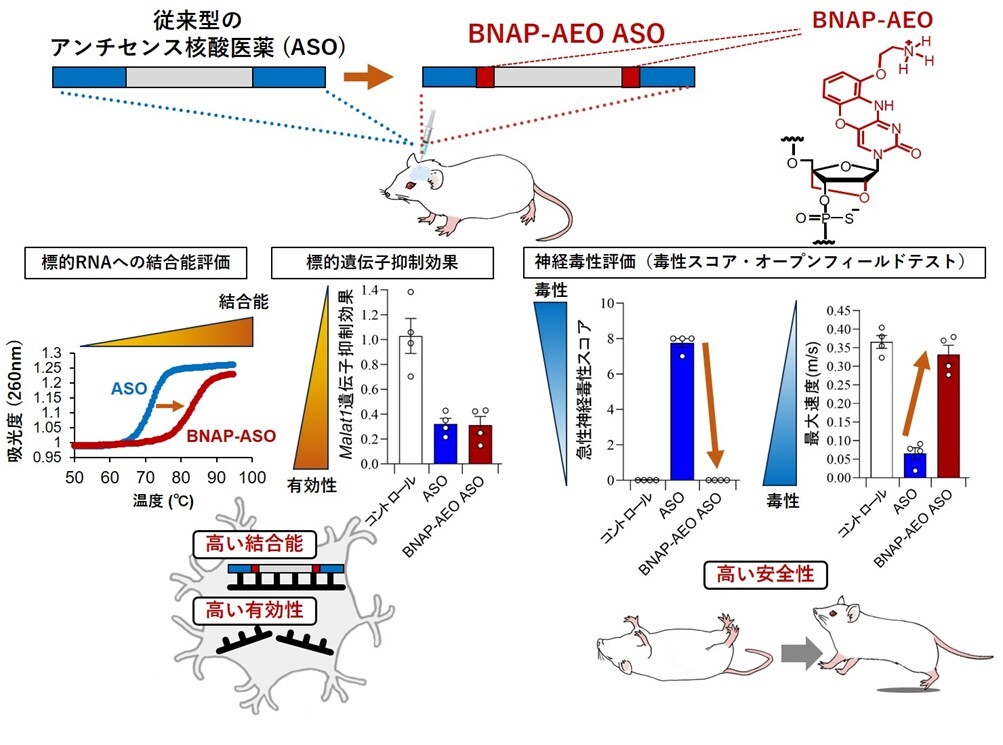
図A:BNAP-AEO ASOは高い有効性及び安全性の両立を可能にする
従来型のASO及び、BNAP-AEO修飾を導入したASO(BNAP-AEO ASO)を設計・合成しました(上段)。BNAP-AEO ASOは従来型のASOと比較して、標的RNAへの結合能が高く(中段左)、それぞれをマウスの髄腔内に投与した際の標的遺伝子への抑制効果は保持されつつ、毒性スコア評価・5分間の自発的運動機能評価(オープンフィールドテスト)において神経毒性が著しく改善しました(中段右)。つまり、BNAP-AEOは高い標的RNAへの結合能・有効性及び安全性を同時に可能としました。
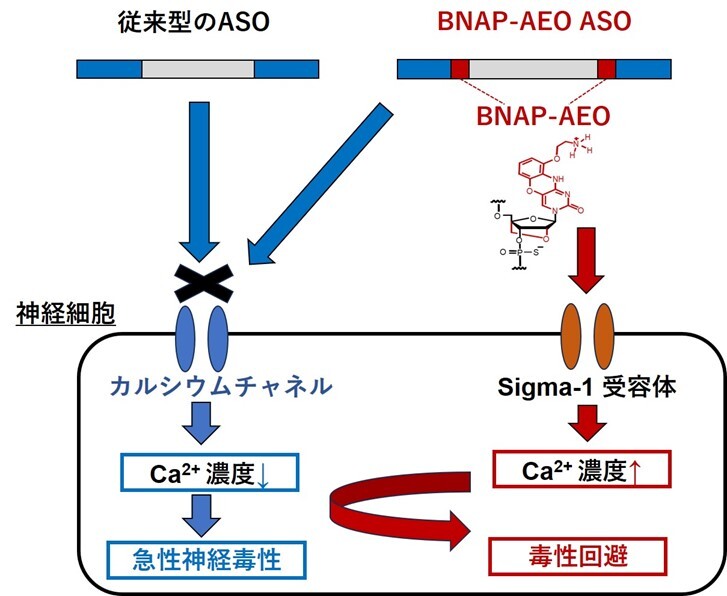
図B:BNAP-AEOによる神経毒性が改善する分子メカニズム仮説
従来型のASOは神経細胞内のカルシウムチャネルの機能を阻害して、細胞内のカルシウムイオンを低下させるため、急性神経毒性が出現します(左)。一方で、BNAP-AEO ASOはSigma-1受容体を介して、細胞内のカルシウムイオン低下を防ぎ、毒性が回避されることが想定されます(右)。
研究成果の意義
用語解説
※1アンチセンス核酸医薬(ASO)
標的とするRNA(mRNA、pre-mRNA、microRNAなど)に対して相補的な塩基配列を有した人工合成した核酸分子で、それらに標的RNAに結合して機能の制御を行う。既存の低分子医薬や抗体医薬では標的にすることが難しい細胞内のRNAを直接標的にすることが可能であり、次世代の医薬品として注目されている。
※22',4'-BNA/LNA with 9-(aminoethoxy)phenoxazine (BNAP-AEO)
大阪大学の小比賀聡教授、中川治博士らが開発した新規の核酸分子の化学修飾技術。核酸糖骨格部に対する化学修飾である2',4'-BNA/LNAと、塩基に対する化学修飾である9-(aminoethoxy)phenoxazineを組み合わせた技術である。本研究グループはBNAP-AEOを導入した核酸分子は、標的RNAへの高い結合能を有することを報告している。
※3Sigma-1受容体
脳内の特に神経細胞に多く発現する二回膜貫通型タンパク質。細胞内のカルシウムイオン濃度の調製や小胞体ストレス経路の活性化、ミトコンドリア機能の強化など様々な機能を有することが示されている。
論文情報
掲載誌:Molecular Therapy-Nucleic Acids
論文タイトル:Favorable Efficacy and Reduced Acute Neurotoxicity by Antisense Oligonucleotides with 2',4'-BNA/LNA with 9-(aminoethoxy)phenoxazine
DOI:https://doi.org/10.1016/j.omtn.2024.102161
研究者プロフィール

横田 隆徳(ヨコタ タカノリ) Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 教授
・研究領域:神経内科学、核酸医薬

小比賀 聡(オビカ サトシ)
大阪大学大学院薬学研究科
生物有機化学分野 教授
・研究領域:生物有機化学、核酸化学

吉岡 耕太郎(ヨシオカ コウタロウ) Kotaro Yoshioka
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任助教
・研究領域:神経内科学、神経科学、核酸医薬

Su Su Lei Mon(ス ス レイ モン)
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任研究員
・研究領域:神経内科学、核酸医薬

松林 泰毅(マツバヤシ タイキ)
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
・研究領域:神経内科学、核酸医薬
問い合わせ先
<研究に関すること>
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野 横田 隆徳 (ヨコタ タカノリ)
E-mail:tak-yokota.nuro[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
大阪大学薬学研究科庶務係
〒565-0871 吹田市山田丘1-6
E-mail:yakugaku-syomu[@]office.osaka-u.ac.jp
科学技術振興機構 広報課
〒102-8666 東京都千代田区四番町5番地3
E-mail:jstkoho[@]jst.go.jp
<JST事業に関すること>
科学技術振興機構 創発的研究推進部
加藤 豪(カトウ ゴウ)
〒102-8666 東京都千代田区四番町5番地3
E-mail:souhatsu-inquiry[@]jst.go.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

