「 アルドステロン産生腺腫の腫瘍内不均一性を単一核レベルで解明 」【山田哲也 教授、村上正憲 助教】
公開日:2024.1.18
「 アルドステロン産生腺腫の腫瘍内不均一性を単一核レベルで解明 」
― 二次性高血圧症の原因となる内分泌腫瘍の発症メカニズム解明に新たな視点 ―
― 二次性高血圧症の原因となる内分泌腫瘍の発症メカニズム解明に新たな視点 ―

ポイント
- シングル核解析によってアルドステロン産生腺腫が多彩な分化レベルの細胞で構成された不均一な集団であることが解明されました。
- 本研究の発展によって、二次性高血圧・糖尿病の原因の一つである原発性アルドステロン症の病態解明および予防・治療法の開発などにつながることが期待されます。
東京医科歯科大学 大学院医歯学総合研究科 分子内分泌代謝学分野の村上正憲助教、原一成大学院生、池田賢司准教授、山田哲也教授らは、二次性高血圧症の重要な原因疾患であるアルドステロン産生腺腫の組織を単一核レベルで初めて解析し、腫瘍内不均一性があることを解明しました。
アルドステロン産生腺腫は、副腎皮質ホルモンの一種であるアルドステロンを自律分泌する内分泌腫瘍であり、原発性アルドステロン症の病型の一つとして重症高血圧や糖尿病の原因となることが知られています。これまでアルドステロン産生腺腫の組織にはホルモン合成能に差のある細胞が混在していることが予想されていました。今回、腫瘍組織の遺伝子発現パターンを単一核レベルで詳細に解析することにより、アルドステロン産生腺腫がホルモン合成能の分化度の観点で多様な細胞が含まれた不均一な集団であることを証明し、それらの細胞が腫瘍内での分化過程の各段階を示している可能性を明らかにしました。この知見は、アルドステロン産生腺腫の発症メカニズム解明に新たな視点をもたらすもので、本研究の発展によって、二次性高血圧・糖尿病の原因の一つである原発性アルドステロン症の病態解明および予防・治療法の開発などにつながる可能性があります。
本研究は、国立研究開発法人科学技術振興機構(JST)ムーンショット型研究開発事業(目標2「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現」)、日本学術振興会科学研究費助成事業(基盤研究C)、公益財団法人日本応用酵素協会(成人病の病因・病態の解明に関する研究助成)の支援を受けて実施されました。 本研究成果は米国科学誌「Hypertension」の2月号に掲載されました。
アルドステロン産生腺腫は、副腎皮質ホルモンの一種であるアルドステロンを自律分泌する内分泌腫瘍であり、原発性アルドステロン症の病型の一つとして重症高血圧や糖尿病の原因となることが知られています。これまでアルドステロン産生腺腫の組織にはホルモン合成能に差のある細胞が混在していることが予想されていました。今回、腫瘍組織の遺伝子発現パターンを単一核レベルで詳細に解析することにより、アルドステロン産生腺腫がホルモン合成能の分化度の観点で多様な細胞が含まれた不均一な集団であることを証明し、それらの細胞が腫瘍内での分化過程の各段階を示している可能性を明らかにしました。この知見は、アルドステロン産生腺腫の発症メカニズム解明に新たな視点をもたらすもので、本研究の発展によって、二次性高血圧・糖尿病の原因の一つである原発性アルドステロン症の病態解明および予防・治療法の開発などにつながる可能性があります。
本研究は、国立研究開発法人科学技術振興機構(JST)ムーンショット型研究開発事業(目標2「2050年までに、超早期に疾患の予測・予防をすることができる社会を実現」)、日本学術振興会科学研究費助成事業(基盤研究C)、公益財団法人日本応用酵素協会(成人病の病因・病態の解明に関する研究助成)の支援を受けて実施されました。 本研究成果は米国科学誌「Hypertension」の2月号に掲載されました。
研究の背景
原発性アルドステロン症(PA)※1は二次性高血圧・糖尿病の原因疾患として有名であり、副腎皮質ホルモンの一種であるアルドステロンの過剰分泌を原因とした内分泌疾患です。PAは本態性高血圧症と比較して心血管合併症発症のリスクが高いため、早期の診断・治療が必要と考えられています。PAの約3割はアルドステロン産生腺腫(APA)と呼ばれる副腎皮質細胞由来の腫瘍が原因で、病勢が強い一方で外科治療による緩解が期待できます。研究グループは、APA発症メカニズムを解明することが本疾患の早期診断、新規治療法の開発につながると考え、病態解析を継続して行ってきました(文献1-5)。APAの腫瘍組織にはカリウムチャネルをコードするKCNJ5遺伝子をはじめとした特異的な遺伝子変異を認め、アルドステロン過剰分泌の原因の一つであると考えられています。研究グループは、APAが腫瘍組織の有する体細胞変異ごとに遺伝子発現やDNAメチル化などの分子生物学的特徴が大きく変わることを明らかにしてきました。一方で、APAの遺伝子変異の頻度としては最多を占めるKCNJ5遺伝子変異を有するAPAのみに注目した場合でも、症例毎にアルドステロン合成酵素(CYP11B2)の発現パターンに差があることがわかっており、体細胞変異の種類では症例毎の不均一性が説明できない状況がありました。
近年、組織レベルではなく単一細胞レベルでの詳細な遺伝子発現解析を可能にするシングルセル/核解析 (single-cell/nucleus RNA-sequence) ※2が可能になり、悪性腫瘍をはじめとした疾患の病態解析に利用されています。ホルモン合成能を特徴とする内分泌疾患の解析にも有用と考えられますが、報告例は少数にとどまります。今回、研究グループはAPAを対象にしたsingle-nucleus RNA-sequence(snRNA-seq)に初めて挑戦し、腫瘍内不均一性の評価を通じて症例毎の特徴を明らかにすることを目指しました(図1)。
近年、組織レベルではなく単一細胞レベルでの詳細な遺伝子発現解析を可能にするシングルセル/核解析 (single-cell/nucleus RNA-sequence) ※2が可能になり、悪性腫瘍をはじめとした疾患の病態解析に利用されています。ホルモン合成能を特徴とする内分泌疾患の解析にも有用と考えられますが、報告例は少数にとどまります。今回、研究グループはAPAを対象にしたsingle-nucleus RNA-sequence(snRNA-seq)に初めて挑戦し、腫瘍内不均一性の評価を通じて症例毎の特徴を明らかにすることを目指しました(図1)。
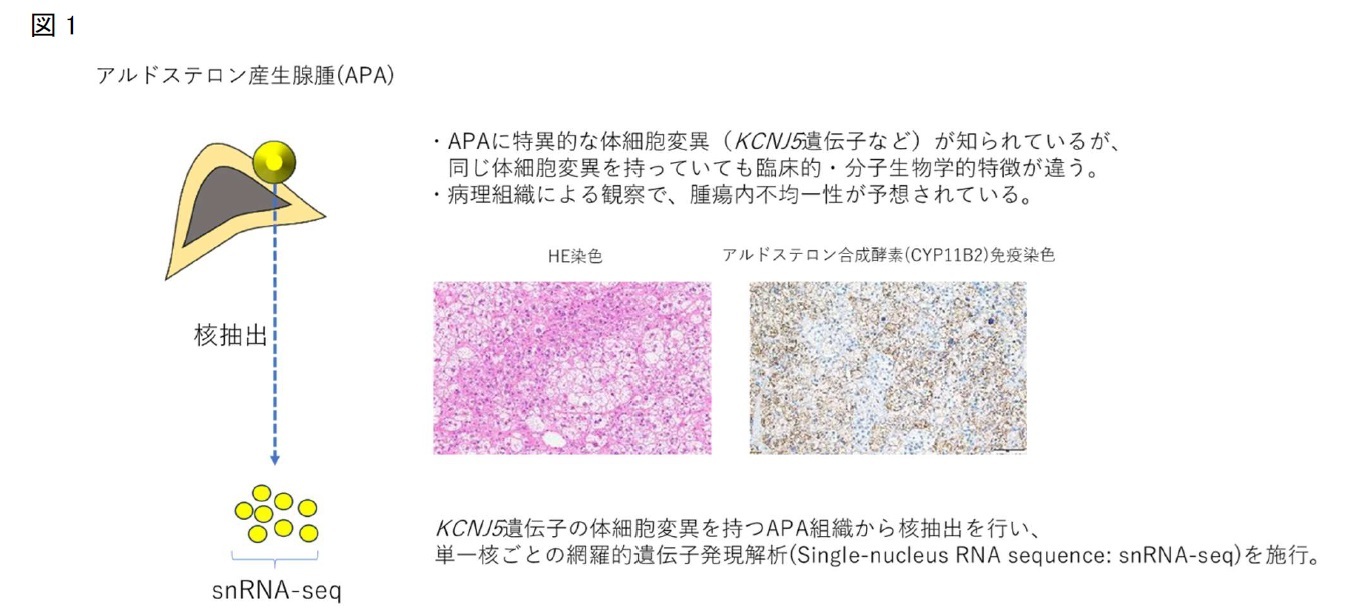
研究成果の概要
当院で入院歴のあるPA症例のうち、副腎腫瘍摘出術が施行されたKCNJ5遺伝子変異を有するAPAの3症例と、ホルモン分泌能のない非機能性腺腫(NFA)2症例を解析対象としました。各腫瘍組織から核抽出を行い、合計で20795個の単一核を対象にsnRNA-seqを行いました。核集団は合計で13個のクラスターに分けることができ、APA3症例毎に異なったクラスターが優位になることがわかりました。またAPA3症例のうち2症例はNFAと共通する副腎皮質由来細胞のクラスターを有しており、これらのクラスターではCYP11B2遺伝子発現量が低く、アルドステロン合成能が低い細胞集団の特徴を反映していると考えられました(図2)。さらに核集団のデータを元に、擬似時系列解析を行うことでAPA組織内の細胞の分化過程を推定しました。アルドステロン合成を特徴とするAPAの臨床的特徴に合致して、CYP11B2遺伝子の発現量の増加に沿った分化過程が描出されました。この分化過程では、アルドステロン合成の上流で働くステロイド合成酵素をコードするHSD3B2遺伝子やCYP21A2遺伝子の発現上昇も伴っていることから、一細胞レベルでアルドステロン合成が成立する方向性が示されました。ステロイド合成酵素以外では、副腎皮質細胞の増殖に関与するWNTシグナル経路のCTNNB1遺伝子の発現上昇も確かめられました。さらに擬似時系列解析ではAPA腫瘍内に想定される分化過程が2方向(fate1, fate2)に分岐することが示されており、fate 1ではリボソームや神経変性疾患に関連のある遺伝子の発現上昇が、fate2では解糖系に関連する遺伝子の発現上昇が特徴的でした(図3)。
単一核レベルでの評価を行うことで、APA腫瘍内が多彩な分化レベルの細胞で構成された不均一な集団であることが分かりました。また同一の体細胞変異(KCNJ5遺伝子変異)を有するAPAを比較したにも関わらず、遺伝子発現パターンに相違のある分化過程が推定されました。APA細胞としてアルドステロン合成能が上昇している点は共通していますが、発症に至る分化過程には複数の経路が存在する可能性を示すことができました。
単一核レベルでの評価を行うことで、APA腫瘍内が多彩な分化レベルの細胞で構成された不均一な集団であることが分かりました。また同一の体細胞変異(KCNJ5遺伝子変異)を有するAPAを比較したにも関わらず、遺伝子発現パターンに相違のある分化過程が推定されました。APA細胞としてアルドステロン合成能が上昇している点は共通していますが、発症に至る分化過程には複数の経路が存在する可能性を示すことができました。
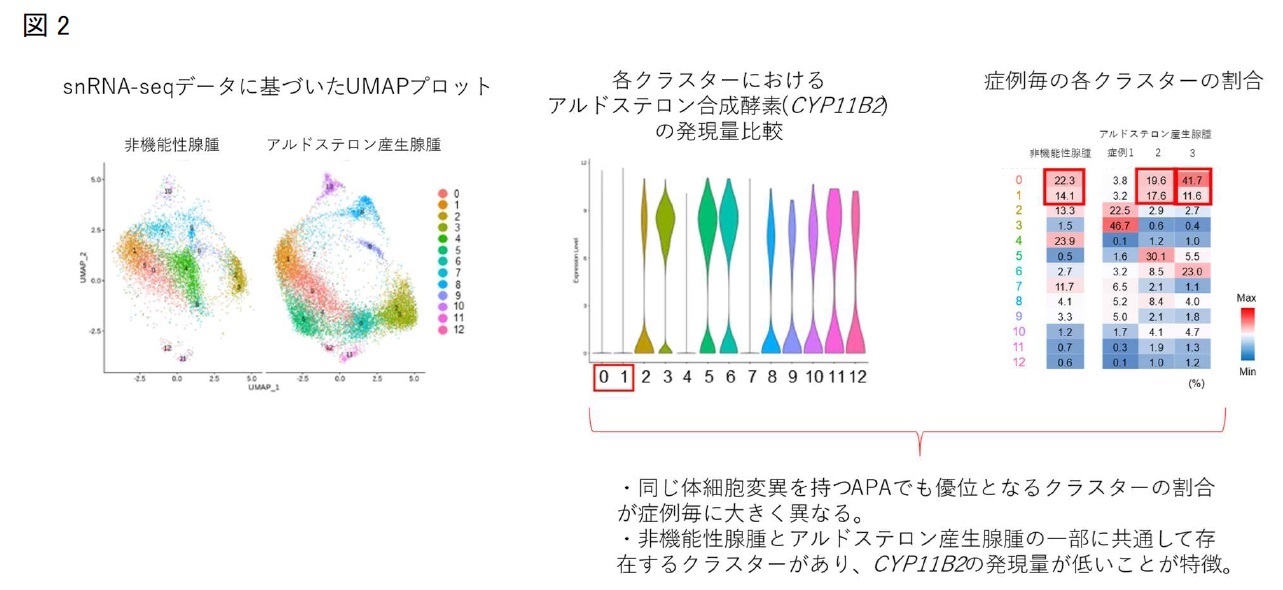
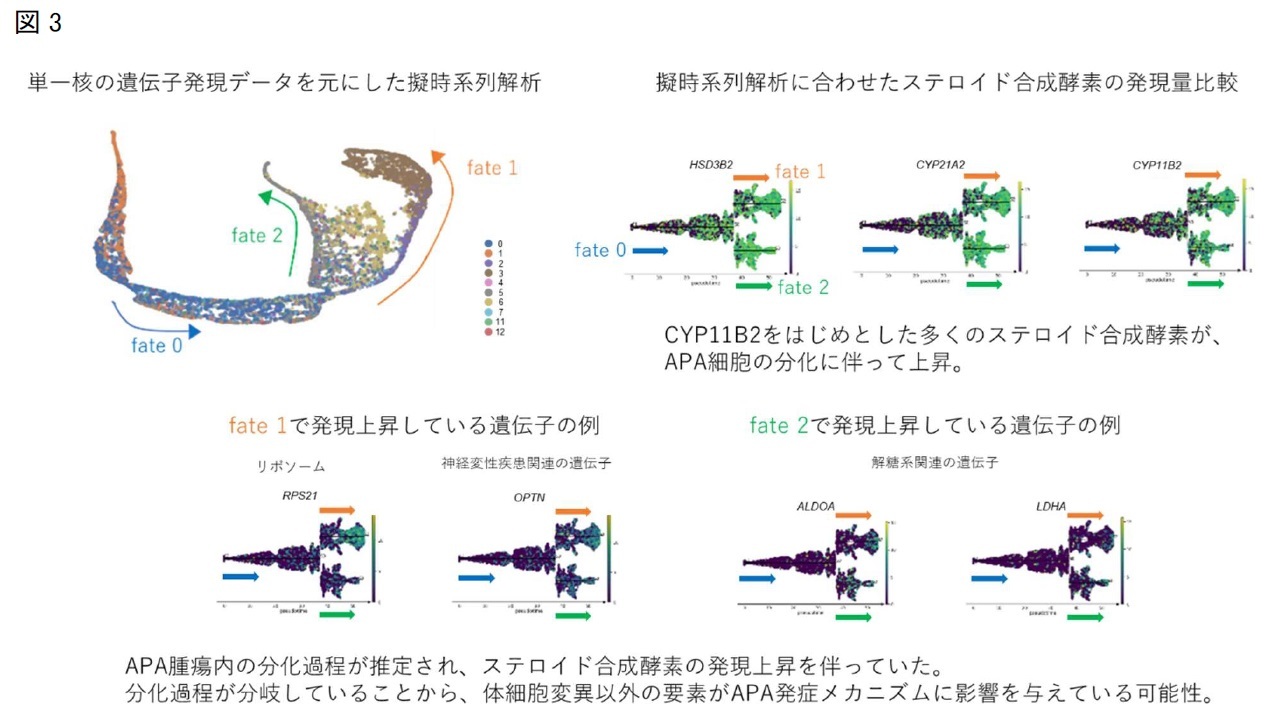
研究成果の意義
本研究成果は、不明点の多いAPAの発症メカニズム解明に向け、新たな知見を与えるものです。APAとNFAが類似した細胞集団を有する場合があるということは、副腎皮質細胞が増殖して腺腫形成するメカニズムについては両者に共通している可能性があります。また、同一の体細胞変異を有する場合でも症例ごとに分化過程に差があるということは、体細胞変異以外の要素がAPA発症メカニズムに影響を与えていることを示唆します。今後、本研究で推定された腫瘍内の分化過程の証明などを行い、研究を発展させることで、二次性糖尿病の原因の一つである原発性アルドステロン症の病態解明および予防・治療法の開発などにつながる可能性があります。
参考文献
1) Murakami M, Yoshimoto T, Nakabayashi K, Tsuchiya K, Minami I, Bouchi R, Izumiyama H, Fujii Y, Abe K, Tayama C, Hashimoto K, Suganami T, Hata K, Kihara K, Ogawa Y.
Integration of transcriptome and methylome analysis of aldosterone-producing adenomas.
Eur J Endocrinol. 2015 Aug;173(2):185-95.
2) Murakami M, Yoshimoto T, Nakano Y, Tsuchiya K, Minami I, Bouchi R, Fujii Y, Nakabayashi K, Hashimoto K, Hata KI, Kihara K, Ogawa Y.
Expression of inflammation-related genes in aldosterone-producing adenomas with KCNJ5 mutation.
Biochem Biophys Res Commun. 2016 Aug 5;476(4):614-619.
3) Murakami M, Yoshimoto T, Nakabayashi K, Nakano Y, Fukaishi T, Tsuchiya K, Minami I, Bouchi R, Okamura K, Fujii Y, Hashimoto K, Hata KI, Kihara K, Ogawa Y.
Molecular characteristics of the KCNJ5 mutated aldosterone-producing adenomas.
Endocr Relat Cancer. 2017 Oct;24(10):531-541.
4) Nakano Y, Yoshimoto T, Watanabe R, Murakami M, Fukuda T, Saito K, Fujii Y, Akashi T, Tanaka T, Yamada T, Naruse M, Ogawa Y.
miRNA299 involvement in CYP11B2 expression in aldosterone-producing adenoma.
Eur J Endocrinol. 2019 Jul 1;181(1):69-78.
5) Murakami M, Rhayem Y, Kunzke T, Sun N, Feuchtinger A, Ludwig P, Strom TM, Gomez-Sanchez C, Knösel T, Kirchner T, Williams TA, Reincke M, Walch AK, Beuschlein F.
In situ metabolomics of aldosterone-producing adenomas.
JCI Insight. 2019 Sep 5;4(17):e130356.
Integration of transcriptome and methylome analysis of aldosterone-producing adenomas.
Eur J Endocrinol. 2015 Aug;173(2):185-95.
2) Murakami M, Yoshimoto T, Nakano Y, Tsuchiya K, Minami I, Bouchi R, Fujii Y, Nakabayashi K, Hashimoto K, Hata KI, Kihara K, Ogawa Y.
Expression of inflammation-related genes in aldosterone-producing adenomas with KCNJ5 mutation.
Biochem Biophys Res Commun. 2016 Aug 5;476(4):614-619.
3) Murakami M, Yoshimoto T, Nakabayashi K, Nakano Y, Fukaishi T, Tsuchiya K, Minami I, Bouchi R, Okamura K, Fujii Y, Hashimoto K, Hata KI, Kihara K, Ogawa Y.
Molecular characteristics of the KCNJ5 mutated aldosterone-producing adenomas.
Endocr Relat Cancer. 2017 Oct;24(10):531-541.
4) Nakano Y, Yoshimoto T, Watanabe R, Murakami M, Fukuda T, Saito K, Fujii Y, Akashi T, Tanaka T, Yamada T, Naruse M, Ogawa Y.
miRNA299 involvement in CYP11B2 expression in aldosterone-producing adenoma.
Eur J Endocrinol. 2019 Jul 1;181(1):69-78.
5) Murakami M, Rhayem Y, Kunzke T, Sun N, Feuchtinger A, Ludwig P, Strom TM, Gomez-Sanchez C, Knösel T, Kirchner T, Williams TA, Reincke M, Walch AK, Beuschlein F.
In situ metabolomics of aldosterone-producing adenomas.
JCI Insight. 2019 Sep 5;4(17):e130356.
用語解説
※1原発性アルドステロン症: 副腎皮質から、ステロイドホルモンの1種であるアルドステロンが自律的に過剰分泌する疾患。過剰分泌されたアルドステロンの影響で二次性高血圧・糖尿病などの代謝異常や低カリウム血症が発症する。高血圧症全体の約10%を占めるとも言われ、本態性高血圧症と比較して心血管合併症のリスクが上昇する。片側の副腎皮質に発症したアルドステロン産生腺腫が原因となる片側性と、副腎皮質過形成が原因とされる両側性(特発性アルドステロン症)に病型が分かれる。一般に片側性の方が重症であることが多いが、外科手術(副腎摘出術)によって治癒が期待できることから、病型を含めた早期診断が望まれる。病型診断にはカテーテルを用いた副腎静脈サンプリングが必須だが、侵襲性があること、難易度が高いこと、高コストなどの課題があり、新規診断法の開発が望まれている。
※2シングルセル/核解析(single-cell/nucleus RNA-sequence)
従来はまとまった組織レベルでの細胞集団からRNAを抽出して遺伝子発現解析を行うことが主流であったが、異なる細胞集団の平均値としての結果しか評価できず、そこに含まれる多様な細胞の特徴を反映する十分な解像度のデータ取得が困難であった。近年の技術革新により、組織から細胞ないし核を単離抽出し、一細胞における網羅的な遺伝子発現量のデータ取得が可能になった。
※2シングルセル/核解析(single-cell/nucleus RNA-sequence)
従来はまとまった組織レベルでの細胞集団からRNAを抽出して遺伝子発現解析を行うことが主流であったが、異なる細胞集団の平均値としての結果しか評価できず、そこに含まれる多様な細胞の特徴を反映する十分な解像度のデータ取得が困難であった。近年の技術革新により、組織から細胞ないし核を単離抽出し、一細胞における網羅的な遺伝子発現量のデータ取得が可能になった。
論文情報
掲載誌:Hypertension
論文タイトル:Single-Nucleus Analysis Reveals Tumor Heterogeneity of Aldosterone-Producing Adenoma
DOI:https://doi.org/10.1161/HYPERTENSIONAHA.123.21446
研究者プロフィール

山田 哲也 (ヤマダ テツヤ) Tetsuya Yamada
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 教授
・研究領域
糖尿病・代謝学、内分泌学
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 教授
・研究領域
糖尿病・代謝学、内分泌学

村上 正憲 (ムラカミ マサノリ) Masanori Murakami
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 助教
・研究領域
糖尿病・代謝学、内分泌学
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 助教
・研究領域
糖尿病・代謝学、内分泌学

原 一成 (ハラ カズナリ) Kazunari Hara
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 大学院生
・研究領域
糖尿病・代謝学、内分泌学
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 大学院生
・研究領域
糖尿病・代謝学、内分泌学

池田 賢司 (イケダ ケンジ) Kenji Ikeda
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 准教授
・研究領域
糖尿病・代謝学、内分泌学
東京医科歯科大学 大学院医歯学総合研究科
分子内分泌代謝学分野 准教授
・研究領域
糖尿病・代謝学、内分泌学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子内分泌代謝学分野 村上 正憲(ムラカミ マサノリ)
山田 哲也(ヤマダ テツヤ)
E-mail:mmurakami.mem[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

