「 インターロイキン18がブルーリ潰瘍の病態進行を抑制することを発見 」【鈴木敏彦 教授】
公開日:2023.11.2
「 インターロイキン18がブルーリ潰瘍の病態進行を抑制することを発見 」
―マイコラクトン毒素の生物活性と宿主応答の攻防を解明―
―マイコラクトン毒素の生物活性と宿主応答の攻防を解明―

ポイント
- アフリカおよびオーストラリアで流行しているブルーリ潰瘍の発症機構の一端が解明されました。
- 起因菌が産生するマイコラクトン毒素の生物活性と宿主サイトカインの役割が明らかになりました。
- 本学が設置しているガーナ拠点における感染症研究の推進に貢献しました。
東京医科歯科大学 大学院医歯学総合研究科 細菌感染制御学分野の鈴木敏彦教授の研究グループは、国立感染症研究所ハンセン病研究センター、東京理科大学、ガーナ大学野口記念医学研究所との共同研究で、ブルーリ潰瘍起因菌が産生するマイコラクトン毒素の生物活性と宿主サイトカインの役割を明らかにしました。この研究は文部科学省科学研究費補助金ならびに日本医療研究開発機構(AMED)新興・再興感染症研究基盤創生事業(海外拠点研究領域、拠点活用研究領域)、ガーナにおける石油開発合弁事業T.E.N. Ghana MV25 B.V.による研究費支援のもとで実施されたもので、その研究成果は、国際専門誌PLOS Pathogensに、2023年11月1日にオンライン版で発表されました。
研究の背景
ブルーリ潰瘍 (Buruli ulcer)は、「顧みられない熱帯感染症 (Neglected Tropical Diseases)」のひとつとして世界保健機関WHOが重点的に疾病対策を展開している細菌感染症です。ガーナをはじめとした西アフリカ諸国で、近年はオーストラリアで流行する本疾患の起因菌は抗酸菌の一種Mycobacterium ulceransです(図1)。日本においても1980年代に初めて患者が報告されて以来、症例が増えています(国立感染症研究所、感染症情報2018)。国内での起因菌としてM. ulcerans subsp. (亜種) shinshuenseが同定されています。本菌は主に水系環境が原因でヒト皮膚に感染すると考えられていますが、自然界におけるリザーバーの有無、感染伝播の様式、感染によって生じる皮膚潰瘍の病態機序はいまだ謎に包まれています。現在、ガーナ大学野口医学研究所と共同でガーナの流行地域での現地調査を実施し、自然界における本菌の生活環を探索しています。一方で、病原因子として宿主のSec61※1に依存するタンパク分泌経路を阻害する活性をもつマイコラクトン※2が知られています。しかし、炎症性サイトカインであるIL-1βおよびIL-18はSec61とは別経路で分泌されることから、感染に伴って誘導・分泌されると考えられていました。そこで本研究では、各種遺伝子欠損マウスを用いて、本菌によるサイトカイン産生機構と病態における役割を解析しました。
研究成果の概要
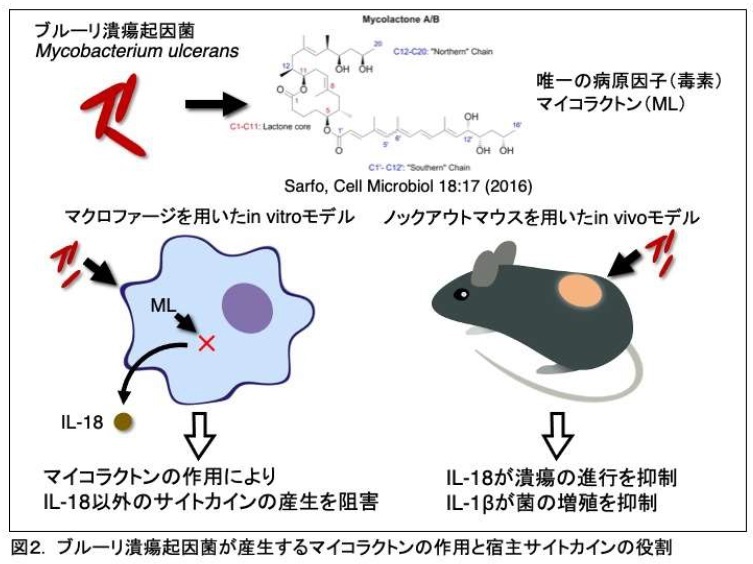
M. ulceransの亜種shishuenseを感染させたマクロファージにおいて、IL-1βをはじめとするサイトカイン誘導は、マイコラクトンにより転写レベルで抑制されることがはじめて明らかになりました。一方で、菌が感染するとマイコラクトンとは無関係に細胞死が誘導され、それに伴ってインフラマゾーム※3とカスパーゼ-1※4の活性化が誘導されます。興味深いことに、もともと定常的に産生されているIL-18は活性化したカスパーゼ-1により切断され、生物学的に活性のある成熟IL-18が分泌されました。次に、ブルーリ潰瘍の発症におけるこれらのサイトカインの役割を調べるため、IL-18およびIL-1β欠損マウスを用いた皮膚潰瘍モデルを構築しました。その結果、IL-18欠損マウスで皮膚潰瘍の増悪化を示したことからIL-18は潰瘍の進行を抑制することが明らかになりました。 一方、IL-1β欠損マウスでは皮膚組織における菌の増殖促進を認めたことから、IL-1βは感染した菌の組織内増殖を抑制する働きがあることがわかりました。マクロファージを用いた試験管内感染実験ではIL-1βの産生は阻害されていたものの、実際の感染の場ではIL-1βによる増殖抑制効果があると考えられます(図2)。
研究成果の意義
以上の成果は、ブルーリ潰瘍の発症病理におけるサイトカインの誘導機構と機能に関する新たな知見をもたらし、疾患発症のメカニズム解明に重要な情報となりました。また、本学が設置するガーナ拠点における感染症研究のひとつとして、野口記念医学研究所との共同研究の推進に貢献しました。
一般的に、インフラマゾームを介したカスパーゼ-1の活性化はIL-1βとIL-18両方を活性化することが知られており、これまで病原体感染においてこれらのサイトカインの活性化は同時に誘導されると考えられていました。本研究で明らかになった、M. ulceransの感染に伴ってIL-18のみが選択的に産生される事例は前例がなく、病原体と宿主免疫との攻防を明らかにしていく上で重要な発見といえます。
一般的に、インフラマゾームを介したカスパーゼ-1の活性化はIL-1βとIL-18両方を活性化することが知られており、これまで病原体感染においてこれらのサイトカインの活性化は同時に誘導されると考えられていました。本研究で明らかになった、M. ulceransの感染に伴ってIL-18のみが選択的に産生される事例は前例がなく、病原体と宿主免疫との攻防を明らかにしていく上で重要な発見といえます。
用語解説
※1Sec61
宿主細胞の小胞体にあり、細胞質で翻訳されたタンパクを小胞体へ移送させるタンパク複合体を形成する。
※2マイコラクトン
M. ulceransをはじめとした一部の抗酸菌が産生する環状ラクトン毒素。ブルーリ潰瘍起因菌が産生する病原因子として唯一同定されている。
※3インフラマゾーム
病原体の感染、宿主代謝産物を感知する細胞質内センサー分子等によって形成されるタンパク複合体。カスパーゼ-1の活性化を誘導する。
※4カスパーゼ-1
宿主プロテアーゼの一種、インフラマゾーム活性化に伴って分子内切断が生じ、活性化型に変換する。
宿主細胞の小胞体にあり、細胞質で翻訳されたタンパクを小胞体へ移送させるタンパク複合体を形成する。
※2マイコラクトン
M. ulceransをはじめとした一部の抗酸菌が産生する環状ラクトン毒素。ブルーリ潰瘍起因菌が産生する病原因子として唯一同定されている。
※3インフラマゾーム
病原体の感染、宿主代謝産物を感知する細胞質内センサー分子等によって形成されるタンパク複合体。カスパーゼ-1の活性化を誘導する。
※4カスパーゼ-1
宿主プロテアーゼの一種、インフラマゾーム活性化に伴って分子内切断が生じ、活性化型に変換する。
論文情報
掲載誌:PLOS Pathogens
論文タイトル:Inflammasome-triggered IL-18 controls skin inflammation in the progression of Buruli ulcer
DOI:https://doi.org/10.1371/journal.ppat.1011747
研究者プロフィール

鈴木 敏彦 (スズキ トシヒコ) Toshihiko Suzuki
東京医科歯科大学 大学院医歯学総合研究科
細菌感染制御学分野 教授、ガーナ拠点長
・研究領域
感染免疫学
感染症学
東京医科歯科大学 大学院医歯学総合研究科
細菌感染制御学分野 教授、ガーナ拠点長
・研究領域
感染免疫学
感染症学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
細菌感染制御学分野 鈴木 敏彦(スズキ トシヒコ)
E-mail:info.bact[at]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[at]tmd.ac.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。

