「 ロングリードシークエンス法を用いた21水酸化酵素欠損症の遺伝子検査法の開発 」【鹿島田健一 准教授】
国立大学法人東京医科歯科大学
公益財団法人かずさDNA研究所
国立研究開発法人日本医療研究開発機構

― 遺伝学的診断を研究レベルから診断目的の検査応用へ道を開く ―

ポイント
- 近年開発された新たな塩基配列決定法であるロングリードシークエンス法(オックスフォードナノポアテクノロジーズ社、MinION®)を用いて、21水酸化酵素欠損症の遺伝子検査法を開発しました。
- これまで、本疾患の遺伝子の解析は、偽遺伝子が隣接するため複雑な解析を必要としました。本法を用いることで、本疾患の遺伝子検査を廉価かつ容易に行うことができます。
- これにより本疾患の精度の高い遺伝子検査として、研究レベルではなく、診断目的の検査応用への道を開きました。
- 本法を応用し、本疾患と同様に偽遺伝子が隣接し、解析困難な遺伝性疾患の廉価かつ簡便な検査法の開発が可能となります。
研究の背景
コルチゾルは生命維持に必須のホルモンであり、先天的にコルチゾル不足が生じる本疾患では、適切な治療がなされない場合乳児期早期に死亡することもあります。またコルチゾル不足を補うために大量に男性ホルモンが副腎より産生されるため、女性では外性器が男性化します。このため、出生児に外性器の形から性別が判定しづらくなり、性別誤認につながる恐れがあります。本疾患は、新生児マススクリーニングの対象疾患であり、国内ではほぼ100%の患者さんは新生児期に発見され、早期より薬物治療(コルチゾルの補充)を含めた医療的介入がなされています。そのため、現在国内では乳幼児期に死亡する患者さんや、性別が誤って判断される方々はほとんどいません。
一方、新生児スクリーニングで陽性となった新生児のうち実際に本疾患であるお子さんは一部(10-40%)であり、正確な確定診断を必要とします。しかし、診断には専門性の高い内分泌学的検査を必要とし、検査は可能な施設が限られます。さらに多量の血液検体とすることがあり、生まれたばかりの赤ちゃんにとって負担となる上、保険診療ではカバーしきれない検査が必要となることもあります。
本疾患は遺伝性の疾患であり、CYP21A2遺伝子という遺伝子を調べることで診断することも可能です。遺伝子検査は少量の血液で可能であり、結果も明確です。さらに遺伝相談にも使用できる利点があります。しかし今日まで、遺伝子検査は限られた研究施設のみで行われ、広く普及していませんでした。原因遺伝子であるCYP21A2が、それとそっくりな構造をもち全く機能しない偽遺伝子(CYP21A1P)と隣り合わせに存在するためです。病気の原因となる遺伝子の変化(病的多型)の大半はこの二つの遺伝子間の組換えの結果生じる多型が複雑な構造をもつため、解析が容易ではありません。CYP21A2の塩基配列を選択的に調べると同時に、組み換えによる構造異常も調べる必要があります。対象となる遺伝子をPCR法で増幅し、一般的な塩基配列決定法(Sanger法)で調べる従来の方法は、1回に読み取れる塩基配列の長さが短く(1000bp以下)本遺伝子の全ての多型を見つけることはできません。同様の理由で、ショートリード型の次世代シーケンサーでも解析困難でした。
研究成果の概要
そこで、本研究ではLRS法を用いた簡便で臨床応用可能な安価なCYP21A2解析法の開発を目指しました。
1: 本遺伝子の病的多型の種類とその可能性を鑑み、一組のPCRプライマーによる標的配列増幅、LRS法による解析のライブラリとして用いることで、作業手順を大幅に減らしました。
2: LRS法の解析として廉価であることで知られるオックスフォードナノポアテクノロジーズ(ONT)社のMinION® システム (Flongleフローセル、R9.4.1)を用いました。懸念される精度の低さは、PCR産物を解析に用いることでリード数を上げ、解決しました。さらに検体にバーコードを紐付け1回の測定できる検体数を最大24検体まで増やしました。
3: 本法の信頼度を、従来最も信頼できる方法であるMLPA法※2とNested PCR法※3を組み合わせた解析方法と比較することで検証しました。対象は本疾患と診断がついた55名110アレルで、全ての結果が双方で一致しました。
4: これまで本疾患の原因として知られていなかった2つの病的多型を新たに同定しました。
5: Duplexベースコール法という新たな方法を用いた最新のONT社MinION® システム(Flongleフローセル、R10.4.1)で同様の試験を行なったところ、さらに高い精度での結果が得られました。特に同一塩基が並ぶ単純配列でのバリアント検出では、R9.4.1と比較し、著明な精度の改善を認めました。
6: 1検体あたりにかかる解析費用は、従来のMLPA法とNested PCR法と比較しても廉価であり、かつ解析にかかる日数も2-3日から1日と減らすことができました。また従来のMLPA法とNested PCR法では正確な多型を決定する上で両親の検体と合わせて3検体の解析が必要でしたが、本法は本人のみの解析で多型の決定が可能であり、その点を加味すれば実際の費用の抑制はさらに大きくなります。
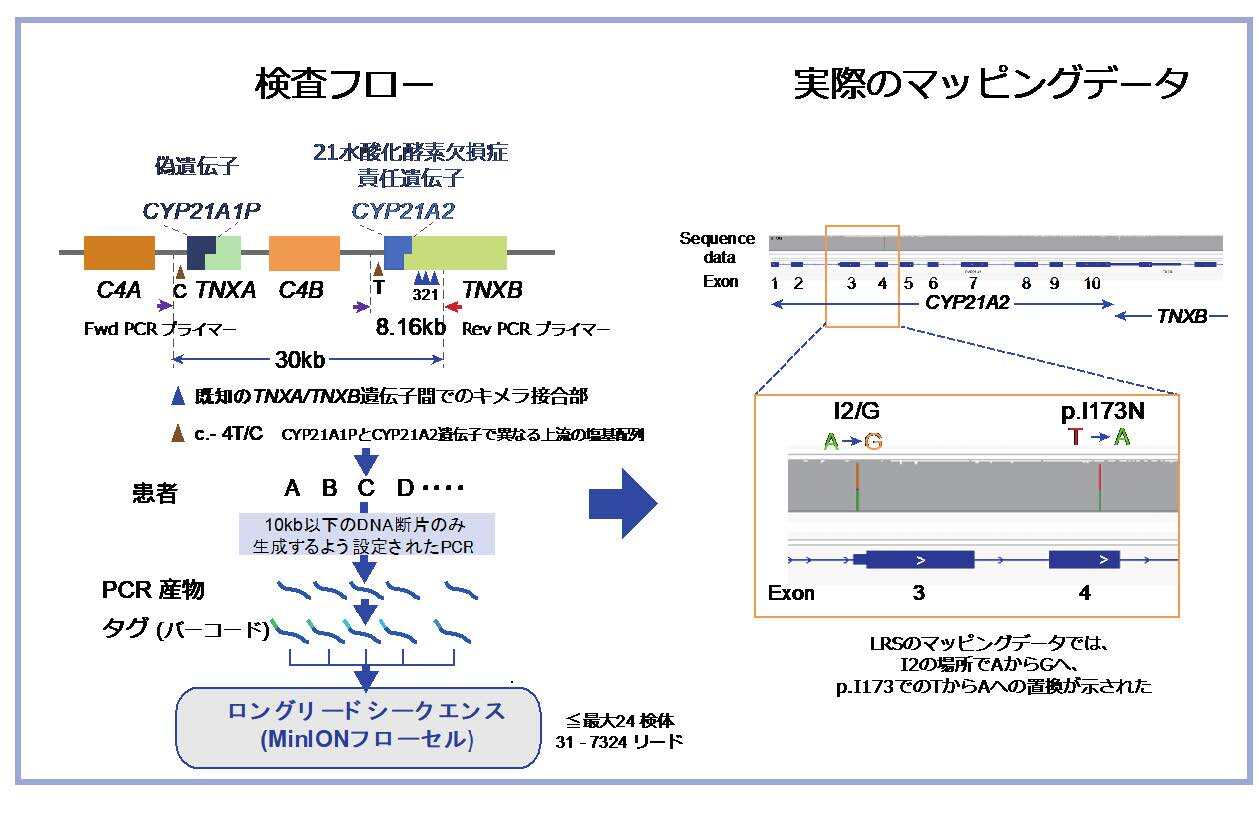
図1 本研究の流れとLRSによるマッピングデータ
研究成果の意義
1: LRS法を用いた高精度、低価格、簡便な遺伝子検査技術を実現しました。今後本疾患の遺伝子解析の診断目的の検体検査応用への道を開きました。
2: 本法を応用し、本疾患と同様に偽遺伝子が隣接し、解析困難な遺伝性疾患の廉価かつ簡便な検査法の開発が応用可能となります。
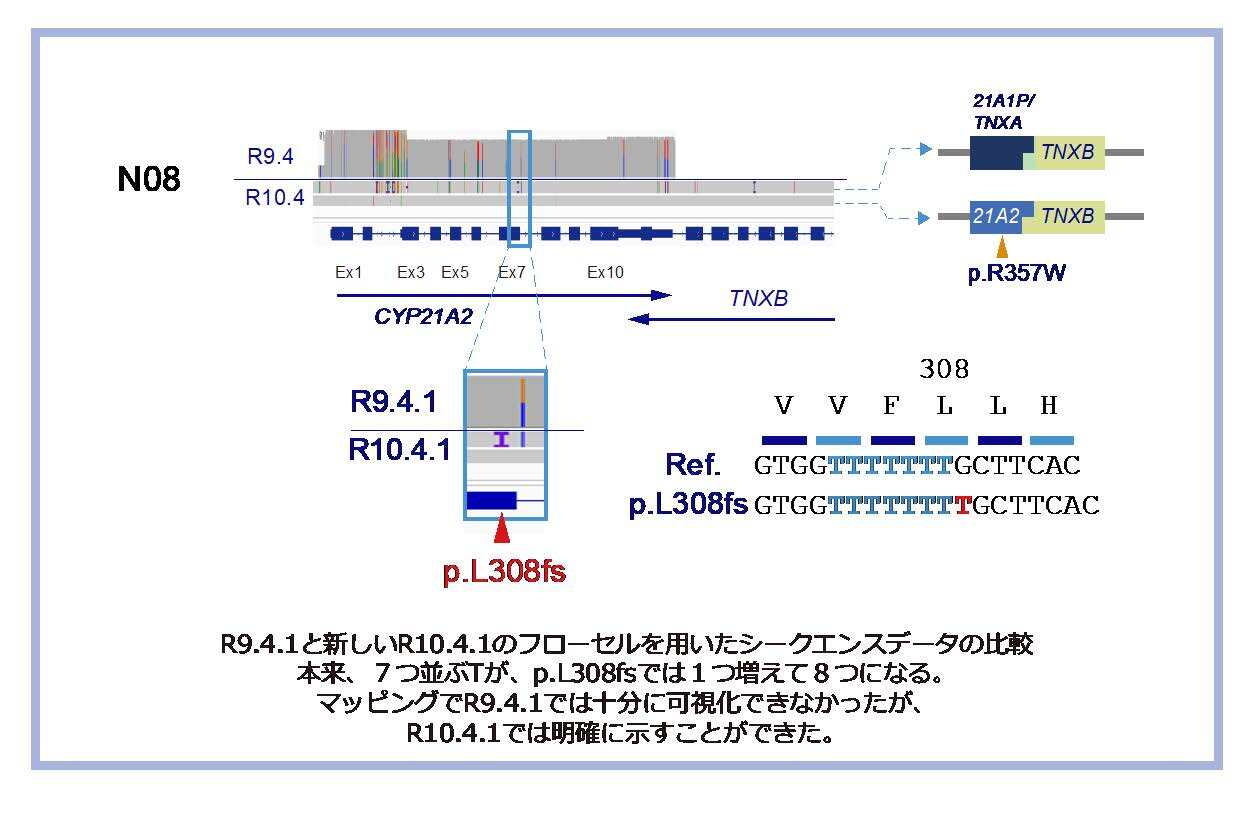
図2 Flongle フローセルR10.4.1によるシークエンス結果
用語解説
※1ロングリードシークエンス (LRS)法: 従来の方法とは全く異なる方法を用い、1回で読むことのできる塩基配列数を飛躍的に増やした塩基配列決定方法。DNAやRNA分子がポリマー製の膜に埋め込まれたタンパク質ポアを通過する際に生じる電位の変化を測定することで塩基配列を行う。従来の方法と比較して、塩基配列の多型に加え遺伝子の構造異常も合わせて把握できる、1つの長いDNA断片を読み込むことによりアレル特異的な情報を多く得ることができる(例:両親の検体と合わせて解析しなくても複合ヘテロ接合性の多型を決定, 等)、といった利点がある。大きく分けて2つのシステムがあり、それぞれ開発した会社より販売されている。精度が高いとされるパックバイオ社のシステムは少数検体では解析単価が高額となり、五月雨式に寄せられる少数の検体を迅速に解析する必要がある臨床応用に不向きである。一方ONT社のMinIONシステムは、廉価であるものの、精度が低く、その点が遺伝子解析をする上で問題となっていた。本研究では、問題解決に向けて、より廉価なONT社の系がより実臨床応用に近いと判断し、採用の上、検査法を確立した。
※2 MLPA法 (Multiplex Ligation-dependent Probe Amplification)法は目的とする配列特異的なプローブを作成し、そのコピー数を調べる。ゲノムの位置毎のコピー数の情報が詳細に得られるため、構造異常の解析に適するが、塩基配列の多型の解析には適さない。
※3 Nested PCR法:似たような配列が複数ある標的遺伝子を解析する際に、目的となる遺伝子特異的に増幅するPCRプライマーにより対象領域を増幅し、それを鋳型としてさらに塩基配列決定のためのPCR増幅を行う方法。入れ子のように2回PCRで増幅するため、このように呼ばれる。従来21水酸化酵素欠損症は、*2,3の技術、両方を用いることで解析が行われた。さらに正確な遺伝子診断には、両親の検体も合わせて解析する必要があった。
論文情報
掲載誌:Journal of Clinical Endocrinology and Metabolism
論文タイトル: A MinION-Based Long-Read Sequencing Application with One-Step PCR for the Genetic Diagnosis of 21-Hydroxylase Deficiency
DOI:https://doi.org/10.1210/clinem/dgad577
研究者プロフィール

鹿島田 健一 (カシマダ ケンイチ) Kenichi Kashimada
東京医科歯科大学 大学院医歯学総合研究科
発生発達病態学分野 准教授
・研究領域
小児科学、内分泌学、再生医学、遺伝学

東京医科歯科大学 大学院医歯学総合研究科
発生発達病態学分野 大学院生
・研究領域
小児科学、内分泌学

かずさDNA研究所 ゲノム事業推進部
・研究領域
生物物理学、分子生物学

東京医科歯科大学 医歯学総合研究科
発生発達病態学分野 教授
・研究領域
小児科学、免疫学、再生医学、遺伝学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
発生発達病態学分野 氏名 鹿島田 健一 (カシマダ ケンイチ)
TEL:03-5803- 5249 FAX:03-5803- 5246
E-mail:kkashimada.ped[at]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[at]tmd.ac.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。

