「脊髄小脳失調症のDNA損傷修復における2つの仕組み」【岡澤 均 教授】
公開日:2023.10.12
「脊髄小脳失調症のDNA損傷修復における2つの仕組み」
―RpA1による遺伝子治療の基盤メカニズムを解明 ―
―RpA1による遺伝子治療の基盤メカニズムを解明 ―
ポイント
- RpA1※1は脊髄小脳失調症※2における強力な寿命延長効果および病態改善効果を持つことが、知られています。
- RpA1は他のRpAファミリー分子と正規型RpA1複合体(canonical RpA)あるいは代替型RpA1複合体複合体を形成するため、複合体レベルでの分子機能については、十分に解明されていませんでした。
- 今回の研究で、正規型RpA1複合体(canonical RpA)と代替型RpA1複合体(Alternative-RpA1)の間でDNA損傷修復※3機能とCAGリピート伸長への影響が異なることを明らかにしました。
- RpA1を用いた脊髄小脳失調症への遺伝子治療がCAGリピート伸長を抑制することが、さらに証明されました。
東京医科歯科大学 難治疾患研究所・神経病理学分野の岡澤均教授のグループでは、2012年にDNA損傷修復分子であるRpA1の脊髄小脳失調症1型病態への関与の可能性を、ショウジョウバエ遺伝学的スクリーニングから示し(Barclay et al, Hum Mol Genet 2012)、また、RpA1を用いた遺伝子治療の可能性について、2016年8月に論文発表を行っています(Taniguchi et al, Hum Mol Genet 2016)(2016年8月12日の東京医科歯科大学プレス発表を参照)。
さらに今回、岡澤均教授とトロント大学・小児病院のChristopher Pearson教授の共同研究グループは、DNA損傷修復においてRpA1の構成する2つの複合体に異なる機能があることを明らかにしました。その研究成果は、国際科学雑誌 Cell (IF=66.85) において2023年10月 11日にオンライン版で発表されました。
さらに今回、岡澤均教授とトロント大学・小児病院のChristopher Pearson教授の共同研究グループは、DNA損傷修復においてRpA1の構成する2つの複合体に異なる機能があることを明らかにしました。その研究成果は、国際科学雑誌 Cell (IF=66.85) において2023年10月 11日にオンライン版で発表されました。
研究の背景
脊髄小脳失調症1型は、常染色体優性の家族性の神経変性疾患です。Ataxin-1(Atxn1)という遺伝子の中のCAG塩基配列の繰り返し数(CAGリピート数)が多くなる(CAGリピート伸長)が、大元の原因であることがわかっています。日本では非常に稀な疾患で700人から2,000人程度の患者さんが罹患しているのではと言われていますが、欧米では頻度がより高いことが知られています。小脳ニューロンの変性のために、小脳失調がおきて歩行や日常動作が困難になる、あるいは一部の患者さんには、脊髄運動ニューロンの変性のために、筋力低下や筋萎縮がおきるなどの症状が知られています。現時点では、根本的な治療法は確立していませんが、岡澤教授の研究グループでは、HMGB1の遺伝子治療が有効であることを発見し(Qi et al, Nature Cell Biol 2007; Ito et al, EMBO Mol Med 2015)、東京医科歯科大学において特許を取得して、これらを基に北海道大学の矢部教授、自治医大の村松教授らと共に開発を進めています。
さらに、岡澤教授グループは脊髄小脳失調症1型の原因遺伝子(変異Atxn1)を発現する疾患モデルショウジョウバエに、病態に影響を及ぼす可能性があるDNA損傷修復遺伝子を同時に発現させて、寿命、運動機能などへの影響を調べる、病態修飾遺伝子スクリーニングを2011-2014年にかけて行い、RpA1が最も強力な寿命延長ならびに症状改善効果を持つことを発見しました(Barclay et al, Hum Mol Genet 2014)。さらに、変異Atxn1ノックインマウスにおいてAAV-RpA1が症状改善効果を持つことを報告しています(Taniguchi et al, Hum Mol Genet 2016) 。一方、RpA1はRpA2, 3, 4と3量体(複合体)を形成することが知られており、今後の治療開発のためにも、RpA1の関与する病態機能のさらに詳細な解析が待たれていました。
さらに、岡澤教授グループは脊髄小脳失調症1型の原因遺伝子(変異Atxn1)を発現する疾患モデルショウジョウバエに、病態に影響を及ぼす可能性があるDNA損傷修復遺伝子を同時に発現させて、寿命、運動機能などへの影響を調べる、病態修飾遺伝子スクリーニングを2011-2014年にかけて行い、RpA1が最も強力な寿命延長ならびに症状改善効果を持つことを発見しました(Barclay et al, Hum Mol Genet 2014)。さらに、変異Atxn1ノックインマウスにおいてAAV-RpA1が症状改善効果を持つことを報告しています(Taniguchi et al, Hum Mol Genet 2016) 。一方、RpA1はRpA2, 3, 4と3量体(複合体)を形成することが知られており、今後の治療開発のためにも、RpA1の関与する病態機能のさらに詳細な解析が待たれていました。
研究成果の概要
今回、岡澤教授グループはPearson教授グループらと共同研究を行い、RpA1が他のRpAファミリー分子とともに形成する複合体において、正規型RpA1複合体(canonical RpA)と代替型RpA1複合体(Alternative-RpA1)(図1)の間で機能が異なること、すなわち、正規型RpA1はDNA損傷修復を促進して脊髄小脳失調症の原因であるCAGリピートを維持もしくは短縮するのに対して、代替型RpA1はDNA損傷修復を阻害してCAGリピート伸長につながることを明らかにしました。
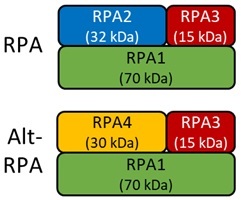
図1:正規型RpA1複合体(canonical RpA)の構成(上図)と代替型RpA1複合体(Alternative-RpA1)の構成(下図)を示す。
また、変異Atxn1ノックインマウス小脳においてAAV-RpA1がCAGリピートを短縮し、症状改善につながることも改めて確認されました(図2)。
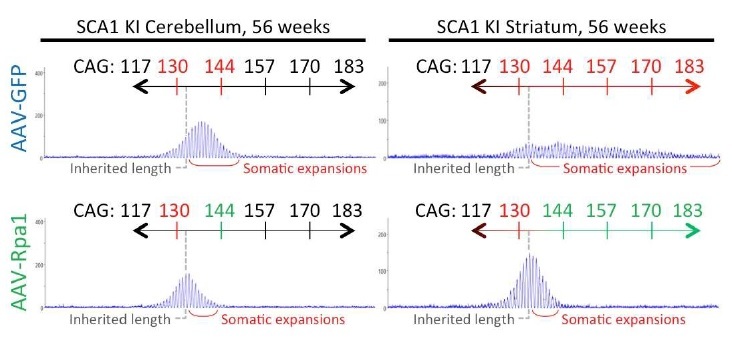
図2: 変異Atxn1ノックインマウス小脳においてAAV-RpA1を用いた治療実験によってCAGリピートが短縮する。一方、AAV-GFPではCAGリピートの短縮は見られない。線条体においても同様である。
加えて、Pearson教授グループが中心となって、RpAファミリー(RpA1, 2, 3, 4)の病態下の遺伝子発現、インタラクトームについても詳細な解析を行いました。その結果、図3に示すように、正規型RpA1複合体と代替型RpA1複合体では、DNA損傷認識後の一連の複合体形成に違いがあり、最終的にCAGリピートへの影響が異なると考えられました。
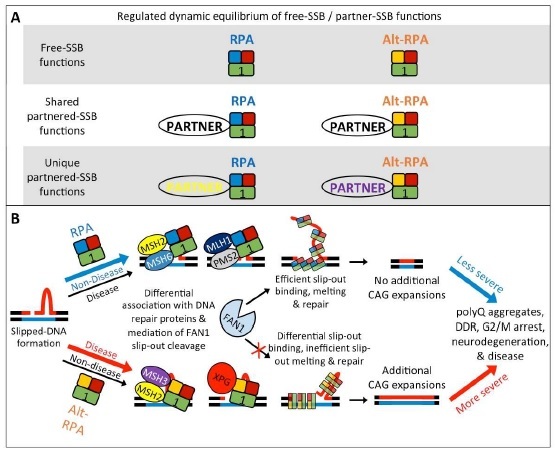
図3:正規型RpA1複合体と代替型RpA1複合体では共通する結合相手と特異的な結合相手があり(A)、その結果、RpA1複合体がCAGリピートのDNA損傷を修復する際に余分な部分の処理が変わってくる(B)。
研究成果の意義
今回の研究成果は、主に二つの点で意義があると考えられます。第一には、RpA1によるDNA損傷修復とCAGリピート体細胞変異の関係がより明確になったことです。正規型RpA1複合体と代替型RpA1複合体では、DNA損傷認識後の一連の複合体形成に違いがあり、最終的にCAGリピートへの影響が異なると考えられました。第二には、RpA1の治療効果が再度確認されたということです。AAV-RpA1による遺伝子治療は、主に正規型RpA1複合体を活性化し、これによってCAGリピート伸長を抑制することが改めて確認されました。岡澤教授はRpA1の治療応用に関する特許をすでに取得しており、今後の実用化が期待されます。
用語解説
※1 RpA1
Replication protein A 70kDa DNA-binding subunitの略称。一本鎖状態のDNAに結合して安定化する作用を持つ。一本鎖DNAはDNA損傷修復や複製の過程で、容易に相補的結合を起こしやすく、不適切な相手DNAと二本鎖を形成する可能性がある。RpA1は、このような不適切な状況を防ぐとともに、DNA損傷修復過程に欠かせないMSH, RAD51, RAD52, XPA, XPGあるいはATRIPなどを、一本鎖状態に引き寄せて、修復過程を円滑に進行する役割を果たす。
※2 脊髄小脳失調症
脊髄小脳失調症は、小脳神経細胞(プルキンエ細胞、歯状核など)の神経変性を中心として、時に大脳基底核、脊髄運動神経、網膜神経細胞、聴神経、末梢神経などの変性を合併する一群の脳疾患である。常染色体優性、常染色体劣性などの形式をとる遺伝性脊髄小脳失調症と、家族歴のはっきりしない弧発例がある。この中で、脊髄小脳失調症1型(SCA1)は、常染色体優性遺伝形式を取り、ataxin-1という原因遺伝子のタンパク翻訳部分(エキソン)の中のCAG繰り返し配列が正常よりも伸長することが原因となっている。
※3 DNA損傷と修復
ゲノムDNAとミトコンドリアDNA損傷は、普通に生活している動植物においても、内在的原因あるいは外来的・環境的原因によって常に損傷を受けている。その数は、RpA1が修復しているsingle strand DNA breaks (SDB)では1細胞あたり1日で約70,000箇所と推定され、Ku70などが修復するdouble strand DNA breaks (DSB)においては1細胞あたり1日で50箇所程度と考えられる。酸化ストレス、aldehydes and advanced glycation end products (AGEs)などは内在的原因の代表であり、生理的なRNA転写やDNA複製にいてもDNA損傷が生じる。また、様々な環境要因がDNAを損傷する。DNA損傷が修復されずに細胞に蓄積すると細胞老化、さらに個体老化につながる。またDNA損傷は、神経変性の直接的・間接的原因となることが知られている。
Replication protein A 70kDa DNA-binding subunitの略称。一本鎖状態のDNAに結合して安定化する作用を持つ。一本鎖DNAはDNA損傷修復や複製の過程で、容易に相補的結合を起こしやすく、不適切な相手DNAと二本鎖を形成する可能性がある。RpA1は、このような不適切な状況を防ぐとともに、DNA損傷修復過程に欠かせないMSH, RAD51, RAD52, XPA, XPGあるいはATRIPなどを、一本鎖状態に引き寄せて、修復過程を円滑に進行する役割を果たす。
※2 脊髄小脳失調症
脊髄小脳失調症は、小脳神経細胞(プルキンエ細胞、歯状核など)の神経変性を中心として、時に大脳基底核、脊髄運動神経、網膜神経細胞、聴神経、末梢神経などの変性を合併する一群の脳疾患である。常染色体優性、常染色体劣性などの形式をとる遺伝性脊髄小脳失調症と、家族歴のはっきりしない弧発例がある。この中で、脊髄小脳失調症1型(SCA1)は、常染色体優性遺伝形式を取り、ataxin-1という原因遺伝子のタンパク翻訳部分(エキソン)の中のCAG繰り返し配列が正常よりも伸長することが原因となっている。
※3 DNA損傷と修復
ゲノムDNAとミトコンドリアDNA損傷は、普通に生活している動植物においても、内在的原因あるいは外来的・環境的原因によって常に損傷を受けている。その数は、RpA1が修復しているsingle strand DNA breaks (SDB)では1細胞あたり1日で約70,000箇所と推定され、Ku70などが修復するdouble strand DNA breaks (DSB)においては1細胞あたり1日で50箇所程度と考えられる。酸化ストレス、aldehydes and advanced glycation end products (AGEs)などは内在的原因の代表であり、生理的なRNA転写やDNA複製にいてもDNA損傷が生じる。また、様々な環境要因がDNAを損傷する。DNA損傷が修復されずに細胞に蓄積すると細胞老化、さらに個体老化につながる。またDNA損傷は、神経変性の直接的・間接的原因となることが知られている。
論文情報
掲載誌:Cell
論文タイトル:Antagonistic roles of canonical and alternative RPA in tandem CAG repeat diseases
DOI:https://doi.org/10.1016/j.cell.2023.09.008
論文タイトル:Antagonistic roles of canonical and alternative RPA in tandem CAG repeat diseases
DOI:https://doi.org/10.1016/j.cell.2023.09.008
研究者プロフィール

岡澤 均 (オカザワ ヒトシ) Hitoshi Okazawa
東京医科歯科大学 難治疾患研究所
神経病理学分野 教授
研究領域
神経内科学、神経科学、神経病理学、分子生物学
東京医科歯科大学 難治疾患研究所
神経病理学分野 教授
研究領域
神経内科学、神経科学、神経病理学、分子生物学

藤田慶太 (フジタ キョウタ) Kyota Fujita
東京医科歯科大学 難治疾患研究所
神経病理学分野 非常勤講師
金沢大学 子どものこころの発達研究センター
特任准教授
研究領域
神経科学、神経病理学、分子生物学
東京医科歯科大学 難治疾患研究所
神経病理学分野 非常勤講師
金沢大学 子どものこころの発達研究センター
特任准教授
研究領域
神経科学、神経病理学、分子生物学

田中 ひかり(タナカ ヒカリ) Hikari Tanaka
東京医科歯科大学 難治疾患研究所
神経病理学分野 講師
研究領域
神経科学、神経病理学、分子生物学
東京医科歯科大学 難治疾患研究所
神経病理学分野 講師
研究領域
神経科学、神経病理学、分子生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
神経病理学分野 岡澤 均(オカザワ ヒトシ)
E-mail:okazawa.npat[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

