「メッセンジャーRNA医薬の再生医療への新しい展開」【位髙啓史 教授】
公開日:2023.6.23
「メッセンジャーRNA医薬の再生医療への新しい展開」
― 複数の治療用因子を組み合わせた骨再生治療 ―
― 複数の治療用因子を組み合わせた骨再生治療 ―

ポイント
- 骨誘導に働くタンパク質、血管新生に働くタンパク質を組み合わせてメッセンジャーRNA(mRNA)で投与することにより、動物骨欠損モデルに対する迅速かつ旺盛な骨再生に成功しました。
- 機能的・美容的に重大な問題を生ずる顎顔面骨骨欠損治療などへの応用が期待されます。
- mRNAが感染症ワクチンだけでなく、再生医療に向けて有効な治療薬となり得ることが示されました。
東京医科歯科大学 生体材料工学研究所 生命機能医学分野の位髙啓史教授、福島雄大助教、中西秀之助教、鄧佳(Deng Jia)大学院生と、大学院医歯学総合研究科 生体補綴歯科学分野の若林則幸教授、野﨑浩佑講師、張茂芮(Zhang Maorui)大学院生の研究グループは、新しい創薬モダリティとして注目を集めるmRNA医薬を用いて、顎骨骨欠損に対する骨再生治療に成功しました。この研究はAMED創薬基盤推進研究事業、肝炎等克服実用化研究事業、アクセリード株式会社の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Inflammation and Regenerationに、2023年6月20日にオンライン版で発表されました。
研究の背景
骨は本来自然に治癒する能力を持つ組織ですが、完全に治癒するまで長い時間を要することも多く、大きな骨欠損を生じた場合の対処は、依然重大な医学的課題です。特に顎顔面領域は、腫瘍切除、外傷などにより大きな骨欠損を生ずることがしばしばあり、機能的・美容的に深刻な問題となりますが、まだその治療法は確立していません。
本研究グループは、mRNAを体内に直接投与するmRNA医薬の研究開発を進めてきました。mRNAは新型コロナウイルスワクチンとして初めて実用化された新しいクスリの形ですが、どのようなタンパク質を投与することも可能で、組織再生に効果が期待されるタンパク質を局所的・一過性に産生させることによって、再生医療への応用も期待されています。本研究では、上記の顎顔面領域の骨欠損に対する治療への応用を想定して、mRNAを用いて複数の治療用タンパク質を組み合わせて投与することによる、新しい骨再生治療を試みました(図1)。
本研究グループは、mRNAを体内に直接投与するmRNA医薬の研究開発を進めてきました。mRNAは新型コロナウイルスワクチンとして初めて実用化された新しいクスリの形ですが、どのようなタンパク質を投与することも可能で、組織再生に効果が期待されるタンパク質を局所的・一過性に産生させることによって、再生医療への応用も期待されています。本研究では、上記の顎顔面領域の骨欠損に対する治療への応用を想定して、mRNAを用いて複数の治療用タンパク質を組み合わせて投与することによる、新しい骨再生治療を試みました(図1)。
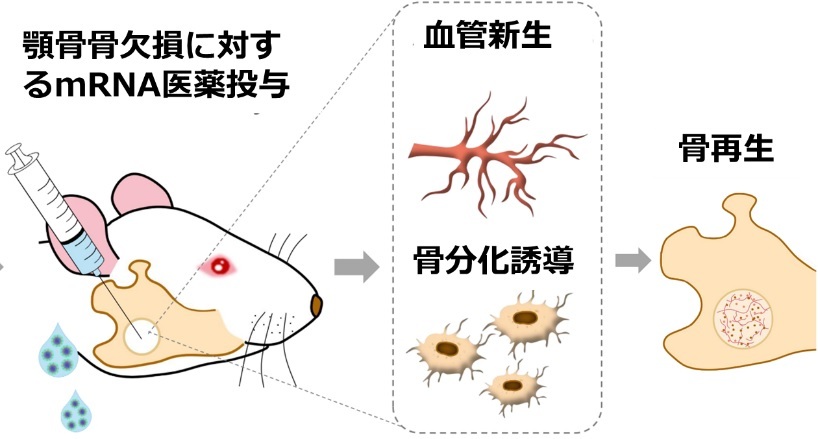
図1:mRNA医薬を用いた骨再生治療
研究成果の概要
本研究では、骨再生の効果を示す治療用タンパク質として、本研究グループの先行研究で骨再生効果が明らかとなっている骨誘導性転写因子(Runx2)※1、および血管内皮増殖因子(VEGF)※2の2種を用いました。後者は、その名の通り本来は血管新生に働く分泌タンパク質で、骨欠損部位への血管誘導が骨再生を促進する効果が期待されること、一方VEGF自体に骨分化誘導の機能があるとの研究報告もあり、Runx2との相乗的な効果が期待されるものとして、今回選択しました。
まず、培養細胞(未分化骨芽細胞)に対して、これらのmRNAを投与して、骨分化誘導能を評価しました。Runx2 mRNA、VEGF mRNAそれぞれを単独で投与しても、骨分化マーカー(オステオポンチン、オステオカルシンなど)の発現が亢進し、Runx2だけでなく、VEGFも骨分化誘導能を持つことが示唆されました。さらに両者を同時投与すると、さらに高い骨分化マーカー発現が観察され、両者が相乗的に細胞の骨分化誘導に働くことが示唆されました(図2)。
まず、培養細胞(未分化骨芽細胞)に対して、これらのmRNAを投与して、骨分化誘導能を評価しました。Runx2 mRNA、VEGF mRNAそれぞれを単独で投与しても、骨分化マーカー(オステオポンチン、オステオカルシンなど)の発現が亢進し、Runx2だけでなく、VEGFも骨分化誘導能を持つことが示唆されました。さらに両者を同時投与すると、さらに高い骨分化マーカー発現が観察され、両者が相乗的に細胞の骨分化誘導に働くことが示唆されました(図2)。
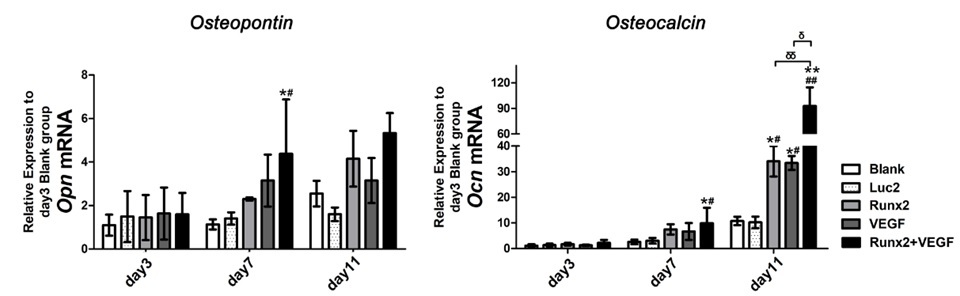
図2:培養細胞に対するRunx2 mRNA、VEGF mRNAの投与による骨分化誘導
次いで、これらのmRNAの動物での骨再生効果を検証しました。動物モデルとして、ラットの顎骨に径4mmの骨孔を作成するモデルを用いました。同モデルは無治療では自然治癒しないモデルとして知られています。この骨欠損部へのmRNA投与には、研究グループが先行研究にて開発を進めてきたナノミセル型mRNAキャリア※3を応用しました。骨欠損作成後1週から、週1回の間隔で計3回のmRNA投与を行い、マイクロCTによる骨の撮影、および組織学的評価を行いました。
Runx2 mRNA、VEGF mRNAいずれかの単独投与でも、無治療群あるいはコントロールmRNA投与群と比べて、骨欠損部に良好な骨再生が得られました。さらに、細胞での結果と一致して、この両者を組み合わせて投与した群で、最も旺盛な骨再生が観察されました(図3)。新生骨を詳細に評価すると、骨量や骨石灰化量など骨の性状を示す値がこの組み合わせ投与群で最も高い値となり、旺盛な骨再生が裏付けられました。
Runx2 mRNA、VEGF mRNAいずれかの単独投与でも、無治療群あるいはコントロールmRNA投与群と比べて、骨欠損部に良好な骨再生が得られました。さらに、細胞での結果と一致して、この両者を組み合わせて投与した群で、最も旺盛な骨再生が観察されました(図3)。新生骨を詳細に評価すると、骨量や骨石灰化量など骨の性状を示す値がこの組み合わせ投与群で最も高い値となり、旺盛な骨再生が裏付けられました。
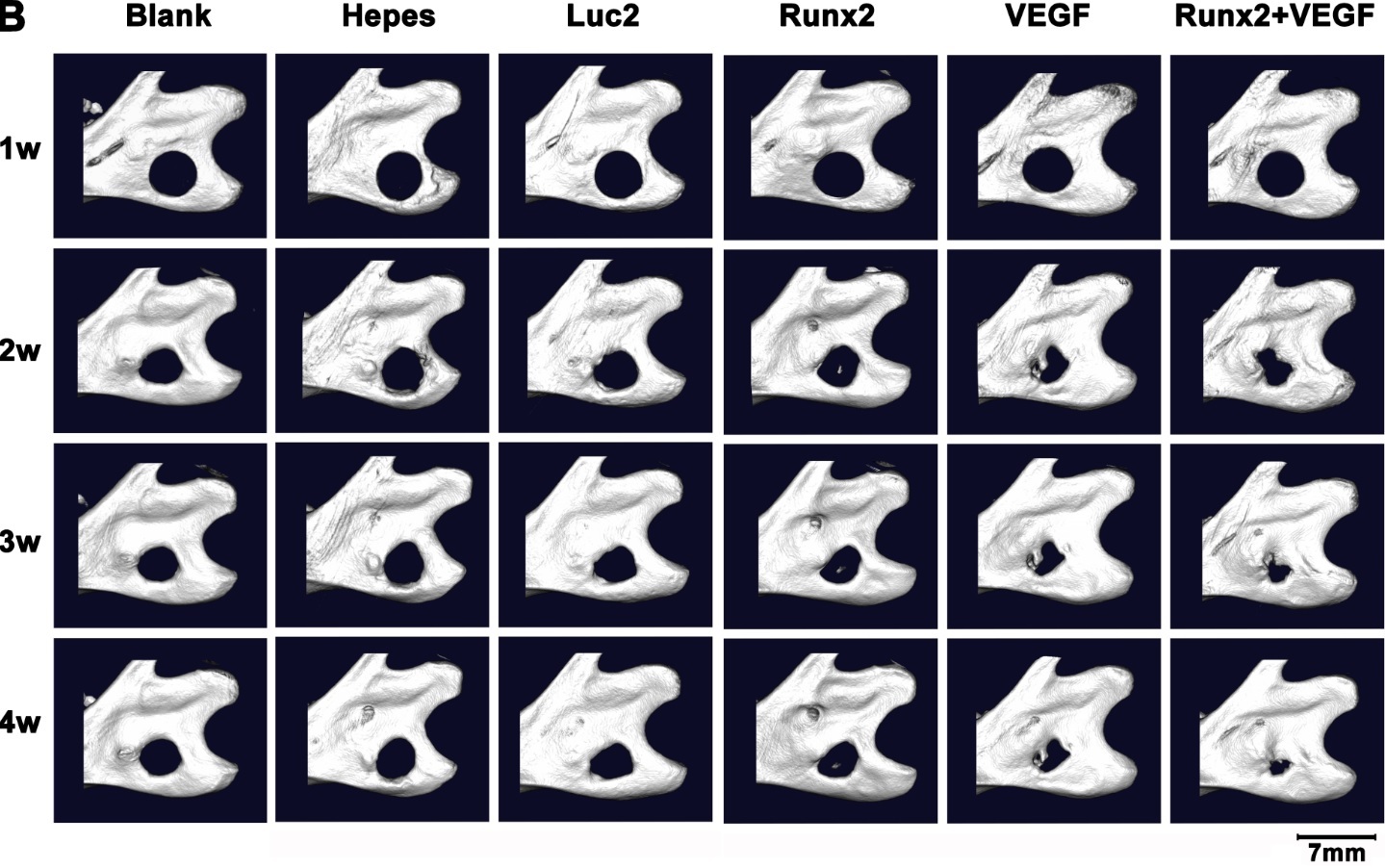
図3:顎骨骨欠損部への各mRNA投与後のマイクロCT画像
骨欠損作成後4週での骨再生部位の組織学的評価では、Runx2 mRNA投与群(単独あるいはVEGF mRNAとの組み合わせ)で、骨分化マーカー(アルカリフォスファターゼ(ALP)など)が広範に発現し、一方VEGF mRNA投与群(単独あるいはRunx2 mRNAとの組み合わせ)で、血管新生マーカー(CD31)の発現の亢進が観察されました(図4)。興味深いことに、VEGF mRNA投与群でも、Runx2 mRNA投与群よりは低い程度ながら骨誘導マーカー発現が増加しており、VEGFも骨誘導能を持つことが示唆されました。従って、VEGF mRNAは骨欠損部への血管新生、骨誘導の両方の役割を果たしたことが示唆され、さらにRunx2 mRNAと組み合わせることにより、両者が相乗的に作用し、より活発な骨再生を誘導したものと考えられます。また、今回のmRNA投与によって、投与局所での炎症反応など明らかな有害事象は観察されませんでした。
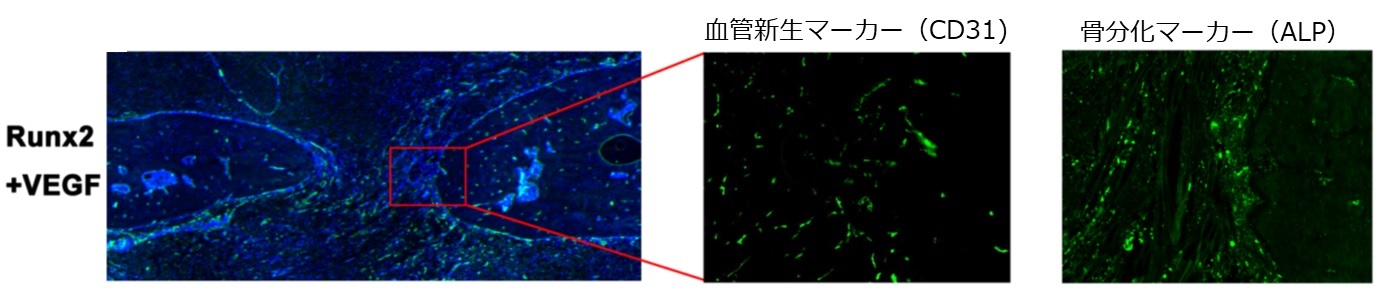
図4:骨再生部位の免疫組織学的解析(Runx2 mRNA、VEGF mRNA組み合わせ投与)
研究成果の意義
mRNA医薬の再生医療への応用例はまだわずかで、現在世界で行われている臨床試験としては、VEGF mRNAを用いた虚血性心疾患治療の事例があるのみです。一方本研究では、分泌タンパク質であるVEGF、細胞内で働く転写因子であるRunx2という、全く種類の異なるタンパク質であっても、それらを自在に組み合わせて治療に用いることができるmRNA医薬の特長を明確に示しました。VEGFによって血管新生の積極的な誘導が可能となることは、特に顎顔面領域などの大きな骨欠損に対して有効に働く可能性があります。mRNA医薬を用いた、細胞移植を必要としない再生医療の実現に向けた重要な一歩と位置づけられます。
用語解説
※1 Runt-related transcription factor 2(Runx2)
骨芽細胞の分化に必須の転写因子の1つ。研究グループの先行研究で、Runx2遺伝子導入による骨再生効果が確認されている。
※2 Vascular endothelial growth factor(VEGF)
血管内皮増殖因子。VEGFが血管内皮細胞に作用すると、細胞の分裂や遊走、分化などを誘導し、その結果、既存の血管から枝分かれした新たな血管が形成される(血管新生)。
※3 ナノミセル型キャリア
本研究グループによって開発されたmRNA送達用ナノ粒子。ナノミセルとは、親水性ポリマー(ポリエチレングリコールなど)と、疎水性や電荷をコントロールした機能性ポリマー(ポリアミノ酸誘導体など)の2つの部分から成るブロック共重合体が凝集して形成されるナノ粒子で、周囲を親水性ポリマーの外郭で覆われた粒子の内部に、薬物や核酸分子を封じ込めることができる。mRNA送達用に最適化されたナノミセルを用いて、これまで脳、脊髄、関節軟骨など種々の臓器、組織に対してmRNAを安全に送達し、機能させることに成功している。
骨芽細胞の分化に必須の転写因子の1つ。研究グループの先行研究で、Runx2遺伝子導入による骨再生効果が確認されている。
※2 Vascular endothelial growth factor(VEGF)
血管内皮増殖因子。VEGFが血管内皮細胞に作用すると、細胞の分裂や遊走、分化などを誘導し、その結果、既存の血管から枝分かれした新たな血管が形成される(血管新生)。
※3 ナノミセル型キャリア
本研究グループによって開発されたmRNA送達用ナノ粒子。ナノミセルとは、親水性ポリマー(ポリエチレングリコールなど)と、疎水性や電荷をコントロールした機能性ポリマー(ポリアミノ酸誘導体など)の2つの部分から成るブロック共重合体が凝集して形成されるナノ粒子で、周囲を親水性ポリマーの外郭で覆われた粒子の内部に、薬物や核酸分子を封じ込めることができる。mRNA送達用に最適化されたナノミセルを用いて、これまで脳、脊髄、関節軟骨など種々の臓器、組織に対してmRNAを安全に送達し、機能させることに成功している。
論文情報
掲載誌:Inflammation and Regeneration
論文タイトル:Enhancement of bone regeneration by coadministration of angiogenic and osteogenic factors using messenger RNA
DOI:https://doi.org/10.1186/s41232-023-00285-3
論文タイトル:Enhancement of bone regeneration by coadministration of angiogenic and osteogenic factors using messenger RNA
DOI:https://doi.org/10.1186/s41232-023-00285-3
研究者プロフィール

位髙 啓史 (イタカ ケイジ) Keiji ITAKA
東京医科歯科大学 生体材料工学研究所
生命機能医学分野 教授
・研究領域
mRNA・核酸医薬、遺伝子治療、DDS(Drug Delivery System)、バイオマテリアル、整形外科
東京医科歯科大学 生体材料工学研究所
生命機能医学分野 教授
・研究領域
mRNA・核酸医薬、遺伝子治療、DDS(Drug Delivery System)、バイオマテリアル、整形外科
問い合わせ先
<研究に関すること>
東京医科歯科 生体材料工学研究所
生命機能医学分野 位髙 啓史 (イタカ ケイジ)
E-mail:itaka.bif@tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

