「舌癌の組織定量イメージ解析でパーソナル免疫プロファイル評価が可能に」【東みゆき 教授】
― 予後予測や有効な治療法選択に有用 ―

ポイント
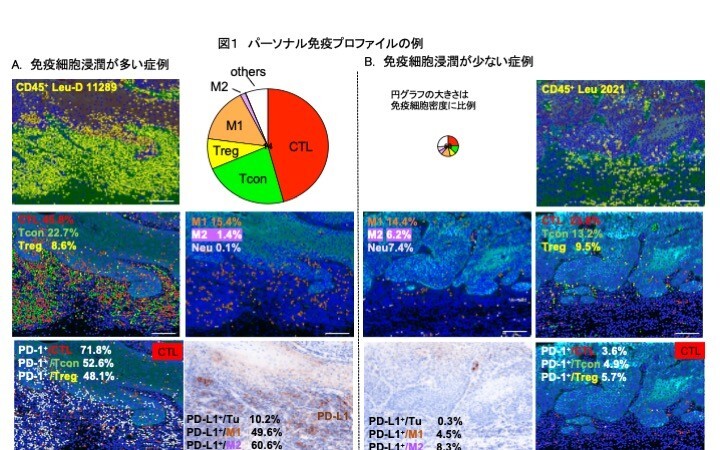
- がんの周囲には、さまざまな役割の免疫細胞が存在していますが、マルチプレックス免疫組織染色※1と組織定量イメージ解析※2 で、免疫細胞の分布密度や比率を包括的に評価することを可能にしました。
- 舌癌の免疫プロファイルは非常に多様性に富んでおり、既存の臨床ステージ (TNM)や病理分類からは推し量ることができないことがわかりました。
- 舌癌では、多くの症例が何らかの免疫抑制状態にあることが明らかになりました。
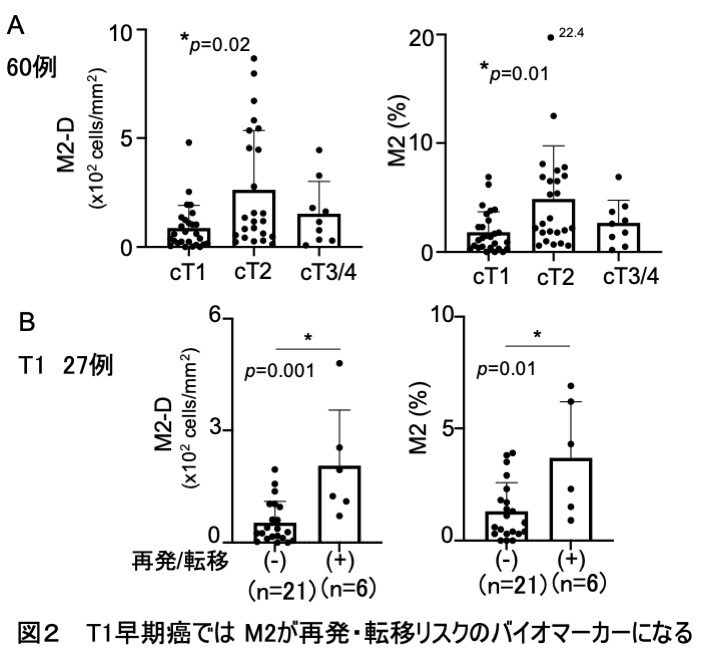
- 早期癌にもかかわらず再発・転移した症例では、M2マクロファージ※3指標が高くなっていました。
- パーソナルな免疫プロファイル評価は、予後予測や有効な治療法選択に有用と思われました。
研究の背景
この研究の対象である舌癌は、頭頸部癌(口・のど・鼻の癌)の中でも最も頻度が高い癌ですが、一旦再発・転移が起こると制御が困難で、再発・転移を起こさないために術前あるいは術後の補助療法の選択が重要になります。さらに、PD-1免疫チェックポイント阻害薬の奏効率も舌癌では肺癌と比べてかなり劣っています。舌癌では、さまざまな免疫抑制作用が働いていることがこれまで報告されてきていますので、免疫チェックポイント阻害薬のみでは、治療効果が得にくいことが予想されます。どのような症例にどのような治療が有効であるかの判断に、患者さん個々の免疫プロファイルを知ることは有用と考えられます。
研究成果の概要
T1早期癌では、 多くの免疫スコアの中でM2マクロファージ指標が低いことが特徴でした(図2A)。 ところが、T1の再発・転移群では、M2マクロファージ指標が有意に高く、多因子解析の主成分分析 (PCA)からもM2マクロファージが単一成分として高く寄与しており、 T1早期癌における再発・転移のバイオマーカーとなる可能性が示されました(図2B)。
研究成果の意義
免疫チェックポイント阻害薬を用いた免疫療法は、頭頸部癌を含めさまざまながん種の治療に用いられていますが、治療効果の認められる患者さんは1−3割と限られており、医療費が高額であることの課題などからも、患者さんごとに効果的な個別化医療を提供することが望まれています。免疫チェックポイント阻害薬投与も、再発・転移を起こしてからではなく、術前あるいは術後の補助療法として使用する動きが進んでいます。その際に、免疫プロファイル評価が有用であると思われます。どこの施設でも入手可能なパラフィン包埋切片が使用でき、ビジュアルな免疫プロファイル提示は、舌癌のみならず多くの癌での活用が期待できます。
用語解説
※1 マルチプレックス免疫組織染色
マルチプレックス免疫組織染色では、染色後に蛍光色素―チラミド複合体を残して抗体を取り除くために、抗体の組み合わせの制約を受けず、同一種の抗体を繰り返し使用することができるので、1切片で6種を超える1次抗体を使用することが可能。チラミドによるシグナル増幅により、存在量の少ない標的分子の検出が可能となる。
※2 組織定量イメージ解析
免疫蛍光染色や酵素抗体染色の組織切片スライドで、解析したいフィールドを機械学習で設定でき、単細胞レベルで、多波長のシグナル強度の定量から細胞サブセットが同定できる。組織染色切片でのサイトメトリー解析および組織空間内での分布・相互位置関係の解析が可能となる。
※3 M2マクロファージ
主に炎症反応に関わり、病原微生物やがんの排除作用をする古典的なM1マクロファージに対して、抗炎症反応に関わり、組織修復や免疫抑制作用を持つマクロファージ。ヒト組織染色では、M2マクロファージの識別に スカベンジャー受容体の膜貫通型タンパク質であるCD163が使用されることが多い。がん微小環境では、抗がん免疫応答の抑制に働く。
※4 制御性 T細胞 (Treg)
免疫応答を抑制する機能を持つCD4+T細胞で、がんを攻撃するエフェクター免疫細胞の機能を抑制してがん増大に関わる。 Tregはマスター転写因子として Foxp3 をもつことで、通常のCD4+T細胞(conventional CD4+T細胞/Tcon)と区別することができる。
論文情報
論文タイトル:Personal immune profiles: Diversity and prognostic value for oral tongue squamous cell carcinoma evaluated by comprehensive immune parameter analyses with multiplex immunofluorescence
DOI:https://doi.org/10.1016/j.oraloncology.2023.106458
研究者プロフィール

東京医科歯科大学 大学院医歯学総合研究科
分子免疫学分野 大学院生
(タイ王国 ナレスワン大学歯学部 口腔診断科 教員)
・研究領域
免疫学 口腔診断学

大内 崚 (オオウチ リョウ) Ryo Ouchi
東京医科歯科大学 大学院医歯学総合研究科
分子免疫学分野 特別研究生
(富山大学大学院医学薬学教育部 歯科口腔外科 大学院生)
・研究領域
口腔外科学

東京医科歯科大学 大学院医歯学総合研究科
分子免疫学分野 教授
・研究領域
免疫学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子免疫学分野 東 みゆき(アズマ ミユキ)
E-mail: miyuki.mim@tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

