「がん免疫療法は皮膚ランゲルハンス細胞のブレーキ機構を外して乾癬を重症化する」【沖山奈緒子 教授】
公開日:2022.7.15
「がん免疫療法は皮膚ランゲルハンス細胞のブレーキ機構を外して乾癬を重症化する」
― ランゲルハンス細胞上の免疫チェックポイント分子PD-L1は乾癬の進展を制御する ―
― ランゲルハンス細胞上の免疫チェックポイント分子PD-L1は乾癬の進展を制御する ―
ポイント
- 皮膚免疫学においてその役割について長らく議論されているランゲルハンス細胞は、乾癬という慢性炎症性皮膚病において、発症誘導をしていると同時に、免疫チェックポイント分子PD-L1というブレーキ機構も持つことをつきとめました。
- 遺伝子改変技術を用いて新しく作出したマウスを用いた実験により、明確な結果を得ています。
- PD-L1を標的とした抗体製剤はがん免疫療法として使われていますが、その時に起こってくる人工的な免疫活性化状態による副作用の病態の一端が解明され、よりよい副作用対処法開発への応用が期待できます。
研究の背景
現在、がん免疫療法が多くのがん治療に応用され、その高い効果が期待されています。がん免疫療法では、免疫チェックポイント分子と呼ばれる免疫抑制性分子に対する抗体医薬や使われており、がんを攻撃するT細胞というリンパ球上に発現しているPD-1と、その刺激分子であるPD-L1、また樹状細胞という抗原提示細胞が発現する免疫刺激分子がT細胞に働きかけることを邪魔しているCTLA-4といった分子が標的となっています。がん治療効果の一方で、人工的な免疫賦活化による免疫関連副作用と呼ばれる現象が、がん免疫療法の妨げとなっており、特に皮膚炎はもっとも頻度が高く、がん患者の治療意欲をそいでいます。
乾癬は慢性炎症性皮膚疾患であり、鱗屑を多く付すくっきりした紅斑が多発し、爪の変形を来し、時にリウマチのような関節炎を伴います。インターロイキン(IL)-17を産生する自然リンパ球γδ T細胞や獲得免疫系リンパ球の一つであるTh17細胞が皮膚炎を形成しており、この病原性細胞はIL-23を産生する表皮常在ランゲルハンス細胞や真皮樹状細胞といった抗原提示能を持つ細胞が誘導していると説明されています。そのため、治療薬として、IL-17やIL-23を標的とした抗体医薬が広く使われます。
がん免疫療法に伴う皮膚の免疫関連副作用には乾癬が含まれ、もともとある乾癬を急激に悪化させる場合と、初めて発症させてしまう場合があります。沖山教授らの研究グループは、この免疫関連副作用としての乾癬は、がん免疫療法によって、細胞傷害性T細胞と呼ばれるリンパ球上の免疫チェックポイント分子PD-1が遮断されて異常に活性化し、皮膚を攻撃することから始まること(Tanaka R, et al. Communications Biology, 2020)、PD-1に対する刺激分子としてはPD-L1とPD-L2があるが特にPD-L1が乾癬の発症を抑えていること(Tanaka R, et al. The Journal of Investigative Dermatology, 2022)を報告しています。しかし、この乾癬の進展抑制機構であるPD-1-PD-L1機構において、どの細胞が発現するPD-L1が特に重要であるかなどは不明でした。
乾癬は慢性炎症性皮膚疾患であり、鱗屑を多く付すくっきりした紅斑が多発し、爪の変形を来し、時にリウマチのような関節炎を伴います。インターロイキン(IL)-17を産生する自然リンパ球γδ T細胞や獲得免疫系リンパ球の一つであるTh17細胞が皮膚炎を形成しており、この病原性細胞はIL-23を産生する表皮常在ランゲルハンス細胞や真皮樹状細胞といった抗原提示能を持つ細胞が誘導していると説明されています。そのため、治療薬として、IL-17やIL-23を標的とした抗体医薬が広く使われます。
がん免疫療法に伴う皮膚の免疫関連副作用には乾癬が含まれ、もともとある乾癬を急激に悪化させる場合と、初めて発症させてしまう場合があります。沖山教授らの研究グループは、この免疫関連副作用としての乾癬は、がん免疫療法によって、細胞傷害性T細胞と呼ばれるリンパ球上の免疫チェックポイント分子PD-1が遮断されて異常に活性化し、皮膚を攻撃することから始まること(Tanaka R, et al. Communications Biology, 2020)、PD-1に対する刺激分子としてはPD-L1とPD-L2があるが特にPD-L1が乾癬の発症を抑えていること(Tanaka R, et al. The Journal of Investigative Dermatology, 2022)を報告しています。しかし、この乾癬の進展抑制機構であるPD-1-PD-L1機構において、どの細胞が発現するPD-L1が特に重要であるかなどは不明でした。
研究成果の概要
乾癬のモデルマウスとして、イミキモド(自然免疫活性化剤)塗布誘導乾癬様皮膚炎がもっとも広く用いられています。研究グループがこのイミキモド誘導乾癬様皮膚炎マウス病変部皮膚にて、PD-L1を発現している細胞を探索したところ、表皮角化細胞、表皮常在ランゲルハンス細胞、真皮樹状細胞など多くの細胞が発現していました。そこで、乾癬の発症において、所属リンパ節に遊走して病原性γδ T細胞の誘導・活性化に大きな役割を果たすとされるランゲルハンス細胞に着目しました。CRISPR-Cas9という遺伝子改変技術を用い、PD-L1をLoxPで囲む遺伝子改変マウスを新規に作出し、ランゲルハンス細胞特異的マーカーLangerinとともにCre酵素を発現させたマウスと掛け合わせることで、ランゲルハンス細胞上でのみPD-L1を遺伝子的に欠損させたコンディショナルノックアウトマウス※1を作製しました。このLangerin-PD-L1コンディショナルノックアウトマウスへ、イミキモド誘導乾癬様皮膚炎を惹起したところ、明確に重症化した乾癬を発症しました(図1、2)。
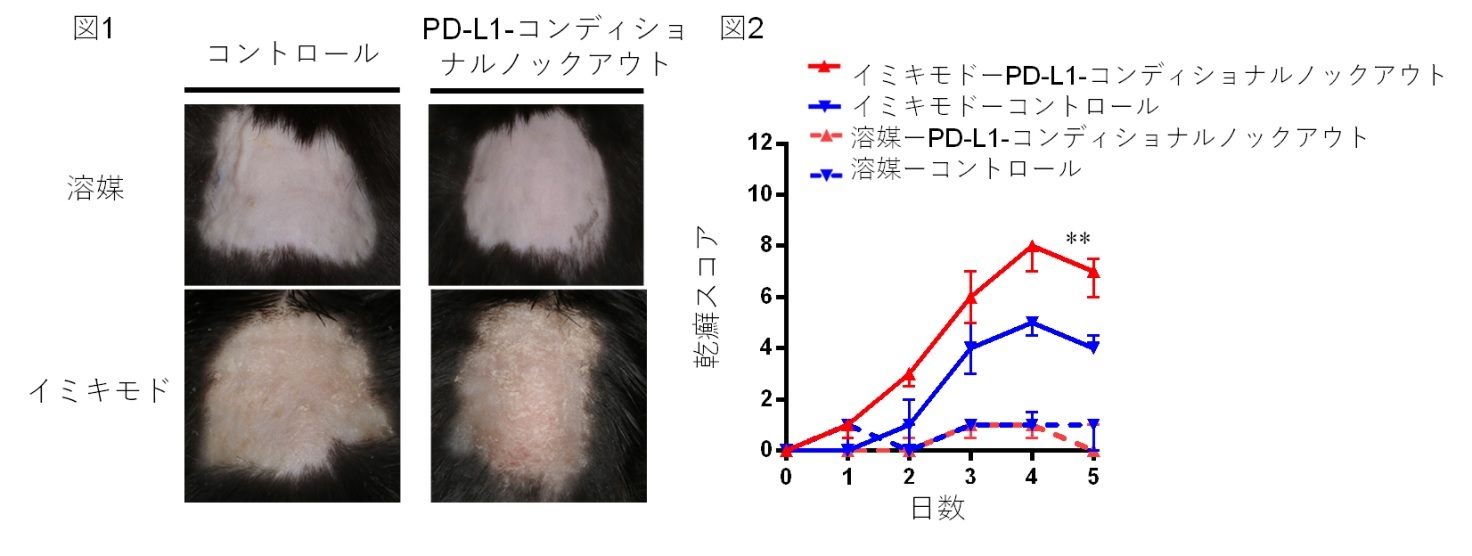
また、コンディショナルノックアウトマウスでは、野生型コントロールマウスと比べ、皮膚にはγδ T細胞が多く浸潤し、この細胞はよりIL-17産生能が高いこと、さらにその所属リンパ節では、表皮向性のある病原性γδ T細胞が特に増多・活性化していることを見出しています。
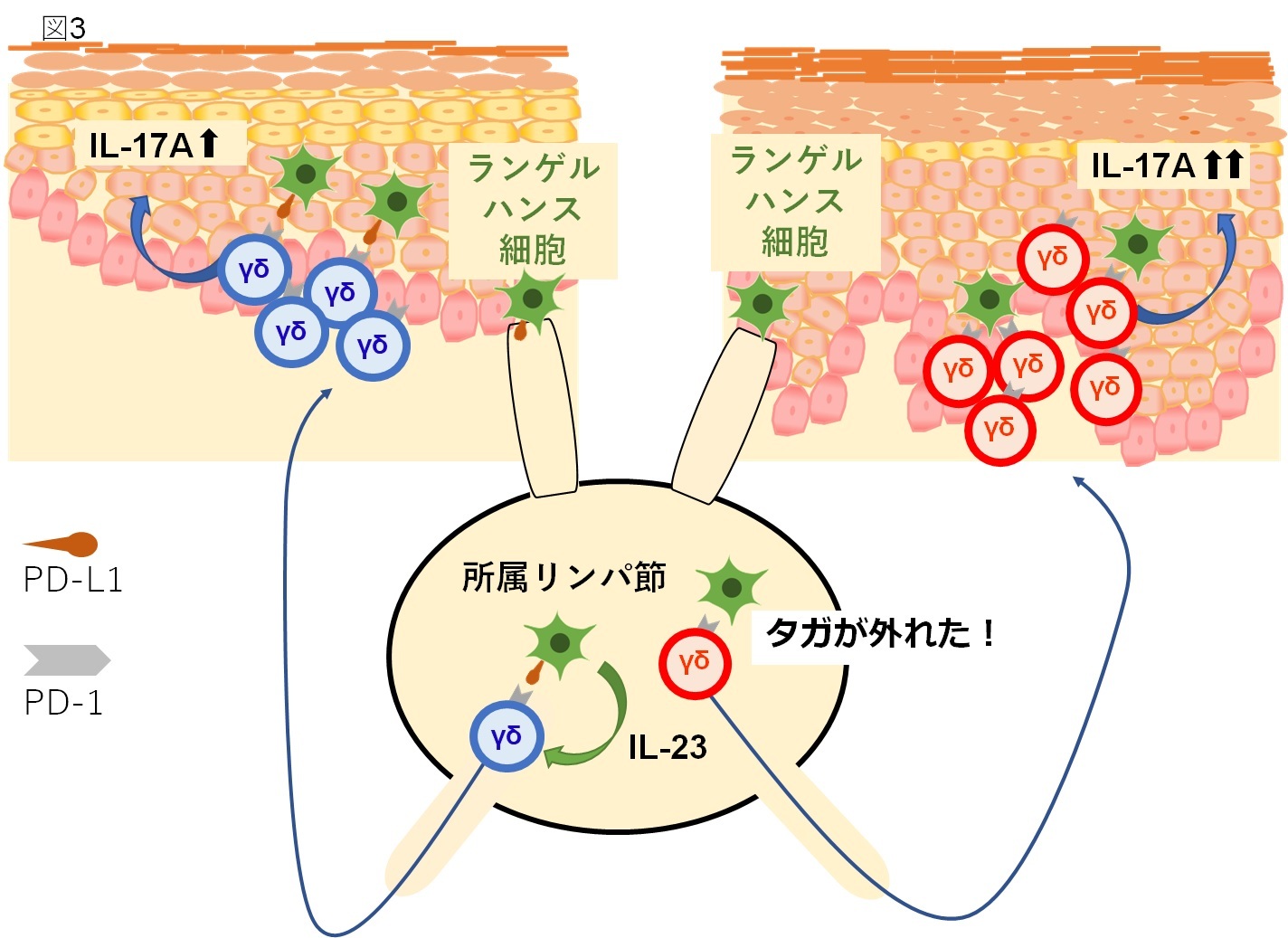
これらの結果は、ランゲルハンス細胞は特に所属リンパ節でγδ T細胞を活性化して乾癬の病態を成立させているが、PD-L1も同時に発現してブレーキをかけている一方、PD-L1シグナルが遮断された状態ではこのブレーキがなく、いわゆる「タガが外れた」状態になっており、これががん免疫療法における免疫関連副作用としての乾癬で起こっている状態と考えられます(図3)。
これらの結果は、ランゲルハンス細胞は特に所属リンパ節でγδ T細胞を活性化して乾癬の病態を成立させているが、PD-L1も同時に発現してブレーキをかけている一方、PD-L1シグナルが遮断された状態ではこのブレーキがなく、いわゆる「タガが外れた」状態になっており、これががん免疫療法における免疫関連副作用としての乾癬で起こっている状態と考えられます(図3)。
研究成果の意義
一般の乾癬、またがん免疫療法の免疫関連副作用として起きている乾癬、双方を説明する免疫制御機構を、新しい遺伝子改変技術を用いて明確に示すことができました。この結果は、通常の乾癬においてはランゲルハンス細胞上のPD-L1発現を上昇させるような治療ストラテジーの確立、またがん免疫療法においてはランゲルハンス細胞上のPD-L1シグナル遮断を回避することで、皮膚免疫関連副作用を回避するという、ブラッシュアップストラテジーへ発展していくことが期待されます。
用語解説
※1コンディショナルノックアウトマウス:研究対象標的の遺伝子を機能しなくしたマウスをノックアウトマウスと呼び、コンディショナルノックアウトマウスはさらに、この遺伝子欠損を、時期や特定の細胞上でのみ行えるように工夫されたマウスであり、多くはCre/LoxPシステムが用いられる。つまり、標的遺伝子は2つのLoxP配列で挟んでおき、このLoxPに挟まれた遺伝子エキソンを切り出す酵素であるCreを例えば特定の細胞のマーカーと連動して発現するように設計すると、これらを掛け合わせることで、特定の細胞上でのみ標的遺伝子発現を欠損したコンディショナルノックアウトマウスが作出できる。
論文情報
掲載誌:The Journal of Investigative Dermatology
論文タイトル: The role of programmed cell death ligand-1 on Langerhans cells in the regulation of psoriasis
DOI: https://doi.org/10.1016/j.jid.2022.06.006
研究者プロフィール

沖山 奈緒子 (オキヤマ ナオコ) Okiyama Naoko
東京医科歯科大学 医歯学総合研究科
皮膚科分野 教授
・研究領域
皮膚免疫学
自己免疫
東京医科歯科大学 医歯学総合研究科
皮膚科分野 教授
・研究領域
皮膚免疫学
自己免疫
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
皮膚科学分野 氏名 沖山 奈緒子(オキヤマ ナオコ)
E-mail:okiy.derm[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

