アルツハイマー病と前頭側頭葉変性症の共通病態を発見 (2018)
アルツハイマー病、前頭側頭葉変性症、レヴィー小体型認知症の3大認知症は、高齢化社会の日本で大きな社会問題となっている。アルツハイマー病は、2025年には高齢者の5人に1人が罹患すると言われている。前頭側頭葉変性症とレヴィー小体型認知症は、アルツハイマー病に次いで頻度が高く、概ね、アルツハイマー病の2分の1から3分の1ほどの患者数があると言われている。これらの3大認知症には遺伝の影響が強い家族性認知症と遺伝的要素が目立たない孤発性認知症とがあるが、家族性前頭側頭葉変性症の中では、タウ(tau)とプログラニュリン(PGRN)の遺伝子変異の頻度が比較的高いと言われている。アルツハイマー病ではアミロイド、レヴィー小体型認知症ではアルファシヌクレインが脳内の神経細胞の内あるいは外に蓄積して凝集することが分かっている。一方、本研究が対象とした前頭側頭葉変性症では、タウタンパク質の凝集が見られるケースと見られないケースがあり、後者ではTDP43 というタンパク質が凝集している場合が多く、プログラニュリン遺伝子変異を伴う前頭側頭葉変性症も、これに相当する。
これらの3大認知症については、根本的な治療法(病態修飾治療法: Disease Modifying Therapy:DMT とも言う)は確立されておらず、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になってはいない。例えば、アルツハイマー病では欧米の巨大製薬企業を中心にアミロイド凝集除去を目的としてアミロイド抗体を用いた多くの国際的臨床試験(日本を含む)が行われてきたが、アミロイド除去には成功したものの、臨床症状の改善には至っておらず、この事例は、どのような時期に如何なる不可逆的病態に至るかを明らかにすることが非常に重要であることを示している。前頭側頭葉変性症とレヴィー小体型認知症では、治療開発はアルツハイマー病よりも遅れた状況にある。
これらの3大認知症については、根本的な治療法(病態修飾治療法: Disease Modifying Therapy:DMT とも言う)は確立されておらず、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になってはいない。例えば、アルツハイマー病では欧米の巨大製薬企業を中心にアミロイド凝集除去を目的としてアミロイド抗体を用いた多くの国際的臨床試験(日本を含む)が行われてきたが、アミロイド除去には成功したものの、臨床症状の改善には至っておらず、この事例は、どのような時期に如何なる不可逆的病態に至るかを明らかにすることが非常に重要であることを示している。前頭側頭葉変性症とレヴィー小体型認知症では、治療開発はアルツハイマー病よりも遅れた状況にある。
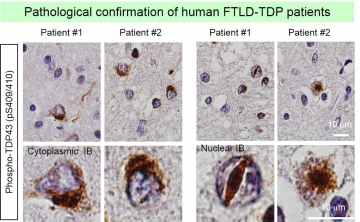
本研究において、岡澤グループは新たに作成した変異プログラニュリン遺伝子を持つノックインマウスより採取した大脳組織を用いて、経時的に網羅的リン酸化プロテオーム解析を行った。得られた結果を検討した結果、予想外にも、TDP43 タンパク質の脳内凝集が見られる以前に、タウタンパク質の203番目アミノ酸(Ser203)のリン酸化の異常増加が変異プログラニュリンノックインマウスの脳内で検出された。さらに解析を進めたところ、この203番目セリンがリン酸化したタウタンパク質(pSer203 タウタンパク質)はヒト前頭側頭葉変性症患者脳でも確認され、pSer203 タウタンパク質は神経細胞のシナプスに局在していることが分かった。このような、異常リン酸化タウタンパク質のシナプスへの局在は、既にアルツハイマー病モデルでも報告されており、シナプスを障害して認知症状につながることが示唆されている。そこで、タウタンパク質のAAV ノックダウンベクターを用いて変異プログラニュリンノックインマウスの遺伝子治療を行ったところ、減少していたシナプスの数が正常化して認知障害の症状も改善した。
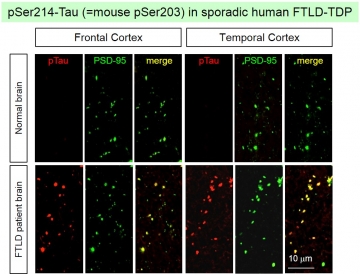
さらに、岡澤グループは、プログラニュリン遺伝子変異と、タウタンパク質のSer203 異常リン酸化の関係を調べた。まず、プログラニュリン遺伝子変異はプログラニュリンタンパク質の減少につながっていた。次に、プログラニュリンは、Tyro3という受容体型チロシンキナーゼとGas6という分泌タンパク質との結合を阻害することが分かった。また、Gas6 がTyro3に結合してこれを活性化すると、PKC, MAPK あるいはB-raf というリン酸化酵素(キナーゼ)によるTyro3 下流シグナルが活性化され、最終的にタウタンパク質のSer203 異常リン酸化につながることが明らかになった(下図 左側)。これらのキナーゼに対する阻害薬あるいはAAV ノックダウンベクターを用いて、変異プログラニュリンノックインマウスの治療実験を行ったところ、いずれも減少していたシナプスの数が正常化して認知障害の症状も改善した(下図 右側)。
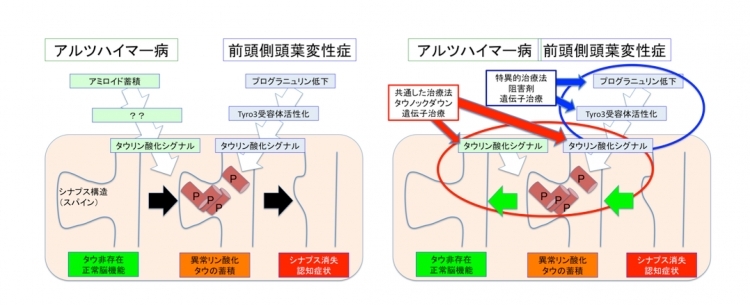
前頭側頭葉変性症はアルツハイマー病に次ぐ認知症の原因である。本研究において、岡澤グループは、前頭側頭葉変性症とアルツハイマー病に共通する病態、すなわちタウタンパク質異常リン酸化とそのシナプス局在、を発見した。さらに本研究は、タウタンパク質異常リン酸化につながる新たなシグナルを解明した。アルツハイマー病においては、アミロイド抗体療法の失敗の後に、タウタンパク質が新たな治療開発の標的分子として注目されている。本研究は、この戦略が前頭側頭葉変性症においても適応可能であることを示唆すると同時に、具体的な治療手法を複数提示した。本研究は、治療標的分子として従来は知られていなかったTyro3, Gas6, B-raf らの分子を示し、それらを阻害する作用を持つ、既に非神経疾患に臨床使用されているVemurafenib などの薬剤や、AAV ノックダウンベクターを用いた遺伝子治療が将来的な治療開発の選択肢であることを、具体的に証明した。同時に、本研究成果は、現在の認知症研究の焦点となっている発症前の早期病態解明と早期治療法開発を明確に示した点でも、大きな意義を持つと考えられる。
発表論文
Fujita K, Chen X, Homma H, Tagawa K, Amano M, Saito A, Imoto S, Akatsu H, Hashizume Y, Kaibuchi K, Miyano S, Okazawa H.
Targeting Tyro3 ameliorates a model of PGRN-mutant FTLD-TDP via tau-mediated synaptic pathology.
Nat Commun, 2018; 9: 433. doi: 10.1038/s41467-018-02821-z.
Targeting Tyro3 ameliorates a model of PGRN-mutant FTLD-TDP via tau-mediated synaptic pathology.
Nat Commun, 2018; 9: 433. doi: 10.1038/s41467-018-02821-z.

