第3の細胞死を標的とするハンチントン病の新しい治療戦略 (2016)
アルツハイマー病、パーキンソン病、ハンチントン病、脊髄小脳失調症、筋萎縮性側索硬化症といった神経変性疾患は、数年から数十年かけて緩徐に進行することが重要な特徴である。神経細胞の機能低下と細胞死の緩徐進行性は、脳梗塞や脳出血など、数分から数時間で症状が完成する脳疾患のそれとは明らかに性質を異にする。神経細胞死がどのようなものであるかは、いまだ議論が続いている。細胞死といえば、アポトーシスやネクローシスが代表例であるが、そのほかにも、オートファジー細胞死、ネクロプトーシス、さらには私達が以前発見したTRIAD(transcriptional repression-induced atypical cell death、転写抑制性非典型的細胞死)など、複数の細胞死が存在する。TRIADは、転写の基本分子であるRNA polymerase IIの特異的阻害による神経細胞で緩慢なネクローシス様細胞死の事であり、アポトーシスの形態学的・生化学的特徴を持たず、オートファゴソームの拡大・増加もなく、小胞体の顕著な膨張が形態学的特徴である。また、網羅的発現解析から得た候補分子YAPの関与が疑われた(Hoshino et al., 2006)。今回私達は、ショウジョウバエライブラリーを用いてTRIADに影響する細胞死関連分子をスクリーニングし、得られた分子をタンパク質間相互作用のデータにマッチングさせるバイオインフォマティクス解析と併せて、TRIADのシグナルネットワークを包括的に探索した。その結果、hnRNPというRNA結合分子、ハンチンチンというハンチントン病原因遺伝子がTRIADに関わっていることを報告した。
今回私達は、上記とは逆に、変異ハンチンチン(ポリグルタミン配列が異常伸長した変異型; 変異Htt)を発現させた神経細胞において、アポトーシスやネクローシスではなく、不均一な細胞質膨張を特徴とする細胞死が増加していることを見出した(Mao et al., 2016)。また、細胞質膨張は小胞体の膨張であり、二光子顕微鏡を用いた観察から、生きたハンチントン病モデルマウス脳においても、同様の小胞体の不安定化や膨張を観察した。
TRIADを導く細胞内シグナルを解析すると、YAP-TEADによる生存シグナルの喪失が主原因であった。Hippo経路の活性化は、YAPの核内移行を妨げ、Plk1によるYAPのリン酸化はYAP/p73の結合を高めた。さらに、変異HttはYAPと結合して封入体内へ取り込んでいた。これらはいずれも、生存シグナル喪失に関わる要因と考えられる。Plk1の活性化は、転写共役因子YAPの結合相手をTEADからp73へ変えるが、非増殖細胞である神経細胞では通常Plk1活性は低いため、YAPの主対象はTEADであると考えられる。最後に、核内YAPを増やす方向に働く、S1PによるHippo経路の抑制が、ハンチントン病モデルマウスの運動機能を改善し、小胞体サイズ変動を改善することがわかった。その後私達は、モデルマウスのみならず、ハンチントン病患者の死後脳において、電子顕微鏡下での小胞体の膨張を認めた他、生化学的・組織学的解析からhippo経路の活性化が認められた(Yamanishi et al., 2017)。以上より、TRIADのシグナル経路を標的とする治療法がハンチントン病態の治療に有効であることが考えられる。
TRIADを導く細胞内シグナルを解析すると、YAP-TEADによる生存シグナルの喪失が主原因であった。Hippo経路の活性化は、YAPの核内移行を妨げ、Plk1によるYAPのリン酸化はYAP/p73の結合を高めた。さらに、変異HttはYAPと結合して封入体内へ取り込んでいた。これらはいずれも、生存シグナル喪失に関わる要因と考えられる。Plk1の活性化は、転写共役因子YAPの結合相手をTEADからp73へ変えるが、非増殖細胞である神経細胞では通常Plk1活性は低いため、YAPの主対象はTEADであると考えられる。最後に、核内YAPを増やす方向に働く、S1PによるHippo経路の抑制が、ハンチントン病モデルマウスの運動機能を改善し、小胞体サイズ変動を改善することがわかった。その後私達は、モデルマウスのみならず、ハンチントン病患者の死後脳において、電子顕微鏡下での小胞体の膨張を認めた他、生化学的・組織学的解析からhippo経路の活性化が認められた(Yamanishi et al., 2017)。以上より、TRIADのシグナル経路を標的とする治療法がハンチントン病態の治療に有効であることが考えられる。
第三の細胞死、TRIADと神経変性疾患
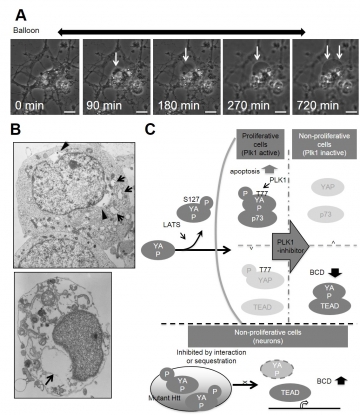
アポトーシスでもない、オートファジー細胞死でもない、非典型的な細胞死の形態があることを、我々は2006年に報告した。TRIAD、すなわち転写抑制性非典型的細胞死は、alpha-amanitinというRNA polymerase II特異的阻害剤によって非常に緩慢な細胞死が起こることを発見したことに端を発する。さらに、電子顕微鏡で細胞を観察すると、小胞体の膨張が見られた。RNA polymerase IIはゲノムDNAからmRNAを転写する上での基本転写マシナリーに必須であるが、神経変性疾患では、核機能異常、とりわけ転写機能異常を示唆する病態が10数年前より数多く報告されている。我々も、ポリグルタミン病原因遺伝子に見られるポリグルタミン配列が、核転写機能異常に関係することをいち早く予見し、例えばPQBP1(polyglutamine binding protein 1)の発見などの報告を重ねて来た。その研究過程で、転写機能不全による細胞死についての解析からTRIADを発見した。今回ハンチントン病原因遺伝子httを発現する培養ニューロンで、図Aのようなballoon様の細胞体膨張が認められ、電子顕微鏡やオルガネラマーカーでの確認から、小胞体膨張というTRIADと同等の形態学的異常を認めた(図B)。ハンチントン病モデルでは、以前から細胞体膨張を伴う非典型的な細胞死は複数報告されていたが、我々は変性疾患原因遺伝子によるTRIAD誘導を示し、その細胞内シグナルの詳細を報告し(図C)、これまで未知であった神経変性疾患とTRIADとの関係性の理解を、前進させることができたと考えている。
発表論文
Mao, Y., Chen, X., Xu, M.,Fujita, K., Sasabe, K.,Homma, H., Murata, M., Tagawa, K., Tamura, T., Kaye, J., Finkbeiner, S., Blandino, G., Sudol, M., Okazawa, H.
Hum Mol Genet. pii: ddw303. doi: 10.1093/hmg/ddw303.
Yamanishi, E., Hasegawa, K., Fujita, K., Ichinose, S., Yagishita, S., Murata, M., Tagawa, K., Akashi, T., Eishi, Y., Okazawa, H.
A novel form of necrosis, TRIAD, occurs in human Huntington's disease.
Acta Neuropathologica Communications, DOI: 10.1186/s40478-017-0420-1.
Hum Mol Genet. pii: ddw303. doi: 10.1093/hmg/ddw303.
Yamanishi, E., Hasegawa, K., Fujita, K., Ichinose, S., Yagishita, S., Murata, M., Tagawa, K., Akashi, T., Eishi, Y., Okazawa, H.
A novel form of necrosis, TRIAD, occurs in human Huntington's disease.
Acta Neuropathologica Communications, DOI: 10.1186/s40478-017-0420-1.

