研究内容の紹介
研究の概要
「糖鎖や核酸などの非タンパク質抗原への獲得免疫応答とその関連領域」をメインテーマとして独創性の高い研究をおこなっています。
糖鎖や核酸などの非タンパク質抗原への獲得免疫応答は感染免疫や自己免疫などで重要な役割を果たし、医学的に重要です。しかし、そのメカニズムは不明であり、免疫学に残された大きなフロンティアの1つとなっています。当研究室では、この未開拓の領域において、基礎的なメカニズムの解明、疾患における役割の解明を行なっています。
近年明らかになってきた、抑制性サイトカインIL10などを産生して自己免疫や炎症性疾患を制御する制御性B細胞も糖鎖シグナルによる制御を受けるなどこの領域と深く関連します。当研究室では、制御性B細胞の機能を増強することで自己免疫疾患を制御する治療薬を開発しています。また、近年開発された画期的な治療薬の多くは抗体医薬ですが、抗体医薬には高価という問題点があります。そこで、抗体医薬の効果を発揮する安価な代替法として治療ワクチンの開発を行っています。
非タンパク質抗原への抗体産生のメカニズムについて
1)タンパク質抗原への抗体産生とメカニズムが異なる非タンパク質抗原への抗体産生
糖鎖や核酸などの非タンパク質抗原への獲得免疫応答は、タンパク質抗原への応答とは大きく異なります。これは、Tリンパ球の抗原レセプターがタンパク質抗原のみにしか反応できず、糖鎖や核酸などの非タンパク質抗原を認識することができないからです。タンパク質抗原への獲得免疫応答の仕組みの解明は進んでいますが、非タンパク質抗原への獲得免疫応答の仕組みには不明の点が多く残されています。
2)微生物抗原と自己抗原および非微生物抗原の識別と免疫疾患
正常な免疫システムは、病原微生物に対して免疫応答をおこしますが、自己抗原や、花粉、食物などの病原微生物以外の異物(このような異物をここでは環境抗原と呼びます)に対しては免疫応答をおこしません。この病原微生物にのみ免疫応答がおこる仕組みは、タンパク質抗原の場合には明らかになっていますが、非タンパク抗原の場合には全く不明です。
Tリンパ球が非タンパク質抗原を通常は認識できないために、非タンパク質抗原への獲得免疫応答ではBリンパ球による抗体産生が中心となります。糖鎖や糖脂質に対する抗体産生は、肺炎球菌など種々の微生物への感染防御で中心的な役割を果たすとともに、ギラン・バレー症候群などの自己免疫疾患の発症に関わります。また、核酸関連抗原への抗体産生は、代表的な全身性自己免疫疾患である全身性エリテマトーデス(SLE)の発症で重要な役割を果たします。したがって、非タンパク質微生物抗原に抗体産生がおこり、自己および環境抗原に抗体産生がおこらないメカニズムの解明は、サイエンティフィックにチャレンジングな課題であるとともに、臨床的にも重要な課題です。
当研究室の研究などにより、自己非タンパク質抗原へのBリンパ球応答を抑制する負のメカニズムと、微生物の非タンパク抗原を自己や環境抗原と識別して微生物抗原に特異的に抗体産生をおこす正のメカニズムがあることが分かってきました。これらの正と負のメカニズムにより、免疫システムは自己や環境中の非タンパク抗原には抗体を産生せず、微生物の非タンパク抗原に抗体を産生すると考えられます。
糖鎖や核酸などの非タンパク質抗原への獲得免疫応答は感染免疫や自己免疫などで重要な役割を果たし、医学的に重要です。しかし、そのメカニズムは不明であり、免疫学に残された大きなフロンティアの1つとなっています。当研究室では、この未開拓の領域において、基礎的なメカニズムの解明、疾患における役割の解明を行なっています。
近年明らかになってきた、抑制性サイトカインIL10などを産生して自己免疫や炎症性疾患を制御する制御性B細胞も糖鎖シグナルによる制御を受けるなどこの領域と深く関連します。当研究室では、制御性B細胞の機能を増強することで自己免疫疾患を制御する治療薬を開発しています。また、近年開発された画期的な治療薬の多くは抗体医薬ですが、抗体医薬には高価という問題点があります。そこで、抗体医薬の効果を発揮する安価な代替法として治療ワクチンの開発を行っています。
非タンパク質抗原への抗体産生のメカニズムについて
1)タンパク質抗原への抗体産生とメカニズムが異なる非タンパク質抗原への抗体産生
糖鎖や核酸などの非タンパク質抗原への獲得免疫応答は、タンパク質抗原への応答とは大きく異なります。これは、Tリンパ球の抗原レセプターがタンパク質抗原のみにしか反応できず、糖鎖や核酸などの非タンパク質抗原を認識することができないからです。タンパク質抗原への獲得免疫応答の仕組みの解明は進んでいますが、非タンパク質抗原への獲得免疫応答の仕組みには不明の点が多く残されています。
2)微生物抗原と自己抗原および非微生物抗原の識別と免疫疾患
正常な免疫システムは、病原微生物に対して免疫応答をおこしますが、自己抗原や、花粉、食物などの病原微生物以外の異物(このような異物をここでは環境抗原と呼びます)に対しては免疫応答をおこしません。この病原微生物にのみ免疫応答がおこる仕組みは、タンパク質抗原の場合には明らかになっていますが、非タンパク抗原の場合には全く不明です。
Tリンパ球が非タンパク質抗原を通常は認識できないために、非タンパク質抗原への獲得免疫応答ではBリンパ球による抗体産生が中心となります。糖鎖や糖脂質に対する抗体産生は、肺炎球菌など種々の微生物への感染防御で中心的な役割を果たすとともに、ギラン・バレー症候群などの自己免疫疾患の発症に関わります。また、核酸関連抗原への抗体産生は、代表的な全身性自己免疫疾患である全身性エリテマトーデス(SLE)の発症で重要な役割を果たします。したがって、非タンパク質微生物抗原に抗体産生がおこり、自己および環境抗原に抗体産生がおこらないメカニズムの解明は、サイエンティフィックにチャレンジングな課題であるとともに、臨床的にも重要な課題です。
当研究室の研究などにより、自己非タンパク質抗原へのBリンパ球応答を抑制する負のメカニズムと、微生物の非タンパク抗原を自己や環境抗原と識別して微生物抗原に特異的に抗体産生をおこす正のメカニズムがあることが分かってきました。これらの正と負のメカニズムにより、免疫システムは自己や環境中の非タンパク抗原には抗体を産生せず、微生物の非タンパク抗原に抗体を産生すると考えられます。
研究のテーマと内容
1. 非タンパク質自己抗原への抗体産生抑制メカニズム
核酸への抗体産生は、代表的な自己免疫疾患の1つ全身性エリテマトーデス(SLE)で特徴的に見られます。当研究室での研究により、Bリンパ球に発現するCD72と呼ばれる抑制性の膜分子が、核酸関連抗原に特異的に結合することで、核酸関連抗原への抗体産生を抑制し、さらにSLEの発症を抑制することを明らかにしました。現在、CD72の詳細な機能解明を行っています。
核酸への抗体産生は、代表的な自己免疫疾患の1つ全身性エリテマトーデス(SLE)で特徴的に見られます。当研究室での研究により、Bリンパ球に発現するCD72と呼ばれる抑制性の膜分子が、核酸関連抗原に特異的に結合することで、核酸関連抗原への抗体産生を抑制し、さらにSLEの発症を抑制することを明らかにしました。現在、CD72の詳細な機能解明を行っています。
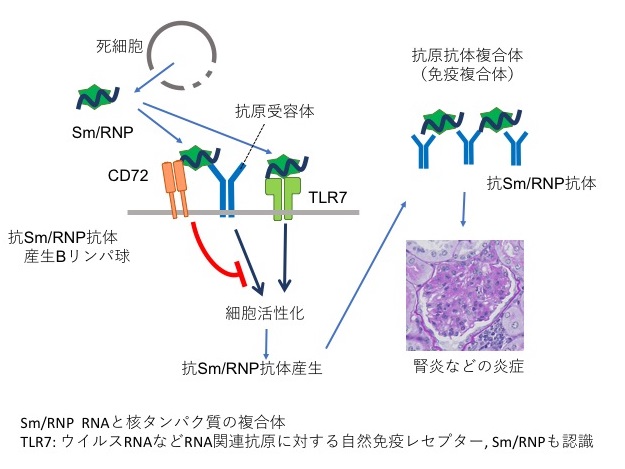
CD72は核酸関連抗原への抗体産生のみを制御することから、CD72の機能を増強できると、微生物への抗体産生を抑制せずに、核酸関連抗原ヘの抗体産生のみを抑制できます。このため、現在SLEの治療に用いられているような非特異的な免疫抑制療法とは異なり、感染症などのリスクなしにSLEを治療することができると期待されます。そこで、CD72の機能を増強する特異的なSLE治療法の開発を行っています。
急性に全身の神経麻痺をきたすギラン・バレー症候群では、神経に主に存在する糖脂質ガングリオシドへの抗体産生がみられ、この自己抗体が疾患発症に関わるとされています。当研究室では、ガングリオシドへの抗体産生抑制のメカニズムおよびギラン・バレー症候群での異常の解明を、患者検体などを用いて行っています。
急性に全身の神経麻痺をきたすギラン・バレー症候群では、神経に主に存在する糖脂質ガングリオシドへの抗体産生がみられ、この自己抗体が疾患発症に関わるとされています。当研究室では、ガングリオシドへの抗体産生抑制のメカニズムおよびギラン・バレー症候群での異常の解明を、患者検体などを用いて行っています。
2. 非タンパク質抗原への抗体産生におけるRedoxosomeの役割の解明
一般的に、レセプターがリガンドと反応するとエンドサイトーシスによりレセプターは細胞内に取り込まれ、エンドソーム、さらに、リソソームに移行して分解されます。エンドソームにおいても、レセプターがシグナル伝達をおこし、さらに、このシグナル伝達が活性酸素種によって増強されることが知られており、このようなシグナル伝達をおこすエンドソームはRedoxosomeと呼ばれています。当研究室では、Bリンパ球が非タンパク質微生物抗原などに応答して、抗体産生を起こす際に、Redoxosomeが重要な役割を果たすことを示唆する結果を得ており、その役割を解明することで、非タンパク質抗原への抗体産生のメカニズムの解明を進めています。
一般的に、レセプターがリガンドと反応するとエンドサイトーシスによりレセプターは細胞内に取り込まれ、エンドソーム、さらに、リソソームに移行して分解されます。エンドソームにおいても、レセプターがシグナル伝達をおこし、さらに、このシグナル伝達が活性酸素種によって増強されることが知られており、このようなシグナル伝達をおこすエンドソームはRedoxosomeと呼ばれています。当研究室では、Bリンパ球が非タンパク質微生物抗原などに応答して、抗体産生を起こす際に、Redoxosomeが重要な役割を果たすことを示唆する結果を得ており、その役割を解明することで、非タンパク質抗原への抗体産生のメカニズムの解明を進めています。
3. 制御性Bリンパ球(B reg 細胞)による免疫疾患制御についての研究
当研究室では、Bリンパ球のIL-10産生誘導メカニズムの解明や、IL-10産生制御シグナルの同定を行なってきました。また、Bリンパ球のIL-10産生が糖鎖シグナルによる制御を受けることを明らかにしました。この知見を活用してIL-10産生増強を誘導する新たな自己免疫疾患治療法の開発を行なっています。
当研究室では、Bリンパ球のIL-10産生誘導メカニズムの解明や、IL-10産生制御シグナルの同定を行なってきました。また、Bリンパ球のIL-10産生が糖鎖シグナルによる制御を受けることを明らかにしました。この知見を活用してIL-10産生増強を誘導する新たな自己免疫疾患治療法の開発を行なっています。
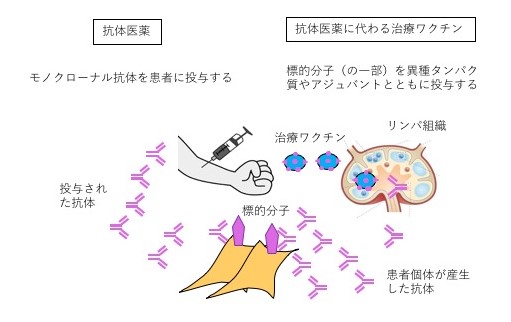
4. 抗体医薬に代わる治療ワクチンの開発
近年の画期的な治療薬の多くは、抗体医薬です。これは、低分子化合物が標的とできないような分子も抗体医薬によって制御できるからです。逆に、低分子化合物で抗体医薬の代替を行なうことは極めて困難です。しかし、抗体医薬は非常に高価になるため、何らかの代替法が求められています。標的分子の一部をワクチンとして免疫することで、患者さん自身が標的分子に対する抗体を作り、抗体医薬と同等の効果を得ることが可能と考えられています。当研究室では、このような抗体医薬に代わる治療ワクチン開発の基盤技術の開発を行っています。この技術により、抗体医薬の導入というパラダイムシフトに匹敵するような、疾患治療のパラダイムシフトが起こると期待されます。
近年の画期的な治療薬の多くは、抗体医薬です。これは、低分子化合物が標的とできないような分子も抗体医薬によって制御できるからです。逆に、低分子化合物で抗体医薬の代替を行なうことは極めて困難です。しかし、抗体医薬は非常に高価になるため、何らかの代替法が求められています。標的分子の一部をワクチンとして免疫することで、患者さん自身が標的分子に対する抗体を作り、抗体医薬と同等の効果を得ることが可能と考えられています。当研究室では、このような抗体医薬に代わる治療ワクチン開発の基盤技術の開発を行っています。この技術により、抗体医薬の導入というパラダイムシフトに匹敵するような、疾患治療のパラダイムシフトが起こると期待されます。