有機フォトン・アップコンバージョン粒子による神経細胞の光操作に成功
~光による生体内での神経活動制御に向けた重要な一歩~
ポイント
- フォトン・アップコンバージョン(UC)※1を用いた生体内における神経細胞の光操作は、生体適合性の低い重金属が必要であった。
- 生体内で近赤外光を青色光に変換可能な、重金属を含まない有機フォトン・アップコンバージョン材料の開発に成功した。
- 青色光に応答するタンパク質と組み合わせることで、生体内で発生したフォトン・アップコンバージョン発光を用いてタンパク質の発現を誘導できた。
概要
今回、九州大学大学院工学研究院の宇治雅記大学院生、楊井伸浩准教授(現 東京大学大学院理学系研究科 教授)らの研究グループは、東京医科歯科大学の味岡逸樹教授、神奈川県立産業技術総合研究所の原央子博士、九州大学大学院工学研究院の近藤純平大学院生(当時)、君塚信夫教授らと共同して、生体透過性が高い赤色・近赤外光を生体内で青色光に変換可能なフォトン・アップコンバージョン(以下、UC)ナノ粒子を開発し、生体内で神経細胞を光操作することに成功しました。
本研究では、新規有機増感剤分子の開発により、赤色・近赤外光から青色光への変換効率が2倍以上更新されました。また、従来のUC材料ではオスミウムといった生体毒性の懸念がある重金属が含まれていましたが、本研究で開発されたUC材料は有機分子のみで構成されており重金属を含みません。マウスの皮下に有機UCナノ粒子を投与し、体外から赤色光を照射することで、生体内で青色光応答性のオプトジェネティクス操作に成功しました。今回の成果により、生体内の神経活動を低侵襲的に光操作できるようになり、オプトジェネティクスによる生命・医療分野への展開が期待されます。
本研究成果は、2024年9月23日(現地時間) にWileyの国際学術誌「Advanced Materials」にオンライン掲載されました。
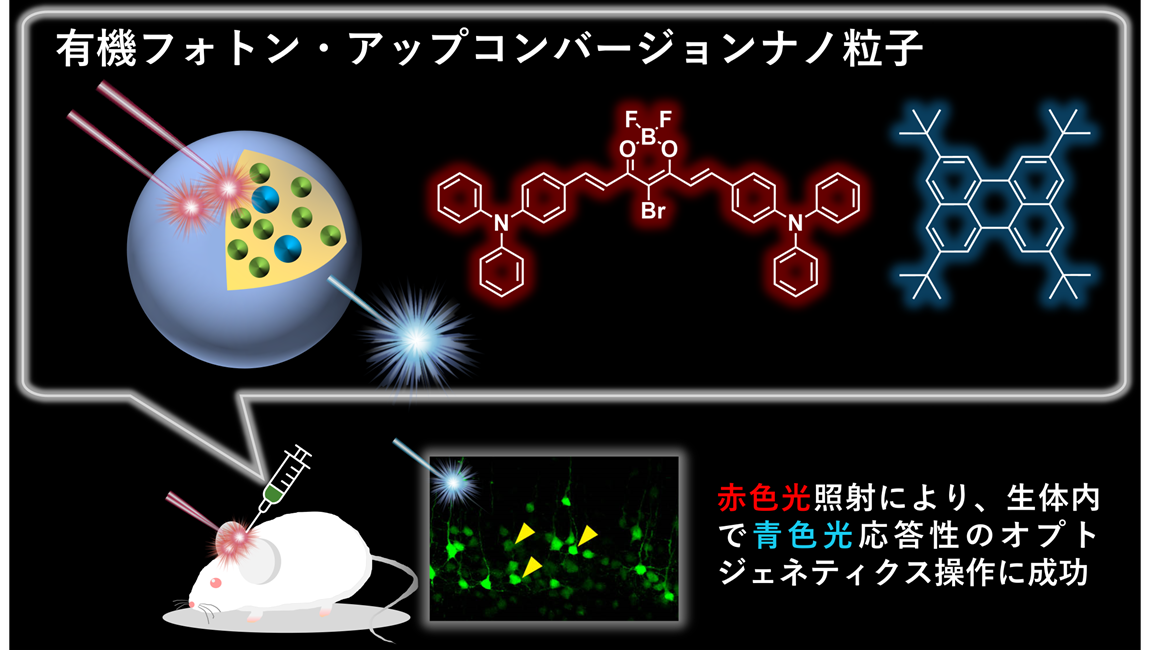
(参考図)生体内で赤色光が青色光に変換され、青色光に応答する蛍光タンパク質の発現を誘導。
本研究は、重金属を含まない有機分子のみからなるフォトン・アップコンバージョン材料で生体内オプトジェネティクスを実証した初めての例です。今後は、脳深部における複雑な神経細胞を光操作することで、侵襲性の低い神経細胞制御法の確立を目指します。
研究の背景と経緯
この問題を解決するための手法として、生体組織への高い透過性を示す赤色光や近赤外光(波長 630 nm以上)を青色光(波長500 nm以下)に変換するフォトン・アップコンバージョン(UC)技術が近年注目を集めています。アップコンバージョンにはいくつかの機構が存在しますが、特に有機分子の三重項※3-三重項消滅※4に基づくアップコンバージョン(TTA-UC)は他の機構よりも弱い強度の光を変換可能であるという点でより実用的であると言えます(図1)。UC材料は、体外から照射された赤色光を生体内で青色に変換することで、侵襲性の低い生体内青色光源として機能します。これまでにUC材料を用いた生体外/生体内オプトジェネティクスが実証されてきましたが、生体毒性の懸念がある重金属材料を含むことが課題でした。
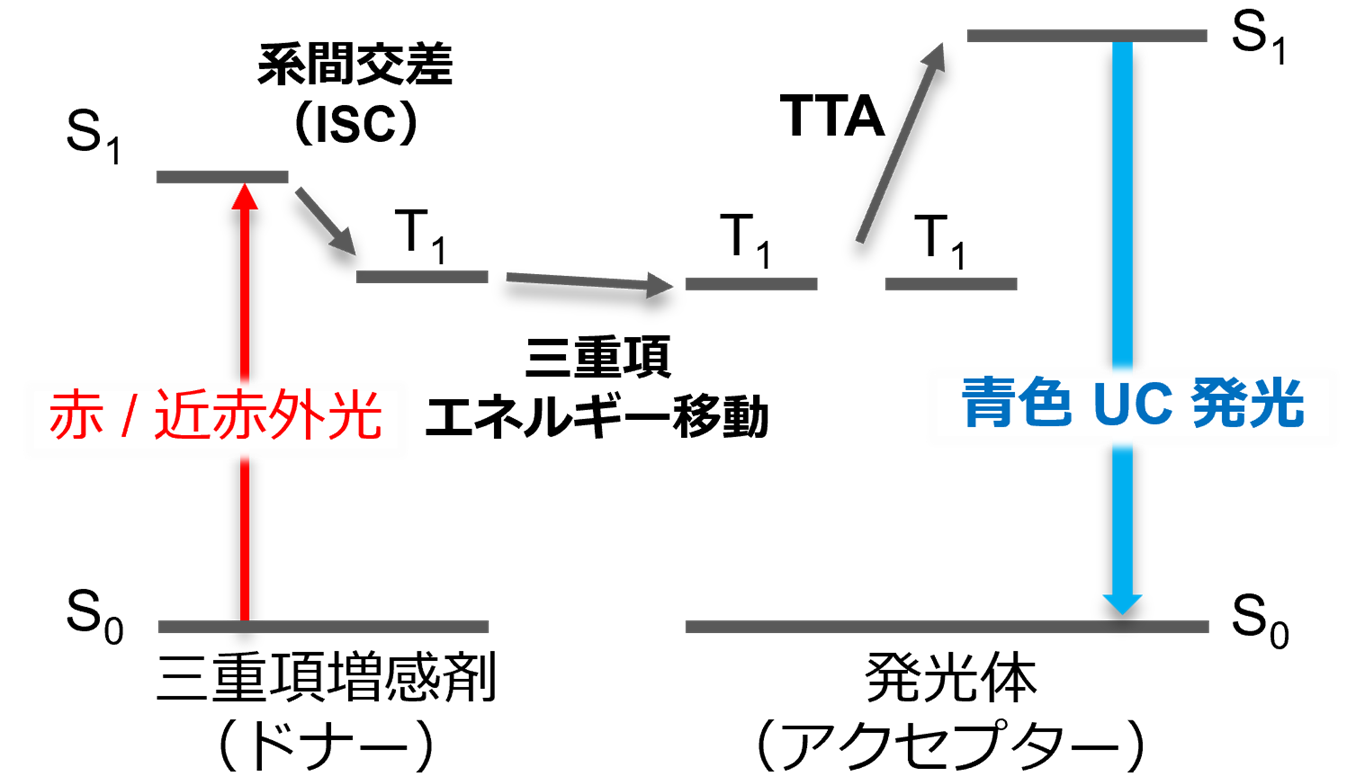
図1. 赤/近赤外光→青色TTA-UCのエネルギーダイアグラム。
研究の内容と成果
今回の研究では、重金属を含まない有機フォトン・アップコンバージョンナノ粒子を用いた生体内オプトジェネティクスを初めて実証しました。重金属を含まない新規三重項増感剤として、ブロモ基を有する熱活性化遅延蛍光(TADF)※5材料を設計しました。有機TADF増感剤にブロモ基を導入することで、重原子効果により励起一重項状態から励起三重項状態への系間交差(ISC)効率が促進され、UC効率が大幅に向上しました(図2)。
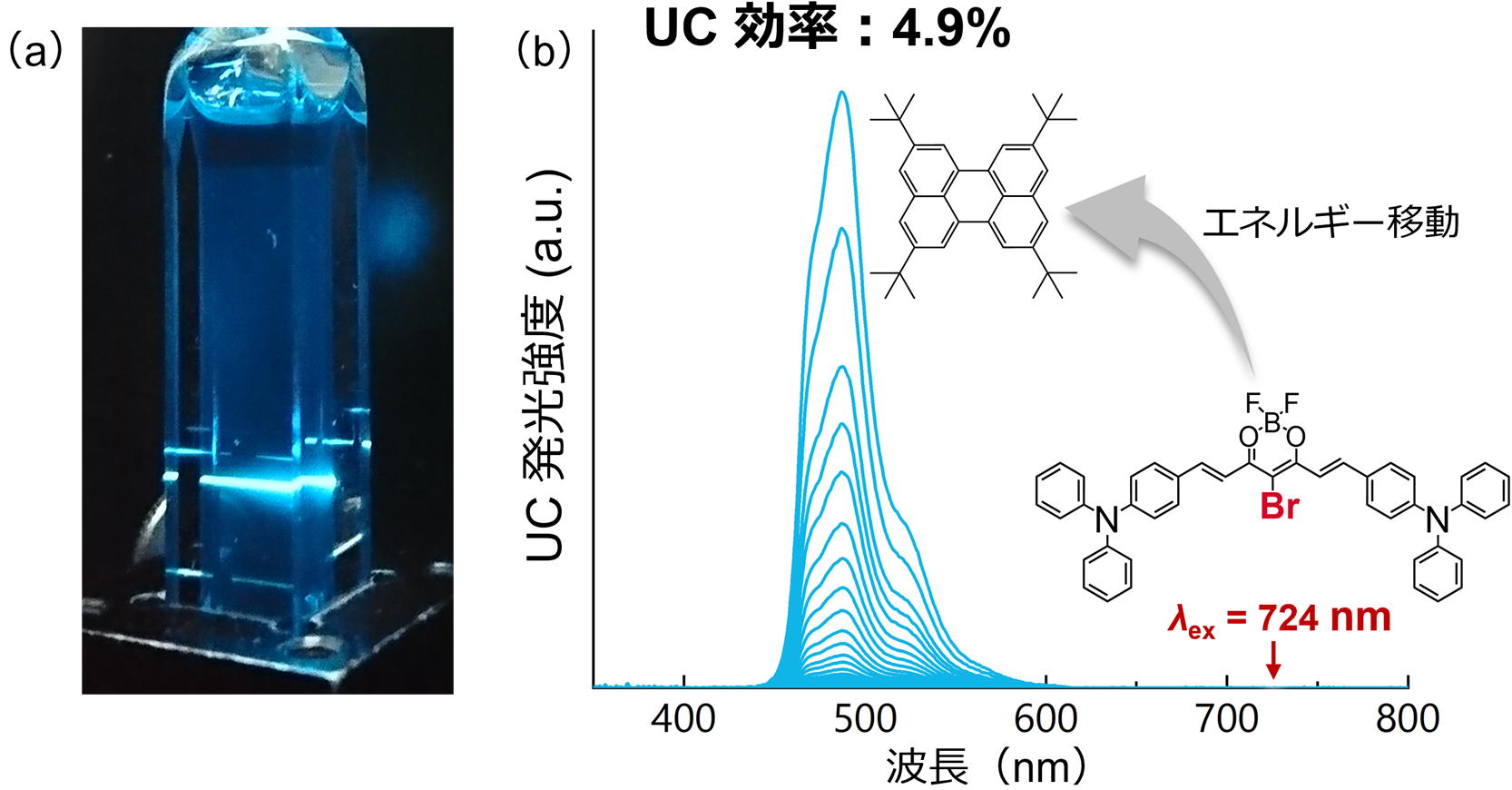
図2. 近赤外光レーザー照射時の(a)青色UC発光を示すサンプルと(b)新規TADF増感剤を用いた近赤外光から青色光へのUC発光スペクトル。
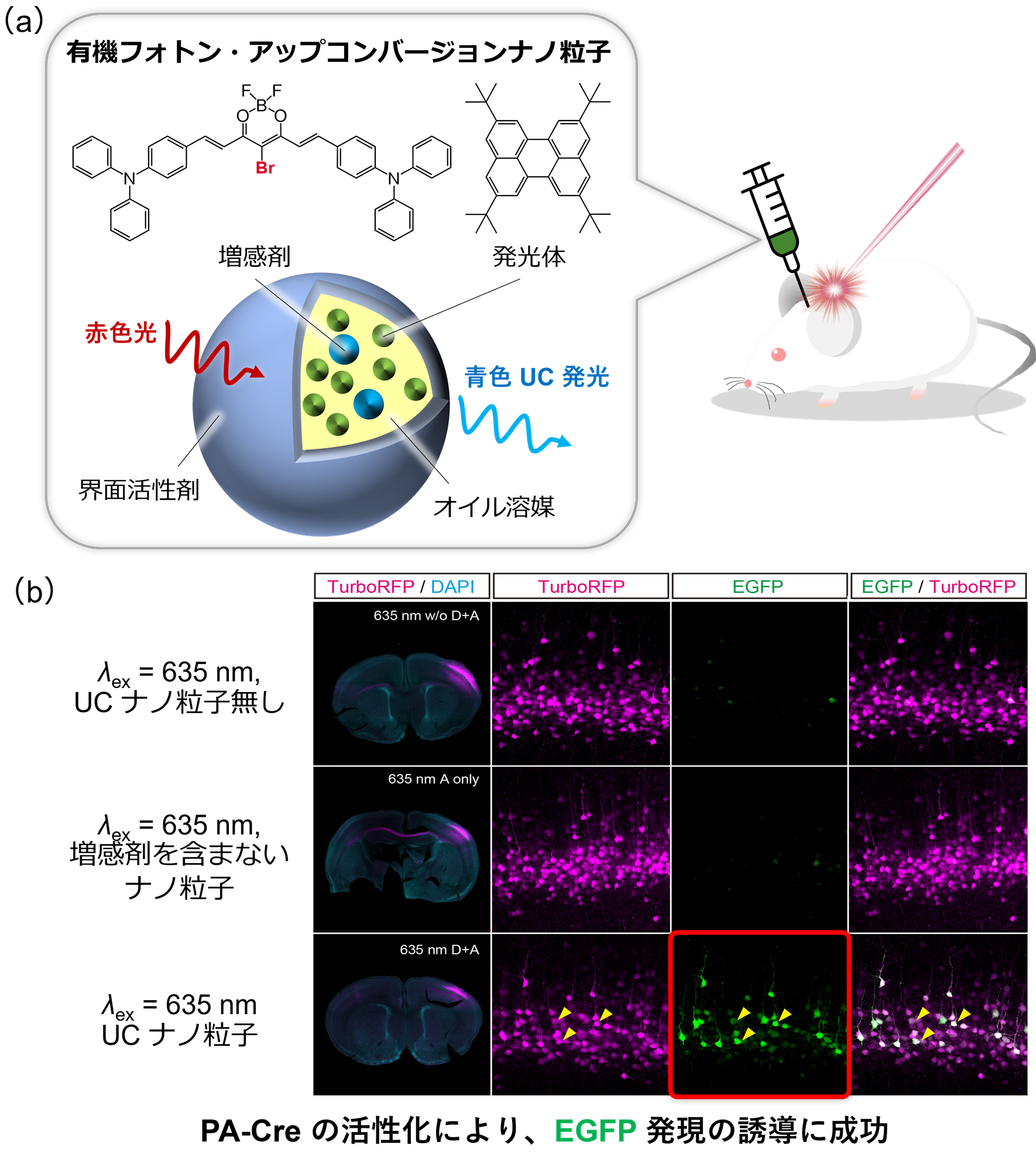
図3.(a)重金属フリーのUC材料からなる水中油型有機UCナノ粒子、(b)有機UCナノ粒子を用いた生体内オプトジェネティクス。遺伝子導入された神経細胞を赤色蛍光タンパク質TurboRFPで可視化した。PA-Creの活性化で発現誘導されるEGFPの蛍光画像より、UCナノ粒子の投与群のみPA-Creの活性化が確認された。
今後の展開
用語解説
(※1) フォトン・アップコンバージョン(UC)
低いエネルギーを持つ光を高いエネルギーを持つ光に変換する方法論です。古典的には、第二次・第三次高調波発生、多光子吸収などの非線形光学現象が用いられてきました。近年では希土類元素の多段階励起も多く報告されていますが、高い励起光強度の光が必要となるため、適応範囲が限られています。そこで近年、太陽光程度の弱い光でも駆動しうる三重項-三重項消滅(TTA)に基づく UC 機構が注目を集めています。
(※2) オプトジェネティクス(光遺伝学)
光によって活性化されるタンパク質をコードする遺伝子を特定の細胞に発現させ、そのタンパク質機能を光で制御する技術を指します。生体内で、特定の神経細胞機能を光で制御できるため、神経科学研究の革新的ツールと言われています。
(※3)三重項
分子の状態の一つで、スピン多重度 2S + 1 = 3 となるような、スピン量子数 S = 1 の状態(基底状態と励起状態の電子スピンが打ち消しあわない状態(図4)を指します。励起三重項状態(T1)から基底一重項状態(S0)への失活はスピン禁制遷移であるためとても遅く、近くの分子にエネルギーを受け渡すことができます。
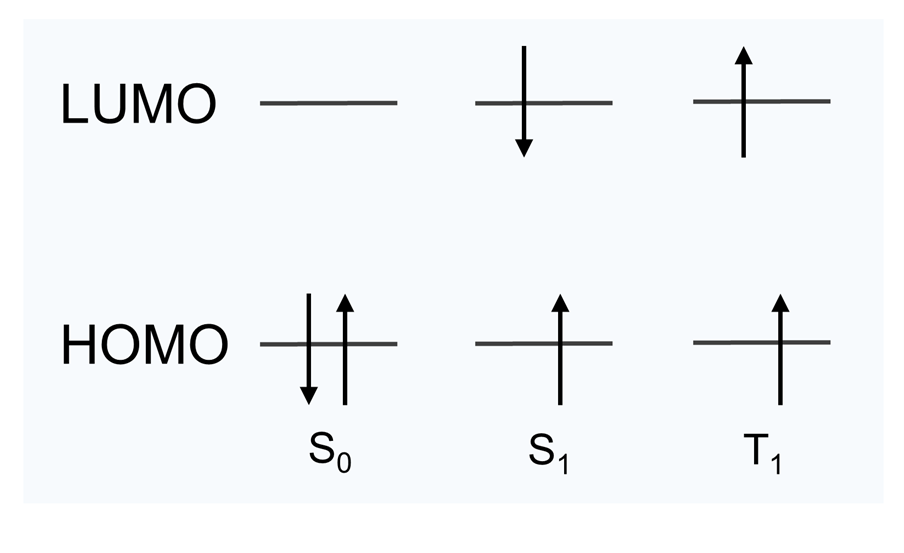
図4. 基底一重項状態(S0)、励起一重項状態(S1)、励起三重項状態(T1)の電子配置。
二つの励起三重項状態(T1)の分子が衝突することで、一方のエネルギーが他方に移り、エネルギー的により高い励起状態が生成する過程を指します。ここで、T1の分子二つの持つエネルギーが一つの分子の励起一重項状態(S1)の持つエネルギーより大きいとき(2xET1 > ES1)、TTAを経た後にS1の一分子が効率よく生成されます。
TTAを起こす発光体(アクセプター分子)とT1を効率的に生成する増感剤(ドナー分子)を組み合わせ、フォトン・アップコンバージョンを起こす方法がTTA-UCと呼ばれています。一般的なTTA-UCでは、まずドナー分子が光を吸収し、項間交差(intersystem crossing, ISC)を経て、T1を生成します。その後、ドナーからアクセプターへの三重項エネルギー移動(triplet energy transfer, TET)により、アクセプターのT1が生成されます。二分子のアクセプターT1が拡散・衝突してTTAを起こすことで、ドナーS1より高いエネルギーを持つアクセプター S1 が生じ、UC発光が得られます(図5)。
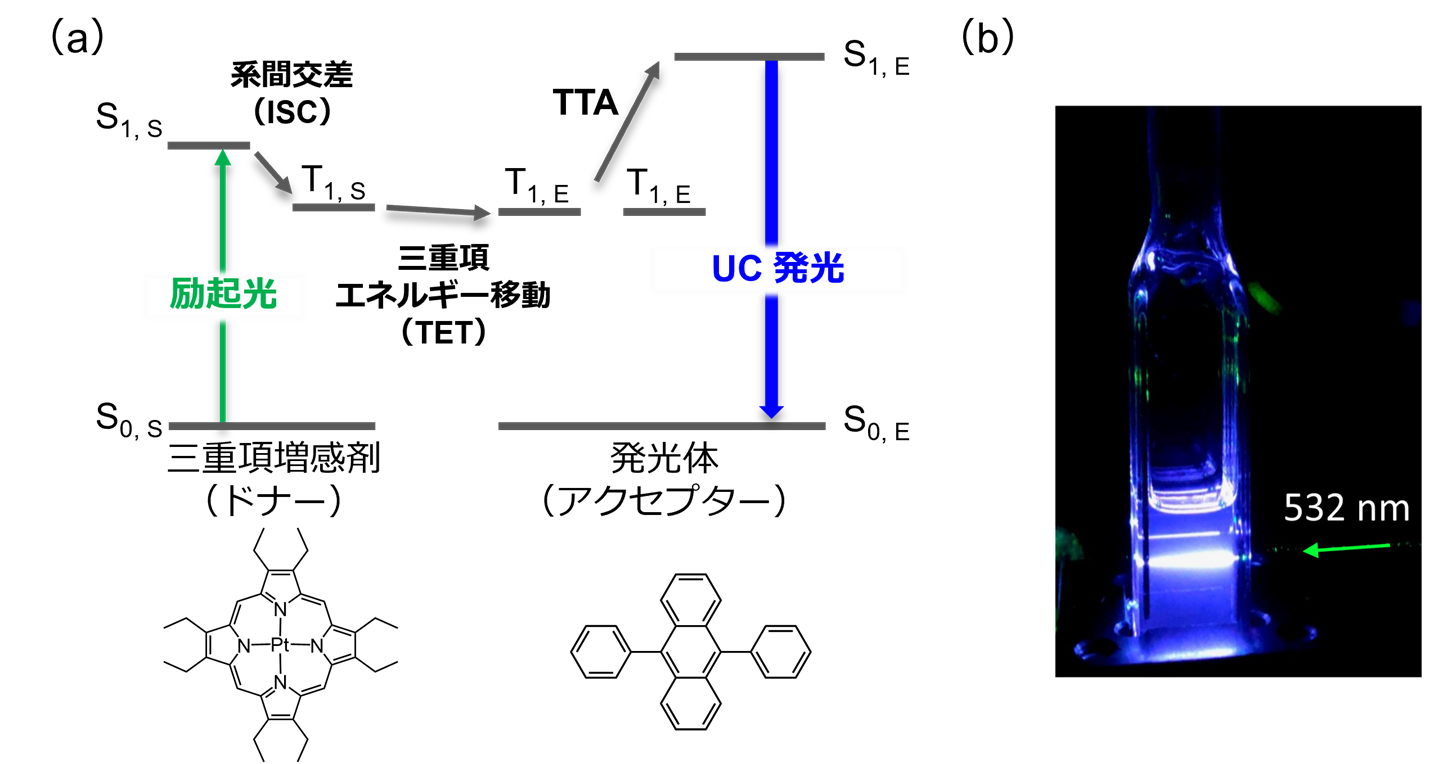
図5.(a)ISCを経由する一般的なTTA-UCのメカニズム、(b)代表的なTTA-UC色素である白金オクタエチルポルフィリンと9,10-ジフェニルアントラセン溶液による緑→青TTA-UCの様子。
三重項励起状態(T1)から一重項励起状態(S1)へ熱的に励起されることで逆項間交差(RISC)を起こし、S1 状態から観測される長寿命成分の遅延蛍光のこと。重原子を用いない低コストな発光材料であることから、有機EL材料として盛んに研究が行われています。三重項―三重項消滅に基づくUCでは、三重項増感剤として用いられます。
謝辞
論文情報
掲載誌:Advanced Materials
論文タイトル:In Vivo Optogenetics Based on Heavy Metal-Free Photon Upconversion Nanoparticles
(重金属フリーなフォトン・アップコンバージョンナノ粒子を用いた生体内オプトジェネティクス)
著者名:宇治雅記・近藤純平・原央子・秋本沙織・晴気怜奈・佐々木陽一・君塚信夫・味岡逸樹・楊井伸浩
DOI:10.1002/adma.202405509
お問合せ先
<研究に関すること>
東京大学 大学院理学系研究科 化学専攻
教授 楊井 伸浩(ヤナイ ノブヒロ)
Mail:yanai[@]chem.s.u-tokyo.ac.jp
東京医科歯科大学 統合研究機構 脳統合機能研究センター(マテリアル神経科学分野)
教授 味岡 逸樹(アジオカ イツキ)
Mail:iajioka.cbir[@]tmd.ac.jp
九州大学 大学院工学研究院 応用化学部門
教授 君塚 信夫(キミヅカ ノブオ)
Mail:kimizuka.nobuo.763[@]m.kyushu-u.ac.jp
<報道に関すること>
九州大学 広報課
Mail:koho[@]jimu.kyushu-u.ac.jp
東京医科歯科大学 総務部総務秘書課広報係
Mail:kouhou.adm[@]tmd.ac.jp
東京大学 大学院理学系研究科・理学部 広報室
Mail:media.s[@]gs.mail.u-tokyo.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

