「 老化と神経変性疾患の関係性を、核小体分子PQBP3が説明する 」【岡澤均 教授】

岡澤 均(オカザワ ヒトシ)難治疾患研究所 神経病理学分野 教授(上段左)
吉岡 優希(ヨシオカ ユキ)難治疾患研究所 神経病理学分野 大学院生(上段中央)
黄 勇(ヨン ファン)難治疾患研究所 神経病理学分野 大学院生(上段右)
本間 秀典(ホンマ ヒデノリ)難治疾患研究所 神経病理学分野 特任准教授(下段左)
田中 ひかり(タナカ ヒカリ)難治疾患研究所 神経病理学分野 講師(下段右)
―老化と神経変性疾患に共通した分子基盤を解明―
ポイント
- 老化は神経変性疾患の最大のリスク因子であり、老化と神経変性疾患の関連性が注目されてきました。
- しかし、老化と神経変性疾患病態の関係性の分子基盤の理解は未だ十分ではありません。
- 今回、岡澤教授の研究グループが20年以上前に発見した分子であるPQBP3の機能低下が、老化と神経変性疾患病態の関連性を分子レベルで説明できることを示しました。
- PQBP3は核膜の安定性を保つ機能を持つこと、細胞老化においてはPQBP3が細胞核から減少すること、神経変性疾患病態においてはPQBP3が疾患タンパク質と結合して細胞核から減少することを示しました。
- したがって、老化と神経変性疾患の両病態では共通して、PQBP3の機能が低下するために、核膜が不安定化し核DNAが細胞質に漏出する状態(細胞老化)に陥ることが示されました。
研究の背景
また、老化のモデルとして「細胞老化(senescence)」が知られています。これは、培養細胞が分裂できる回数には上限があり(50回程度)、その結果として分裂を止めた細胞の状態を意味しています。このような細胞老化では、細胞の核膜が不安定化していること、Lamin B1などの核膜の裏打ちタンパク質が減少していることが知られています。このような細胞老化は高齢者の皮膚や脳グリア細胞※1にも見られるため、senolysisと呼ばれる老化細胞除去による治療法の開発が進んでいます。しかし、もともと細胞分裂を停止している神経細胞であるニューロン※1に同様の治療法を用いることは、ニューロンを殺してしまうことになり、ニューロンにおける細胞老化と神経変性の関係性は、この点でも重要な研究課題です。
一方、岡澤教授の研究グループでは20年以上前に、神経変性疾患の主要カテゴリーのひとつであるポリグルタミン病(脊髄小脳失調症1型やハンチントン病を含む10種類以上の神経変性疾患が含まれる神経変性疾患グループ)の原因タンパク質と結合して細胞毒性の起点となる正常タンパク質を網羅的にスクリーニングしました。この結果、PQBP1, PQBP3, PQBP5, VCPなどのタンパク質を発見しました(Imafuku et al, BBRC 1998; Waragai et al, Hum Mol Genet 1999)。PQBP1はRNAスプライシングの調節因子であり、神経細胞ではシナプス関連遺伝子の発現調節に関わること(Okazawa et al, Neuron 2002; Ito et al, Mol Psychiatry 2015; Tanaka et al, Mol Psychiatry 2018)、遺伝性知的障害の原因遺伝子であること(Kalscheuer et al, Nature Genet 2003)、アルツハイマー病の神経細胞では減少していること(Tanaka et al, Mol Psychiatry 2018)、自然免疫細胞ではアルツハイマー病のタウ蛋白やエイズウィルス蛋白・DNAと結合して炎症反応を惹起すること(Yoh et al, Cell 2015; Yoh et al, Mol Cell 2022; Jin et al, Nature Comun 2021)、がわかっています。また、PQBP5は細胞の正常状態およびストレス状態において核小体構造を形成・維持するための必須分子であることがわかっています(Jin et al, Nature Commun 2023)。
残されたPQBP3の機能解明を目指して、岡澤教授グループが20年にわたって研究を続けた結果が今回の発表につながりました。
なお、PQBP3とPQBP5はこの20年の間に、他の研究グループが核小体構成成分の質量分析研究を行った際にNOL7, NOL10という名称をつけたため、PQBP3/NOL7あるいはPQBP5/NOL10とも呼ばれます。
研究成果の概要
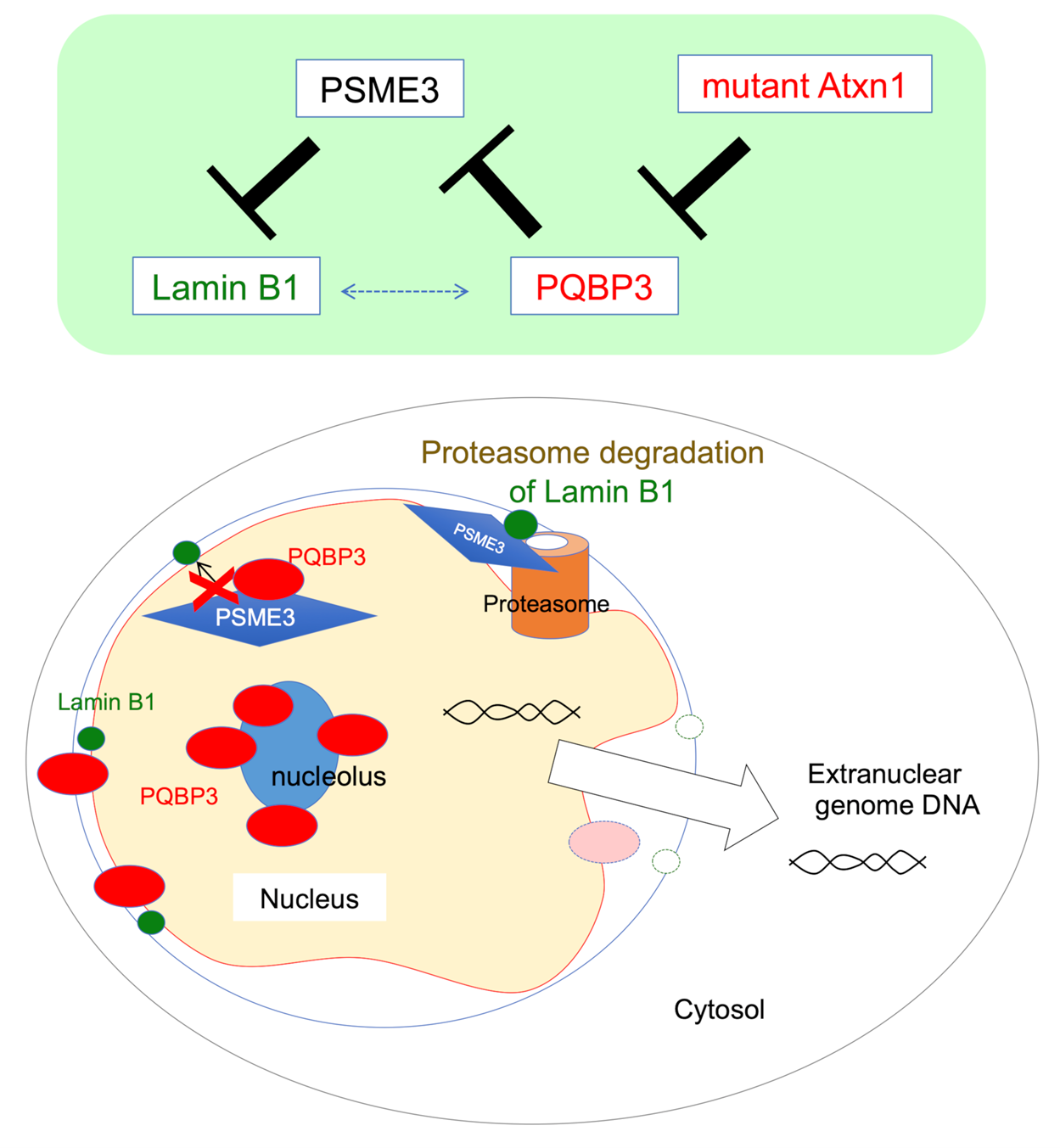
図1説明:
PQBP3は核小体に貯蔵されているが、その一部が正常状態において核膜に移動し、PSME3による核膜裏打ちタンパク質Lamin B1の分解を抑制している。
細胞老化では、mTORシグナル活性化を通じてPQBP3が細胞質に移動してしまうために、核内および核膜裏打ち部から不足する。また、SCA1のようなポリグルタミン病では、疾患タンパク質が蓄積・凝集した封入体にPQBP3が引き寄せられるため、やはり、PQBP3が細胞質に移動してしまうために、核内および核膜裏打ち部から不足する。
研究成果の意義
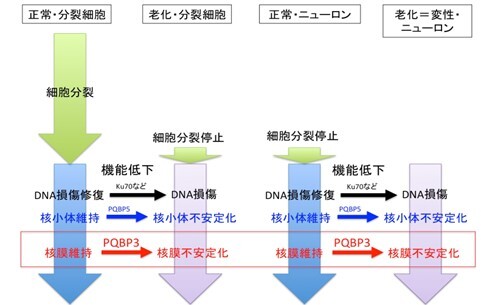
図2説明:
分裂細胞と非分裂細胞(ニューロン)のそれぞれにおける細胞老化の分子基盤を図示する。
用語解説
※1 神経細胞、ニューロン、グリア
脳には、分裂を止めた神経細胞であるニューロンと、分裂を続けているグリアがある。ニューロンはニューロン同士の微小な結合部であるシナプスを介して神経回路を形成し、化学的シグナルである伝達物質を電気的シグナルである膜電位の脱分極に変換することで、脳内の電気回路として機能する。グリア細胞は、ニューロンの形成する神経回路の維持・調節に機能するとともに、再生・修復にも大きな役割を果たしている。細胞老化については、細胞分裂の有無から、少数の例外的局面を除き、成熟ニューロンとグリアでは大きな差異があると考えられる。
論文情報
掲載誌: The EMBO Journal
論文タイトル: PQBP3 prevents senescence by suppressing PSME3-mediated proteasomal Lamin B1 degradation
DOI: https://doi.org/10.1038/s44318-024-00192-4
研究者プロフィール

岡澤 均(オカザワ ヒトシ) Hitoshi Okazawa
東京医科歯科大学 難治疾患研究所
神経病理学分野 教授
研究領域
神経内科学、神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 大学院生
研究領域
神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 大学院生
研究領域
神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 講師
研究領域
神経科学、神経病理学、分子生物学

東京医科歯科大学 難治疾患研究所
神経病理学分野 非常勤講師
金沢大学 子どものこころの発達研究センター
特任准教授
研究領域
神経科学、神経病理学、分子生物学

本間 秀典(ホンマ ヒデノリ) Hidenori Homma
東京医科歯科大学 難治疾患研究所
神経病理学分野 特任准教授
研究領域
数理情報学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
神経病理学分野 岡澤 均(オカザワ ヒトシ)
E-mail:okazawa.npat[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

