がん抑制の分子メカニズム解明に新局面
~ゲノム異常の原因解明に期待~
ポイント
- がん抑制タンパク質p53の有無によりDNA複製期ヒストンH3.1の動態が異なることを発見。
- ヒストンH3.1は核脂質フォスファチジン酸と結合することで核膜に係留されることを発見。
- 核膜に係留されたH3.1が通常とは異なる化学修飾を受けるメカニズムを解明。
概要
p53は代表的ながん抑制タンパク質で、正常な細胞ががん化することを抑制する重要な機能を担っています。一方、p53が担う機能には多様性があり、がん抑制に寄与する未知の働きがあると考えられています。
生理的な細胞分化やがんなどの病的状態では、それぞれの細胞のDNAの読み取られ方、すなわち遺伝子発現状態が大きく変化します。DNAが巻き付くヒストンには様々な化学的な「印」が付けられ(化学修飾)、この印に応じてDNAの読み取られやすさが変化しますが、ヒストンが細胞質から核内へ適切に運ばれ、分布し、細胞の状況に応じた化学修飾を受ける仕組みには不明点が多く残されています。
今回、研究グループはp53欠失に伴い、ある種のヒストンの細胞核内における分布と化学修飾が異常になることを発見し、その詳しい分子メカニズムを明らかにしました。
今回の研究で明らかにしたことは、がんで見られる遺伝子発現異常の原因の一つである可能性があり、さらに研究を進めることで新しいがん治療戦略の開発につながることが期待されます。
なお、本研究成果は、2024年6月21日(金)公開のLife Science Alliance誌に掲載されました。
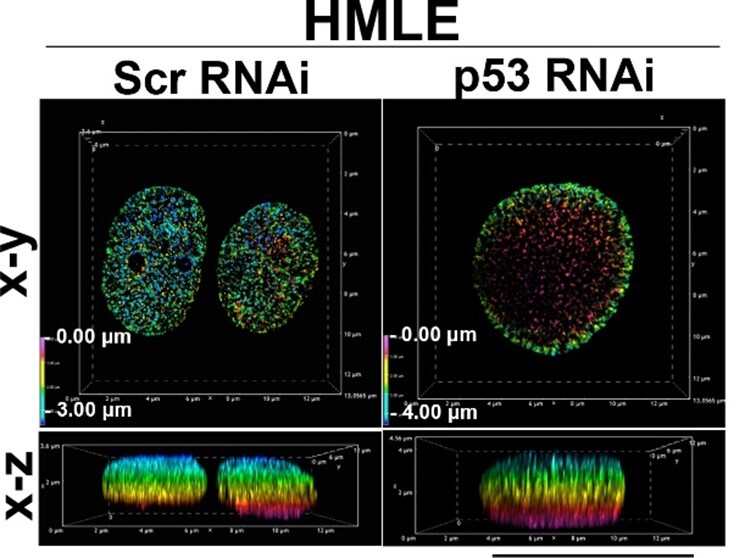
正常乳腺上皮細胞株HMLEの核におけるメチル化ヒストンの分布を超解像顕微鏡で観察したもの。対照(Scr RNAi)に比べ、p53発現抑制(p53 RNAi)によりメチル化ヒストンの分布が核膜近傍に濃縮する。
スケールバー23は10 μm。
背景
ゲノムDNA、ヒストン、その他の制御分子からなるクロマチンは、遺伝子発現制御の基本単位です。メチル化やアセチル化などのヒストン化学修飾は、クロマチンと制御分子の結合性などに影響を与え、遺伝子発現に深く関与します。実際、複数のがんでヒストン遺伝子に変異が報告され、この変異が原因で通常とは異なるヒストン化学修飾状態が実現していることが知られています。
これまでの研究から、ヒストン化学修飾が細胞の分化状態の遷移や維持に重要であることが示唆されていますが、分化状態に応じて、あるいは病的状況でどのような種類のヒストン化学修飾が施され、維持されるか、そのメカニズムは依然として不明のままです。
がん抑制タンパク質として知られるp53は様々な分子の転写を司る転写因子*2であり、がんの半数以上は正常p53を失っていることが知られています。研究グループはがんにおけるp53機能の研究を進める中で、正常p53を失うと細胞核内において特定の化学修飾を持つヒストン(27番目のリジン残基(K27)に三つのメチル基(me)を持つヒストンH3: H3K27me3)の分布が変化することに気づきましたが、そのメカニズムや意義は不明でした。
研究手法
研究成果
そこで、この現象の詳しいメカニズムを解明するために、H3.1と相互作用するタンパク質を網羅的に調べました。その結果、p53が存在する時に相互作用量が増加する分子として、核膜脂質制御に関わる分子であるCTDNEP1を、逆にp53が存在しない時に相互作用量が増加する分子として、H3のK27残基のメチル化を担うEZH2を同定しました。
さらに詳しい分子メカニズムを調べると、p53にはCTDNEP1のタンパク質量を増加させる作用があり、このことが核脂質の一つ、フォスファチジン酸をジアセルグリセロールへ変換させることに寄与することが分かりました。H3.1はジアセルグリセロールよりもフォスファチジン酸に強く結合するため、p53のこの作用によりH3.1は核内でスムーズに動けることが示唆されました。このことは、ゲノム編集技術を用いてH3.1に蛍光タンパク質を融合させ、FRAP(光褪色後蛍光回復)法*5で核内に流入するH3.1の挙動をライブ観察することでも確かめられました(図1)。
今後への期待
謝辞
関連するプレスリリース
化阻止やiPSの安全性に重要な可能性を示唆~」
発表日:2018年1月26日
URL:https://www.hokudai.ac.jp/news/180126_pr.pdf
論文情報
論文名 p53 ensures the normal behavior and modification of G1/S-specific histone H3.1 in the nucleus(p53はG1/S期特異的ヒストンH3.1の正常な核内動態と化学修飾を制御する)
著者名 及川 司1、長谷川純矢2、半田 悠1、大西なおみ3、小野寺康人1、4、橋本あり1、佐々木純子2、佐々木雄彦2、植田幸嗣3、佐邊壽孝1、5(1北海道大学大学院医学研究院分子生物学教室、2東京医科歯科大学難治疾患研究所未来生命科学研究部門病態生理化学分野 、3公益財団法人がん研究会がんプレシジョン医療研究センター、4北海道大学大学院医学研究院医理工学グローバルセンター、5北海道大学遺伝子病制御研究所)
雑誌名 Life Science Alliance(生命科学の専門誌)
DOI 10.26508/lsa.202402835
公表日 2024年6月21日(金)(オンライン公開)
お問い合わせ先
北海道大学大学院医学研究院 講師 及川 司(おいかわつかさ)
メール oikawa_tsukasa[@]med.hokudai.ac.jp
URL https://molbiolhokudai.wixsite.com/website
北海道大学名誉教授/北海道大学遺伝子病制御研究所 客員教授 佐邊壽孝(さべひさたか)
メール sabeh[@]med.hokudai.ac.jp
東京医科歯科大学難治疾患研究所 教授 佐々木雄彦(ささきたけひこ)
メール tsasaki.pip[@]mri.tmd.ac.jp
公益財団法人がん研究会がんプレシジョン医療研究センター
がんオーダーメイド医療開発プロジェクト プロジェクトリーダー 植田幸嗣(うえだこうじ)
メール koji.ueda[@]jfcr.or.jp
配信元
北海道大学社会共創部広報課(〒060-0808 北海道札幌市北区北8条西5丁目)
メール jp-press[@]general.hokudai.ac.jp
東京医科歯科大学総務部総務秘書課広報係(〒113-8510 東京都文京区湯島1-5-45)
メール kouhou.adm[@]tmd.ac.jp
公益財団法人がん研究会社会連携部広報課(〒135-8550 東京都江東区有明3-8-31)
メール ganken-pr[@]jfcr.or.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。
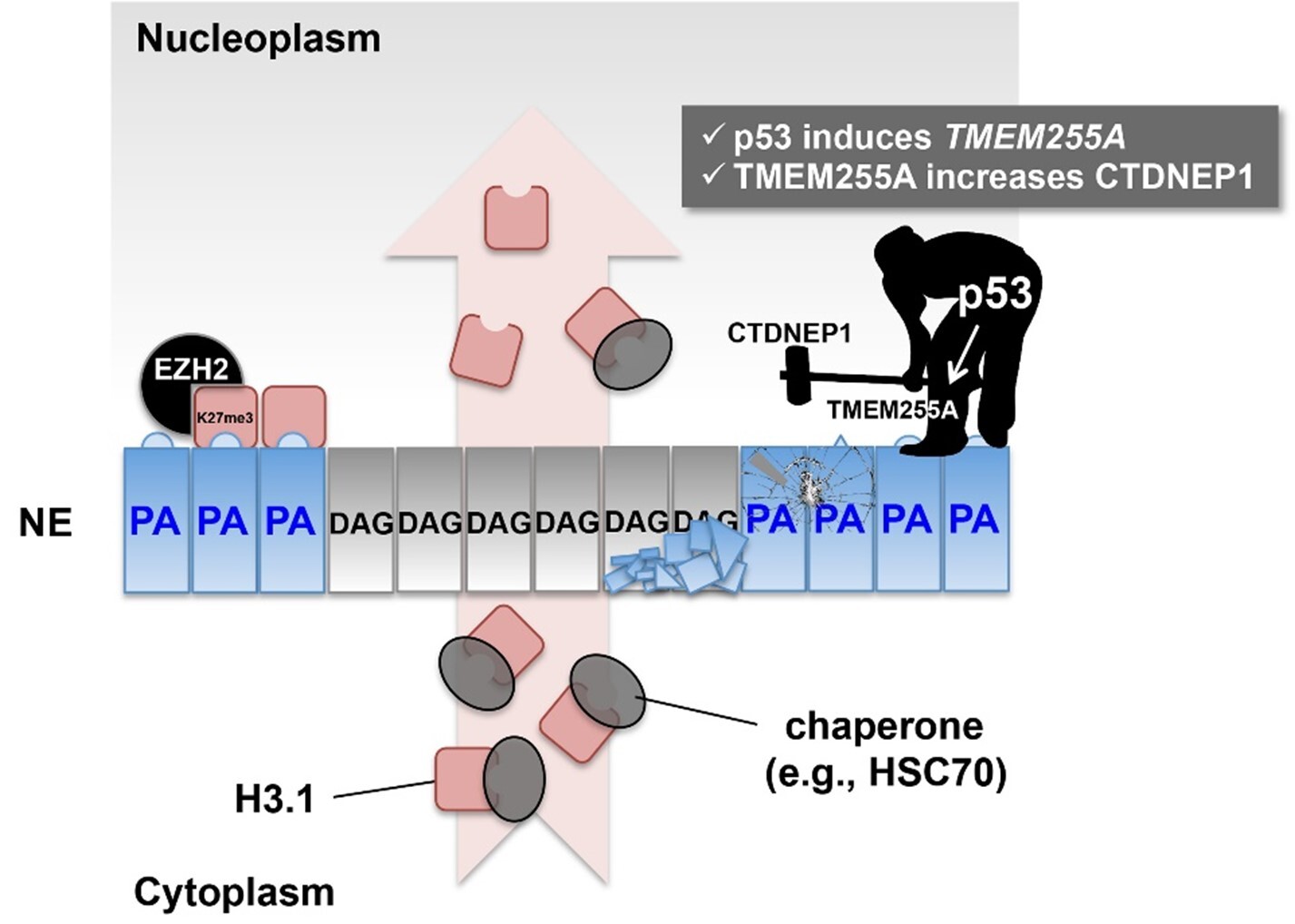
【参考図】
図1. 本研究で明らかになったヒストンH3.1の核内動態制御メカニズム。ヒストンH3.1はDNA複製
期に細胞質(Cytoplasm)から核質(Nucleoplasm)へ移行する。核膜(NE)は通常p53とCTDNEP1の働きによりフォスファチジン酸(PA)がジアシルグリセロール(DAG)に変換され、PAのレベルは低く保たれている。p53の喪失などを契機としてPAのレベルが高まると、H3.1は核膜に係留され、EZH2によるメチル化を受ける。
用語解説
*2 転写因子 … ゲノムDNAに結合し、遺伝子の発現を制御するタンパク質。
*3 細胞周期 … 一つの細胞が二つの娘細胞を生む過程で、細胞はゲノムDNAやヒストンを含む染色体を倍化させるDNA複製期(S期)、倍加した染色体が細胞質と共に娘細胞へ分配されるM期、それらの間の間期(G1期及びG2期)を経る。この周期(M-G1-S-G2-M)を細胞周期と呼ぶ。
*4 バリアント … 単一の遺伝子または遺伝子ファミリーに由来する、一連の類似したタンパク質。ヒトのヒストンH3タンパク質には八つのバリアントが存在し、染色体における位置や細胞周期の特定のフェーズにそれぞれが異なる役割を果たすことが知られるが、その制御には不明な点も多い。
*5 FRAP(光褪色後蛍光回復)法 … 細胞の特定部分に強いレーザーを当て、その部分に存在する蛍光分子を褪色させた後、蛍光の回復を観察する手法。

