「 アンチセンス核酸(ASO)による異常αシヌクレイン病理伝播抑制 」【横田隆徳 教授、永田哲也 教授】
― パーキンソン病等シヌクレイノパチー治療応用への可能性 ―

ポイント
- 振戦(ふるえ)、動作緩慢、筋強剛(筋固縮)、姿勢保持障害(転びやすいこと)を来すパーキンソン病※1は神経変性疾患の一つであり、原因タンパク質であるαシヌクレイン蛋白質(aSyn)※2の伝播が注目されています。
- 研究グループは、パーキンソン病のモデル動物である線維化aSynを脳に局所接種することで異常病理が伝播するモデルマウスを用いています。このモデルマウスに対してαシヌクレイン遺伝子 (Snca)を標的とするアンチセンス核酸(ASO)※3を局所投与することで内因性αシヌクレイン蛋白質を抑制し、異常病理の伝播の変化について検討しました。
- ASOをaSyn接種前に投与することで異常病理の出現が予防され、接種後(7-14日後)に投与することでも、既に進展している異常病理の更なる進展のみならず出現していた異常病理が改善している可能性が示されました。更にASOを線維化aSyn接種部位と異なる遠隔の脳領域に事前投与する事でASO投与部位周囲への異常病理進展抑制を認めました。これらの結果は発症後に投与しても症状の改善が期待でき、運動症状発症後でも投与する事で認知症等の新規の症状が出現することを予防できる可能性を示唆しています。
- 核酸医薬によるパーキンソン病等のαシヌクレイノパチーの様々な病期に応じた治療応用が期待されます。
研究の背景
ASOは細胞内で標的mRNAの分解を特異的に誘導し、対応するタンパク質を減少させます。aSynをコードするSnca mRNAを標的としたASO治療は、PD動物モデルにおける側脳室注射により脳全体のaSynの減少が病理伝播を予防・抑制する事が示されています。
研究グループはSnca ASOの病期に応じた治療効果を評価する為に線維化aSyn線条体接種モデルマウスを用いて、ASOの投与時期と部位毎に、aSyn病理の細胞内および神経回路を介した異常aSyn病理伝播に対する予防・進行抑制効果を示しました。
研究成果の概要
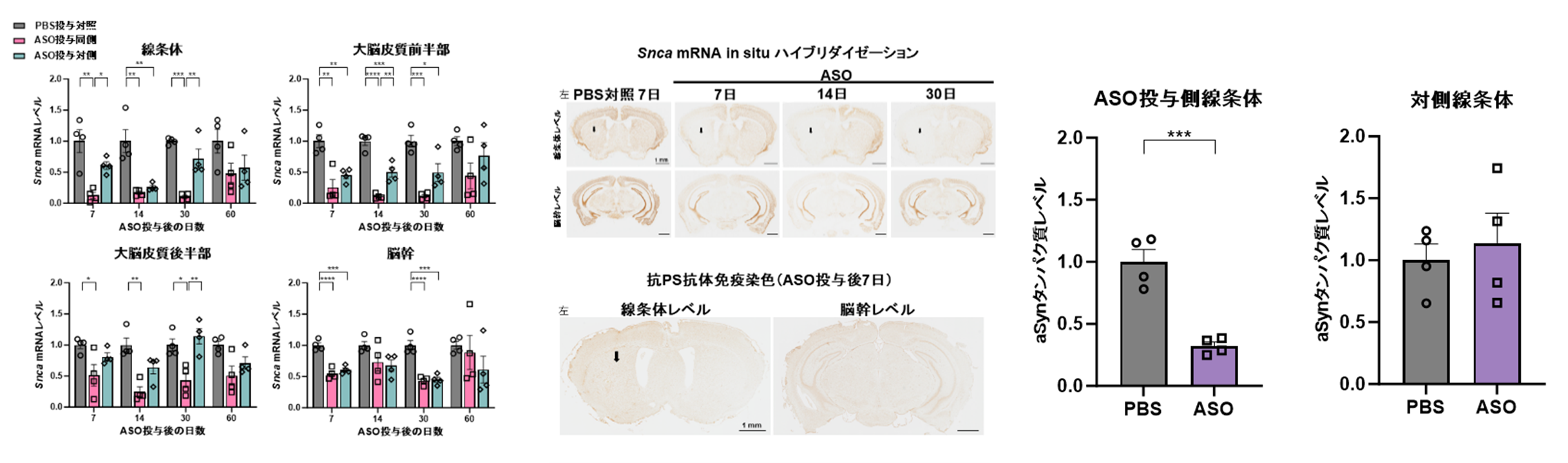
図A
Snca ASOの局所投与により投与側に限局した脳領域のSnca mRNA発現抑制が可能であり(左)、in situ ハイブリダイゼーションおよび抗PS抗体染色でその効果が示された(中)。aSynタンパク質レベルは投与側に限局した抑制が認められた(右)。
この「細胞体」と 「神経突起」 病理を指標としてpSyn陽性となる神経細胞密度を複数の脳領域で比較しました。Snca ASO群では、PBS群と比較して、左線条体で細胞体(95%)および神経突起(92%)陽性細胞密度減少が認められ広範な脳領域での病理出現予防効果を認めました(図B中)。また、免疫ブロット法でASO群ではサルコシル不溶性pSynの減少(93%)が示されました(図B右)。ユビキチンとp62の免疫染色でも、Snca ASO群で陽性細胞密度の減少が認められました。ASO投与による細胞毒性や運動機能障害は認められませんでした。
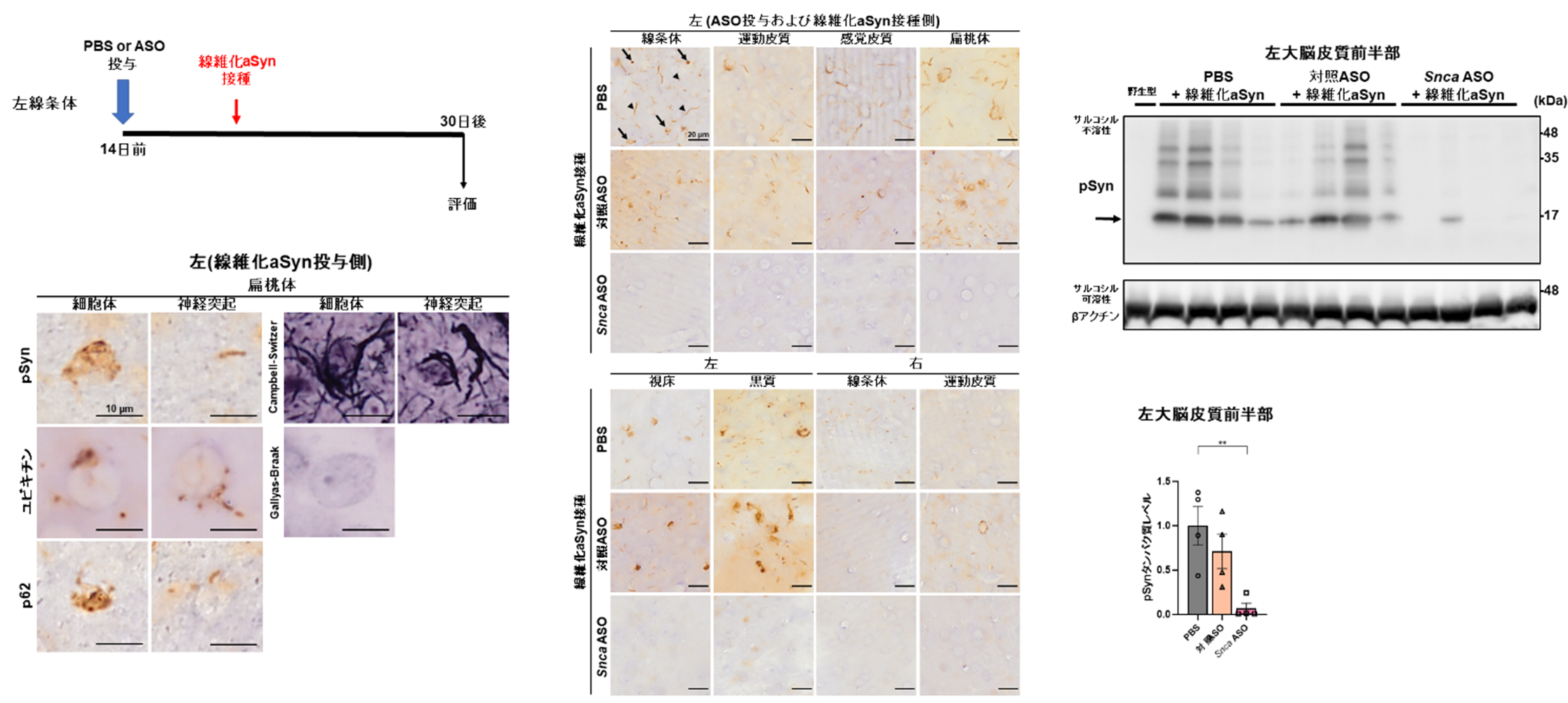
図B
Snca ASOの線維化aSyn接種部位への局所事前投与(左上)。ASO非投与群でPD患者類似の病理が細胞体(矢印)および神経突起(矢頭)を認めた(左下)。pSynを指標とした組織学的評価では広範な予防効果を認めた(中)。生化学的にはサルコシル不溶性のpSyn減少を認めた(右、矢印は単量体)。
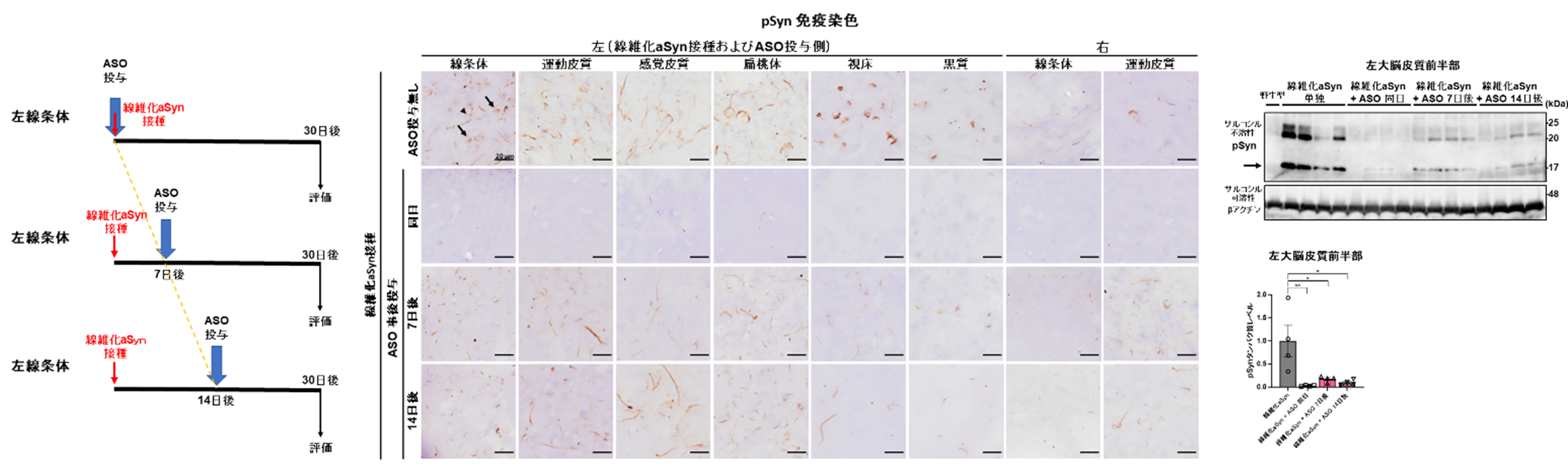
図C
Snca ASOの線維化aSyn接種部位への局所事後投与(左)。pSynを指標とした組織学的評価では細胞体病理(矢印)の広範な抑制が認められる一方で、7,14日後投与では神経突起病理(矢頭)の抑制は認められなかった(中)。生化学的にはいずれの投与時期でもサルコシル不溶性のpSyn減少が認められた(右、矢印は単量体)。
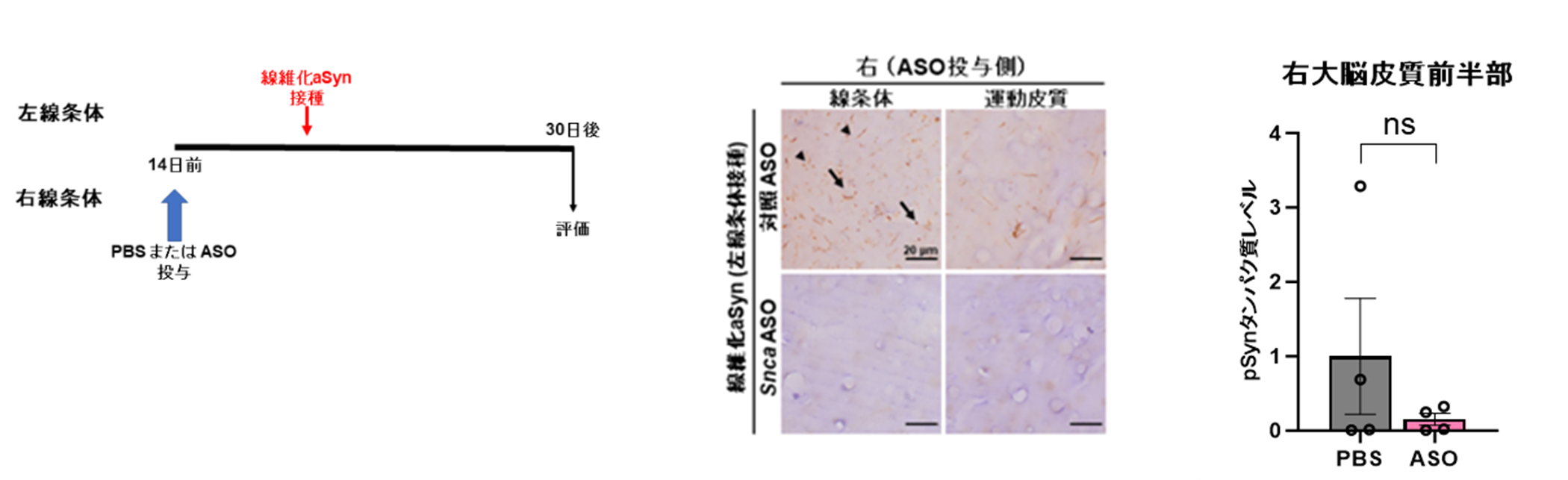
図D
Snca ASOの線維化aSyn接種部位の反対側の局所事前投与(左)。pSynを指標とした組織学的評価ではASO投与部位近傍に限局した細胞体(矢印)および神経突起(矢頭)病理進展抑制効果を認めた(中)。生化学的にはサルコシル不溶性のpSyn減少傾向が認められた(右)。
研究成果の意義
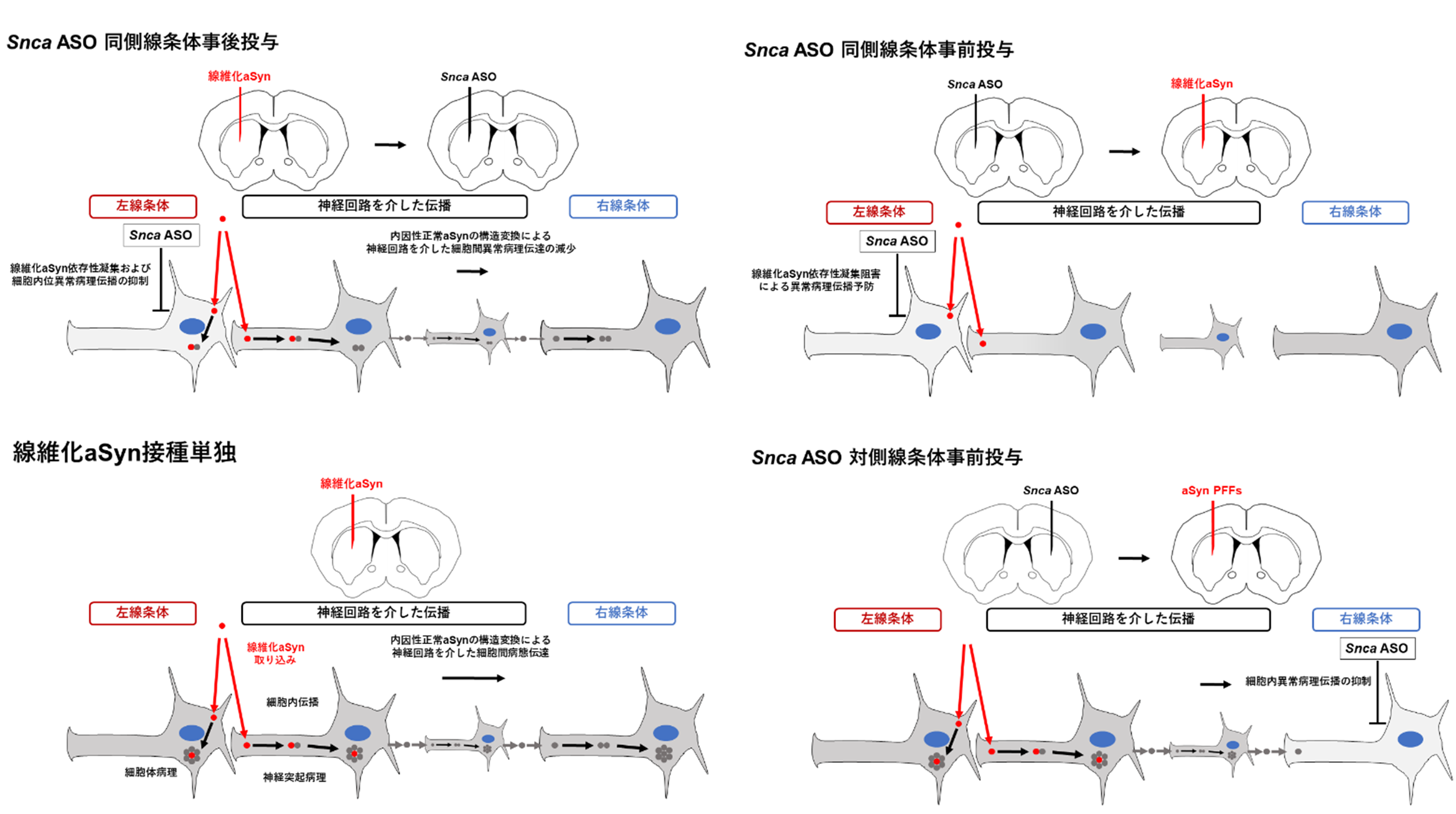
図E
用語解説
※1 パーキンソン病(PD)
パーキンソン病は成人発症の進行性神経変性疾患であり、1000人に1人~1.8人の割合で発症する。65歳以上では100人に約1人で高齢化に伴い患者は増加している。従来、振戦(ふるえ)、動作緩慢、筋強剛(筋固縮)、姿勢保持障害(転びやすいこと)という特徴的な症状から運動系の疾患と考えられてきたが、現在では、認知機能障害、行動障害、睡眠障害、気分障害、注意障害、自律神経障害等の様々な非運動症状を伴う全身性の疾患であると認識されている。
※2 αシヌクレイン(aSyn)
aSynは140アミノ酸残基のタンパク質であり、脳に多く存在している。aSynは神経終末に多く分布し、シナプス小胞と相互作用して小胞リサイクルを生理的に調節する機能が知られている。aSynをコードするSNCA遺伝子の点変異や重複は、家族性のパーキンソン病やレビー小体型認知症の原因となる遺伝子異常として知られている。また、多系統萎縮症や純粋自律神経不全症等の神経変性疾患でもaSynの異常が認められており、αシヌクレイノパチーという疾患分類が提唱されている。
※3 アンチセンス核酸(ASO)
細胞内に存在する RNA等を標的とする核酸医薬で、1本鎖DNAを基本構造として様々な化学修飾が施されている。既存の抗体医薬では標的にできない細胞内のRNAを標的として結合することが可能で、標的RNAから翻訳される疾患に関わる係わるタンパク質を一過性に発現を制御し、これまで治療法のなかった疾患の治療薬の主流となりつつある。主な国内での承認薬としては、脊髄性筋萎縮症に対するヌシネルセン、家族性ポリアミロイドニューロパチーに対するイノテルセン、デュシェンヌ型筋ジストロフィーに対するビルトラルセンが有り、現在も複数の臨床試験が進行中である。
※4 プリオン
タンパク質を含み核酸を欠く小型の感染性病原体を指す。異常構造を持ったタンパク質が同一遺伝子由来の正常な細胞内タンパク質を構造変換し、病態が進展すると推測されている。ヒトのプリオン病としてクロイツフェルト・ヤコブ病(CJD)が知られており、急速進行性の認知症を来す。
論文情報
掲載誌: Acta Neuropathologica Communications
論文タイトル: Effects of local reduction of endogenous α-synuclein using antisense oligonucleotides on the fibril-induced propagation of pathology through the neural network in wild-type mice
研究者プロフィール

佐野 達彦 (サノ タツヒコ) Tatsuhiko Sano
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 大学院生
・研究領域
神経内科学

東京医科歯科大学 統合研究機構
先端医歯工学創成クラスター 核酸・ペプチド創薬治療研究センター 教授
・研究領域
神経内科学、核酸医薬

東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 教授
・研究領域
神経内科学、核酸医薬
問い合わせ先
<研究に関すること>
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野
横田 隆徳 (ヨコタ タカノリ)
永田 哲也 (ナガタ テツヤ)
E-mail:tak-yokota.nuro[@]tmd.ac.jp t-naga.nuro[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
<AMED事業に関すること>
日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
E-mail:sentan-bio[@]amed.go.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

