「 真皮と皮膚付属器を有する機能的な皮膚再生 」【中内啓光 特別栄誉教授、水野直彬 助教】
― 細胞競合による長期生着可能な移植用皮膚作成法の開発 ―

ポイント
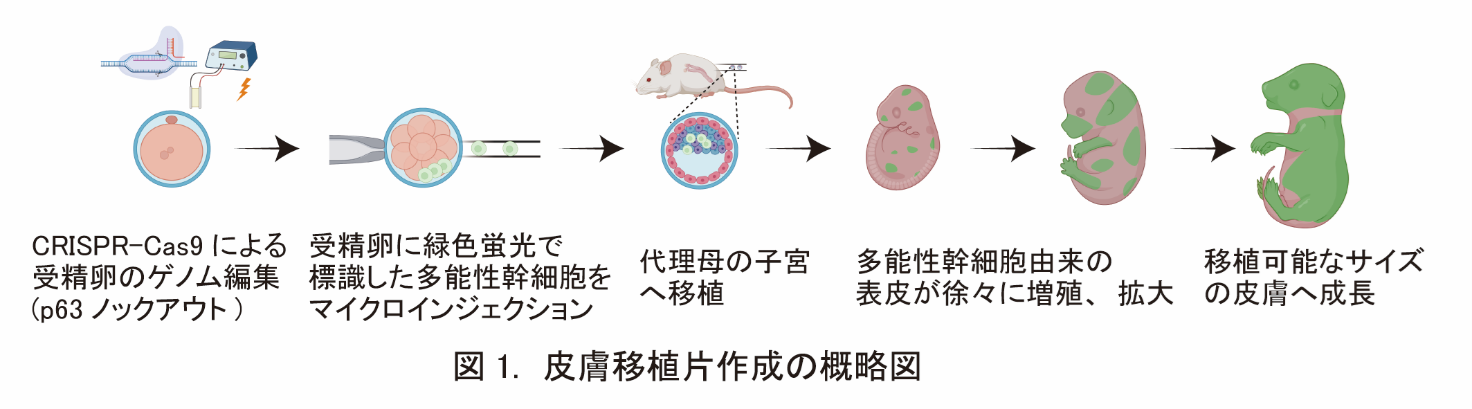
- 研究グループは個体発生の環境と細胞競合※1を利用して、幹細胞から移植用臓器を作成する新手法 (ニッチ侵入法)を開発し、多能性幹細胞※2由来のマウス皮膚を作成しました。
- この手法で作成した皮膚は、従来の皮膚代替物※3と異なり、皮膚の支持組織である真皮を持つため皮膚の深い部分まで損傷するような重症の皮膚損傷にも移植可能で、毛包などの付属器※4もあるため皮膚機能を完全に再生する事が出来ます。
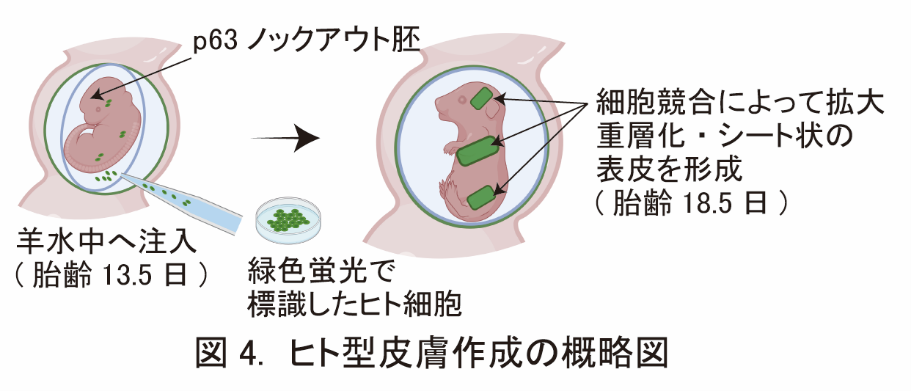
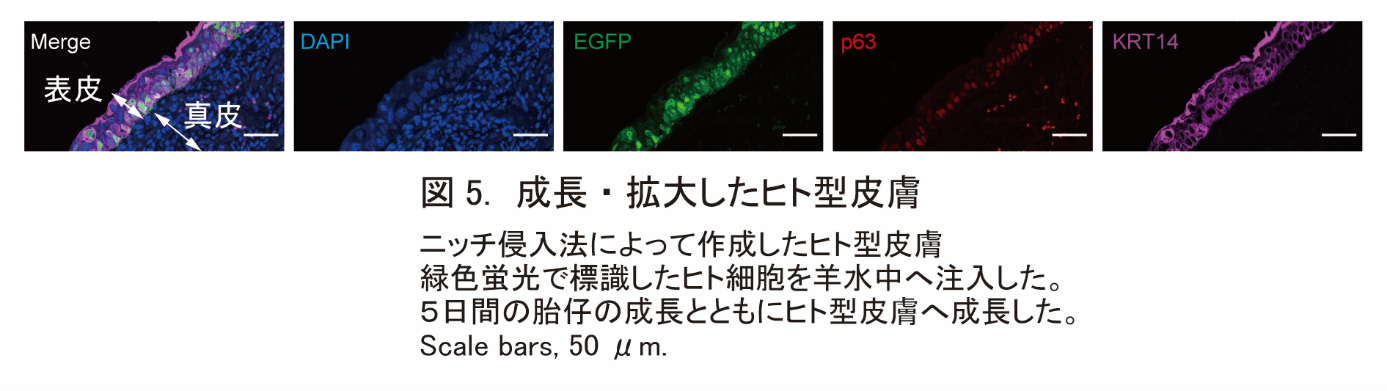
- マウスの羊水中にヒト細胞を注入する事で、ヒト型の皮膚を作成することにも成功しました。
- 本研究結果は、免疫抑制剤なしで永久生着し、機能的にも完全な移植用皮膚を幹細胞から作成する技術の基盤であり、重症の広範囲熱傷の患者さんへ毛包や汗腺などの付属器を備えた移植用の皮膚を提供できるようになることが期待されます。
東京医科歯科大学 高等研究院卓越研究部門 幹細胞治療研究室の中内啓光特別栄誉教授、長野寿人非常勤講師、同実験動物センター疾患モデル動物解析分野の水野直彬助教の研究グループは、個体発生の環境と細胞競合を利用して、幹細胞由来の移植用臓器を作成する新手法「ニッチ※5侵入法(Niche encroachment)」を開発しました。この手法で作成した幹細胞由来の皮膚は、表皮、真皮、毛包など皮膚付属器を持っており、深い傷にも永久生着し、感染防御・体液保持・体温調整といった様々な皮膚機能を迅速に回復させることが可能です。従来、発生原理を利用して移植用臓器を作成するには、異種動物間のキメラ※6個体を作成する必要がありましたが、ニッチ侵入法は羊水中へのドナー細胞注入でも皮膚の作成が可能で、研究グループはヒト由来のドナー細胞からヒト型皮膚を作成する事にも成功しました。
この研究は文部科学省科学研究費補助金ならびに日本医療研究開発機構 再生医療実現拠点ネットワークプログラム 疾患・組織別実用化研究拠点(拠点C)「動物生体内環境を利用した移植用ヒト臓器の開発」の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Nature Communications(ネイチャーコミュニケーションズ)に、2024年4月29日にオンライン版で発表されました。
研究の背景
研究成果の概要
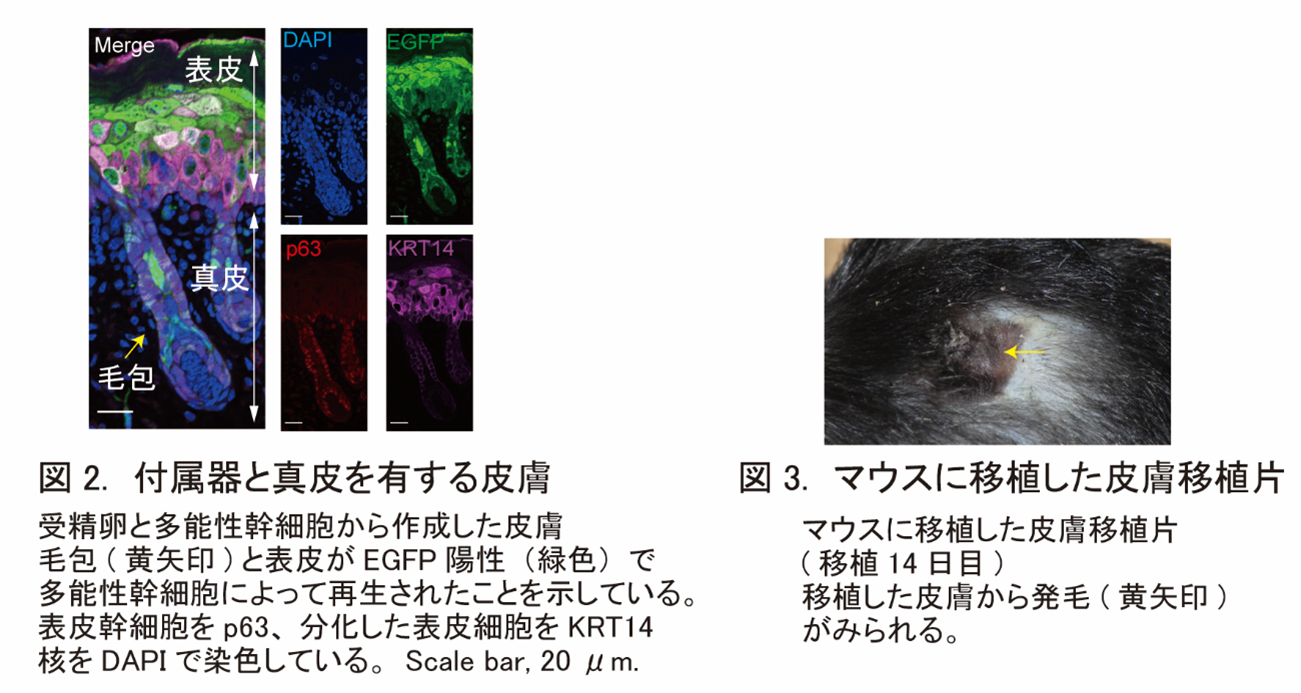
研究グループは次に、ニッチ侵入法で作成したマウス皮膚を移植片として利用できるかについて、移植実験で検証しました。一般に皮膚は他の臓器と比較して免疫原性が強いため、強力な免疫抑制剤を使用した場合でも他家移植(他人の皮膚による植皮術)すると短期間で拒絶されてしまいます。今回作成したマウス皮膚の移植片の中にも、他家移植と同様に拒絶の原因となりうる自己の細胞以外の成分、具体的には真皮中の毛細血管などが含まれていましたが、免疫抑制剤の投与を行わなくても移植片は永久生着しました。しかも移植後の皮膚片からは、付属器である毛包からの発毛が長期で見られました(図3)。この結果は、皮膚移植における免疫反応の主因は、真皮ではなく表皮細胞への拒絶反応であることを示唆します。
研究成果の意義
用語解説
※2多能性幹細胞・・・・・・・・胎盤を除く体を構成する様々な種類の細胞へ分化することが可能な細胞で、ES細胞やiPS細胞などが知られている。受精卵と混合することで2種類の異なる遺伝子を持つキメラ動物ができる。
※3皮膚代替物・・・・・・・・皮膚の表皮細胞や線維芽細胞を体外で培養して作成した人工の皮膚。表皮や疑似的な真皮様構造の構築に一部成功したものはあるが、複雑な器官である毛包等の付属器を持つ皮膚代替物の作製が達成できていない。
※4皮膚付属器・・・・・・・・皮膚に存在する毛包、汗腺、皮脂腺などの器官で様々な皮膚機能を司っている。皮膚付属器は表皮と同様に表層外胚葉と呼ばれる幹細胞を共通の起源として持ち、原則として器官形成期と呼ばれる胎仔発生の時期(胎仔が子宮内で成長している時期)にしか作られず、大人になってから新たに増えることはない。
※5ニッチ・・・・・・・・細胞自身が自己の能力を十分に発揮するために必要な微小環境。ニッチの存在下で幹細胞は適切に分化し目的の器官・臓器へ成長する。
※6キメラ・・・・・・・・キメラとは2つ以上の遺伝的背景の異なる細胞によって構成された個体で、着床前受精胚へ多能性幹細胞を顕微注入(マイクロインジェクション)することで作ることができる。この受精胚を代理母の子宮環境で育てると、遺伝的に異なる細胞が混在した動物個体が得られる。
※7ゲノム編集・・・・・・・・ゲノムDNAの特定の遺伝子を狙って改変する技術。遺伝子の機能の喪失(ノックアウト)や新しい遺伝子の挿入(ノックイン)などが可能である。最近ではCRISPR-Cas9(細菌や古細菌の有する適応免疫であるCRISPR/Cas9システムをもとに開発された遺伝子改変技術)によるゲノム編集が頻用されている。
※8胚盤胞補完法・・・・・・・・遺伝的に特定の臓器が欠損する動物の着床前受精胚(胚盤胞)に、正常な多能性幹細胞を注入しキメラを形成すると、一定の頻度で、本来は欠損するはずだった臓器が多能性幹細胞由来の臓器で補われる。この機序を利用すると、患者さん本人の多能性幹細胞から、移植用の臓器を作成する事ができる。
論文情報
掲載誌: Nature Communications
論文タイトル: Skin graft with dermis and appendages generated in vivo by cell competition
DOI: https://doi.org/10.1038/s41467-024-47527-7
研究者プロフィール

長野 寿人 (ナガノ ヒサト) Nagano Hisato
東京医科歯科大学 高等研究院 卓越研究部門
幹細胞治療研究室 非常勤講師
・研究領域
再生医療、形成外科学
水野 直彬 (ミズノ ナオアキ) Mizuno Naoaki
東京医科歯科大学 統合研究機構 実験動物センター
疾患モデル動物解析学分野 助教
(高等研究院 卓越研究部門 幹細胞治療研究室兼務)
・研究領域
再生医療、発生工学、ゲノム編集、幹細胞生物学
東京医科歯科大学 高等研究院 卓越研究部門
幹細胞治療研究室 特別栄誉教授
・研究領域
再生医療、幹細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 高等研究院 卓越研究部門
幹細胞治療研究室 長野 寿人(ナガノ ヒサト)
E-mail:h-nagano.sct[@]tmd.ac.jp
東京医科歯科大学 統合研究機構 実験動物センター
疾患モデル動物解析学分野 水野 直彬(ミズノ ナオアキ)
E-mail:nmizuno1.sct[@]tmd.ac.jp
東京医科歯科大学 高等研究院 卓越研究部門
幹細胞治療研究室 中内 啓光(ナカウチ ヒロミツ)
E-mail:sctlab[@]ml.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

