「 新興・再興感染症パンデミック下の新薬開発を加速する臨床試験デザインを特定 」【平川晃弘 教授】
― アダプティブプラットフォーム臨床試験の効率性の分析 ―

ポイント
- 新型コロナウイルス感染症(COVID-19)パンデミック時に、欧米諸国はアダプティブプラットフォーム臨床試験を積極的に活用したため、新薬を迅速に開発することができました。
- 本研究では、新興・再興感染症パンデミック下の臨床試験の実施方法(臨床試験デザイン)を最適化するための知見を得ることを目的に、アダプティブプラットフォーム臨床試験と標準的な臨床試験の効率性(薬剤の開発期間、臨床試験に参加して頂く患者さんの数)をクリニカルトライアルシミュレーション実験※1により網羅的に比較分析しました。
- クリニカルトライアルシミュレーション実験の結果、アダプティブプラットフォーム臨床試験は標準的な臨床試験よりも効率性が高いことが示されたものの、その効率性は患者登録スピード、各被験薬に期待される治療効果の大きさから計算される試験計画時の予定登録患者数、各被験薬群への患者登録の開始時期等に依存することが明らかとなりました。
- COVID-19の教訓を踏まえた「100 Days mission (パンデミックが宣言されてから100日以内にワクチンや薬剤を開発する)」と呼ばれる国際的な目標があります。本研究の成果は、パンデミック時に最適な臨床試験デザインを決定する際の重要な指針となることが期待されます。
本研究は国立研究開発法人日本医療研究開発機構(AMED) 医薬品等規制調和・評価研究事業「国内マスタープロトコル試験の実施に関する規制的、統計的、実務的課題の検討とその適正利用のためのガイドライン作成(研究代表者 平川晃弘)」、及び新興・再興感染症に対する革新的医薬品等開発推進研究事業「新興・再興感染症流行に即応した医薬品開発に係る臨床研究を実施するための体制整備の基盤技術構築に関する研究(研究代表者 杉浦亙)」の支援のもとで行われたもので、その研究成果は、米国臨床薬理学会が刊行しているClinical Pharmacology & Therapeuticsに、2024年3月5日に発表されました。
研究の背景
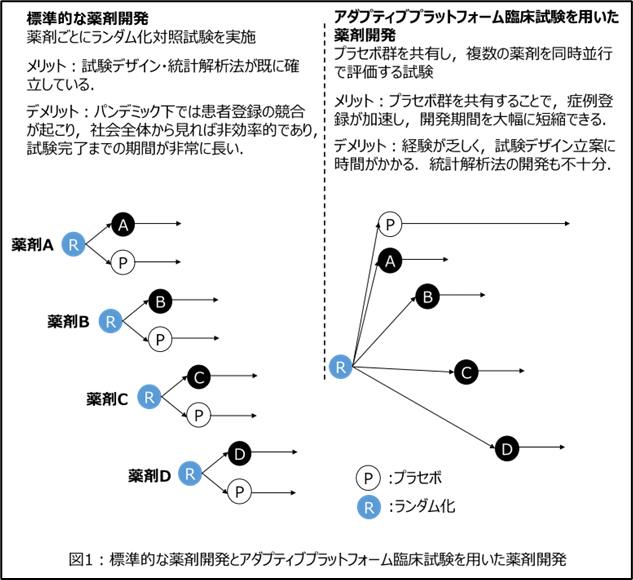
標準的な薬剤開発では、薬剤ごとにプラセボ(又は対照薬)と比較する2群ランダム化対照試験を実施します(図1左)。このような臨床試験は、臨床試験デザインやデータ解析に用いる統計解析法が既に確立しているという利点があるものの、薬剤開発のスピードも重視されるパンデミック下では試験間で患者登録が競合し、社会全体から見れば非効率的な薬剤開発になってしまいます。
複数の被験薬を1つの共通のプラセボ又は対照薬と比較することを特徴とするアダプティブプラットフォーム臨床試験は、近年に提唱された新しい臨床試験デザインであり、薬剤の開発期間を大幅に短縮できると考えられています(図1右)。実際、欧米諸国等では、このアダプティブプラットフォーム臨床試験を積極的に活用して、パンデミック下でも薬剤を迅速に開発することができました。
アダプティブプラットフォーム臨床試験は、標準的な薬剤開発に比べて、開発期間を大幅に短縮できると考えられていますが、実際にパンデミック下でどの程度の効率性(薬剤の開発期間、臨床試験に参加して頂く患者さんの数)があるのか、統計学的に分析した研究はありませんでした。アダプティブプラットフォーム臨床試験の効率性を定量的に分析した結果は、臨床医、研究者、製薬企業、規制当局等の各ステークホルダーが、パンデミック時に薬剤開発期間を最短にする臨床試験デザインを決定する際の重要な指針となることが期待されます。
研究成果の概要
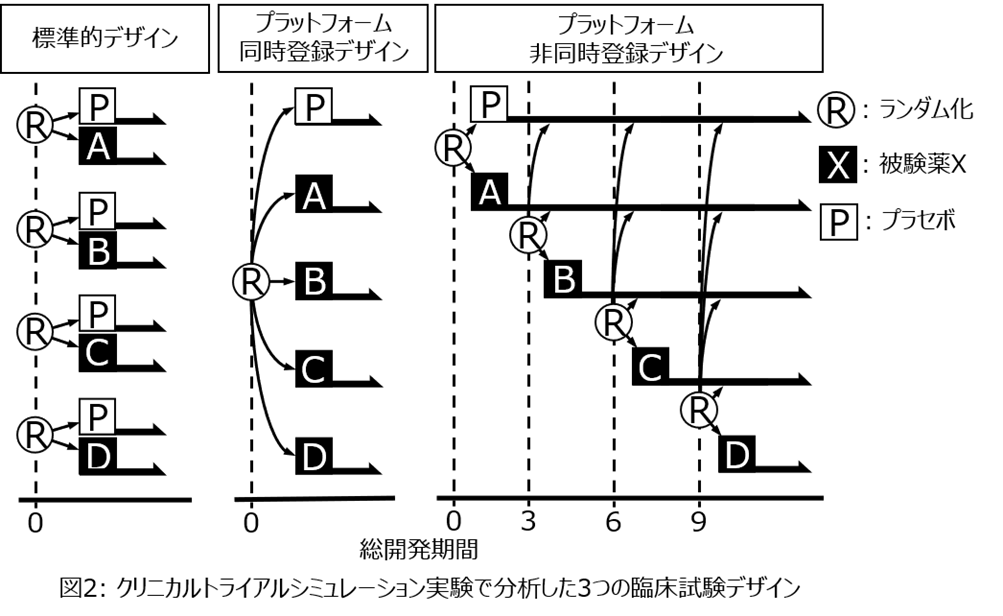
【標準的デザイン】 被験薬ごとに標準的なプラセボ対照ランダム化対照試験を実施する開発。
【プラットフォーム同時登録デザイン】 1つの共通のプラセボ群を設定して、各被験薬群への患者登録を同時に開始するアダプティブプラットフォーム臨床試験を実施する開発。
【プラットフォーム非同時登録デザイン】 1つの共通のプラセボ群を設定し、各被験薬群への患者登録は3か月ずつのラグ(登録ラグ)があるアダプティブプラットフォーム臨床試験を実施する開発。パンデミック時には、試験準備が整った被験薬から順に患者登録を開始することが想定されるため、このデザインが現実に即した試験デザインと言える。なお、患者登録のラグとして設定した3か月はシミュレーション上の参考設定値であり、実際の薬剤開発において常に3か月の登録ラグが生じるわけではない。
実験の結果から明らかになった主なことは以下の通りです。
【総開発期間】
プラットフォーム同時登録デザインは、標準的デザインよりも、開発期間を短縮できる。例えば、1か月あたりの登録患者数が100例である場合、標準的デザインの平均総開発期間は57.1か月であるのに対して、プラットフォーム同時登録デザインの平均総開発期間は35.8か月であり、21.3か月短縮することができる。1か月あたりの登録患者数が1,000例になった場合でも、プラットフォーム同時登録デザインは、標準的デザインよりも、開発期間を2か月は短縮できる。このプラットフォーム同時登録デザインの有用性は、100 Days missionの実現に大きく貢献するものである。
プラットフォーム非同時登録デザインは、1か月あたりの登録患者数が500例未満の場合は、標準的デザインよりも開発期間を短縮できたが、500例を超えると開発期間を短縮できなくなった。ただし、この結果は、あくまで本研究で設定したシミュレーション条件の下での結果であることに留意する必要がある。重要なことは、クリニカルトライアルシミュレーション実験をとおして、プラットフォーム非同時登録デザインが標準的デザインよりも開発期間を短縮できる1か月あたりの登録患者数を逆算することが可能であるという点である。パンデミック時に、クリニカルトライアルシミュレーション実験を実施して、開発期間を短縮できる1か月あたりの登録患者数を特定することで、臨床試験に参加する医療機関の数等も調整でき、迅速な薬剤開発が可能となる。
【総登録患者数】
プラットフォーム同時登録デザインは、標準的デザインよりもプラセボ群の数が少ないため、その分だけ総登録患者数を削減でき、結果として総開発期間を短縮できる。プラットフォーム非同時登録デザインは、常に標準的デザインよりも総登録患者数を削減できるわけではない。なぜなら、被験薬A~Dへの登録がすべて終了するまで、プラセボ群への登録を継続する必要があるからである。本研究で設定したシミュレーション条件の下では、1か月あたりの登録患者数が500例未満の場合は、標準的デザインよりも総登録患者数を削減できたが、500例を超えると総登録患者数を削減できなかった。プラットフォーム非同時登録デザインと標準的デザインの総登録患者数の差は、患者登録スピード(1か月あたりの登録患者数)、各被験薬に期待される治療効果の大きさから計算される試験計画時の予定登録患者数、各被験薬群への登録ラグに依存することが明らかとなった。言い換えると、プラットフォーム非同時登録デザインの総登録患者数は、パンデミック時の感染状況や被験薬に期待される効果の大きさ等に依存するということである。
研究成果の意義
COVID-19の教訓を踏まえた「100 Days mission (パンデミックが宣言されてから100日以内にワクチンや薬剤を開発する)」という国際的な目標があります。創薬研究をとおして有望な薬剤候補が見いだされたとしても、適切な臨床試験を実施して、適切なエビデンスを創出しなければ、患者さんに新薬は届きません。本研究の成果は、パンデミック下で迅速に新薬を開発するための重要な指針となります。また、日本も欧米のように、新興・再興感染症パンデミック下の臨床試験の実施体制・方法に係る基盤整備や効率的な臨床試験デザインに関する学術研究を推進していく必要があると考えます。なお、現在、上述したAMED医薬品等規制調和・評価研究事業「国内マスタープロトコル試験の実施に関する規制的、統計的、実務的課題の検討とその適正利用のためのガイドライン作成(研究代表者 平川晃弘)」において、アダプティブプラットフォーム試験を含むマスタープロトコル試験に関する国内ガイドラインを策定中です。
用語解説
※1クリニカルトライアルシミュレーション実験
臨床試験の成功確率を最大化するために実施されるコンピュータシミュレーション実験。疑似的な患者データをコンピュータ内で生成・分析することで、想定される薬剤の効果、登録可能な患者数、試験期間、データ解析に用いる統計解析法など、臨床試験の計画、実施に係る諸条件を最適化できる。
論文情報
掲載誌: Clinical Pharmacology & Therapeutics
論文タイトル: How Much More Efficient Are Adaptive Platform Trials Than Multiple Stand-Alone Trials? A Comprehensive Simulation Study for Streamlining Drug Development During a Pandemic
著者: Masanao Sasaki, Hiroyuki Sato, Yukari Uemura, Ayako Mikami, Nao Ichihara, Shigeki Fujitani, Masashi Kondo, Yohei Doi, Eriko Morino, Daisuke Tokita, Norio Ohmagari, Wataru Sugiura, Akihiro Hirakawa
DOI: https://doi.org/10.1002/cpt.3224
研究者プロフィール
佐々木 誠治(ササキ マサナオ)
東京医科歯科大学 大学院医歯学総合研究科
臨床統計学分野 大学院生(博士課程)
・研究領域
臨床統計学、臨床試験方法論、データサイエンス

佐藤 宏征(サトウ ヒロユキ)
東京医科歯科大学 大学院医歯学総合研究科
臨床統計学分野 助教
・研究領域
臨床統計学、臨床試験方法論、データサイエンス

東京医科歯科大学 大学院医歯学総合研究科
臨床統計学分野 教授
・研究領域
臨床統計学、臨床試験方法論、データサイエンス、
レギュラトリーサイエンス
問い合わせ先
<研究に関すること>
東京医科歯科大学 大学院医歯学総合研究科
臨床統計学分野 平川 晃弘(ヒラカワ アキヒロ)
E-mail:a-hirakawa.crc[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

