大腸がん発がんにおける免疫寛容を引き起こす仕組みを同定
早期から使用できる大腸がんに対する免疫療法開発に向けた一歩
ポイント
- 散発性大腸がんに対する、免疫チェックポイント阻害剤(ICB)を中心とした免疫療法の治療効果は乏しい。
- 早期大腸がんにおける空間的転写産物解析(ST-seq)とシングルセルRNAシークエンス(scRNA-seq)を統合解析することで、がんと腺腫の境界部において、腫瘍細胞の増殖/免疫抑制に関与する細胞集団を同定し、細胞間相互作用機構を解明した。
- 本研究成果は、散発性大腸がんに対する免疫療法の新たな治療標的の開発に役立つことが期待される。
概要
今回、早期大腸がんにおけるがんと腺腫の境界部から生じる腫瘍細胞の増殖・免疫寛容(※2)に関与する仕組みを新たに明らかにしました。
九州大学別府病院外科教授 三森功士、大阪大学医学部附属病院 医員(研究当時) 橋本雅弘、大阪大学大学院医学系研究科消化器外科学教授 江口英利、同教授 土岐祐一郎、東京医科歯科大学難治疾患研究所計算システム生物学分野教授 島村徹平、国立がん研究センター研究所計算生命科学ユニット長 小嶋泰弘、東京大学新領域創成科学研究科教授 鈴木穣、関西医科大学附属生命医学研究所がん生物学部門学長特命教授 坂本毅治らの研究グループは、アジア人早期大腸がん患者(5名)と進行大腸がん患者(1名)の空間的転写産物解析(ST-seq)と公共データベースにおけるアジア人大腸がん患者(23名)のシングルセルRNAシークエンスデータ(scRNA-seq)を用いて、深層生成モデル(※3)を活用した統合解析を行い、大腸腺腫とがんの境界部における単一細胞レベルの現象を明らかにしました。すなわち腫瘍細胞は、免疫寛容に関わる制御性T細胞(Treg)と共局在関係(※4)を有し、Midkine (MDK)(※5)という分子を介したシグナル経路が関与していることを解明しました。
さらに、MDKは大腸がん早期から発現を認め、MDKシグナル経路が、大腸がんにおける臨床的予後に関与することを明らかにしました。
これらの知見は将来、早期大腸がんの診断だけでなく、免疫療法における有望な治療標的となること、さらに、発がん予防への展開が期待される結果でした。
本研究成果は「eBioMedicine」誌に2024年4月13日(土)午前7時30分(日本時間)にオンラインで掲載されました。
研究の背景と経緯
九州大学別府病院では、早期大腸がんおよび前がん病変において、一腫瘍多領域検体解析(※6)を用いて、がんの早期の段階でドライバー変異自身が多様性を形成しますが、強力なドライバー変異が選択され、進行がんへと進展し、がんの進化モデルを示しました。しかし、腫瘍細胞自身のDNAの変化は解明されていますが、免疫寛容へとつながる、がん微小環境の変化に関しては明らかになっていません。
また、近年シングルセルRNAシークエンス(scRNA-seq)が開発されました。scRNA-seqは、組織内の個々の細胞に対して1細胞レベルでRNAシークエンスを行い、遺伝子発現レベルを測定する技術であり広く普及しています。しかし、空間情報がないため、大腸がんの腺腫病変からがんへの変化における、腫瘍細胞と他の細胞群との細胞間相互作用に関する重要なメディエーターはこれまで明らかにされていませんでした。われわれは先行研究において、進行大腸がんを対象にscRNA-seqと空間的転写産物解析(ST-seq)とを統合解析してがん微小環境の解明に成功しました(Ozato Y. et al. Cell Rep. 2023)。本論文では、早期大腸がんを対象に新たな解析パイプラインを用いた統合解析を実施したことで、腺腫とがん、それぞれの腫瘍細胞とクロストークする細胞を解析し、更にリガンド/レセプターの関係性から新たな治療標的分子を探索しました。
研究の内容と成果
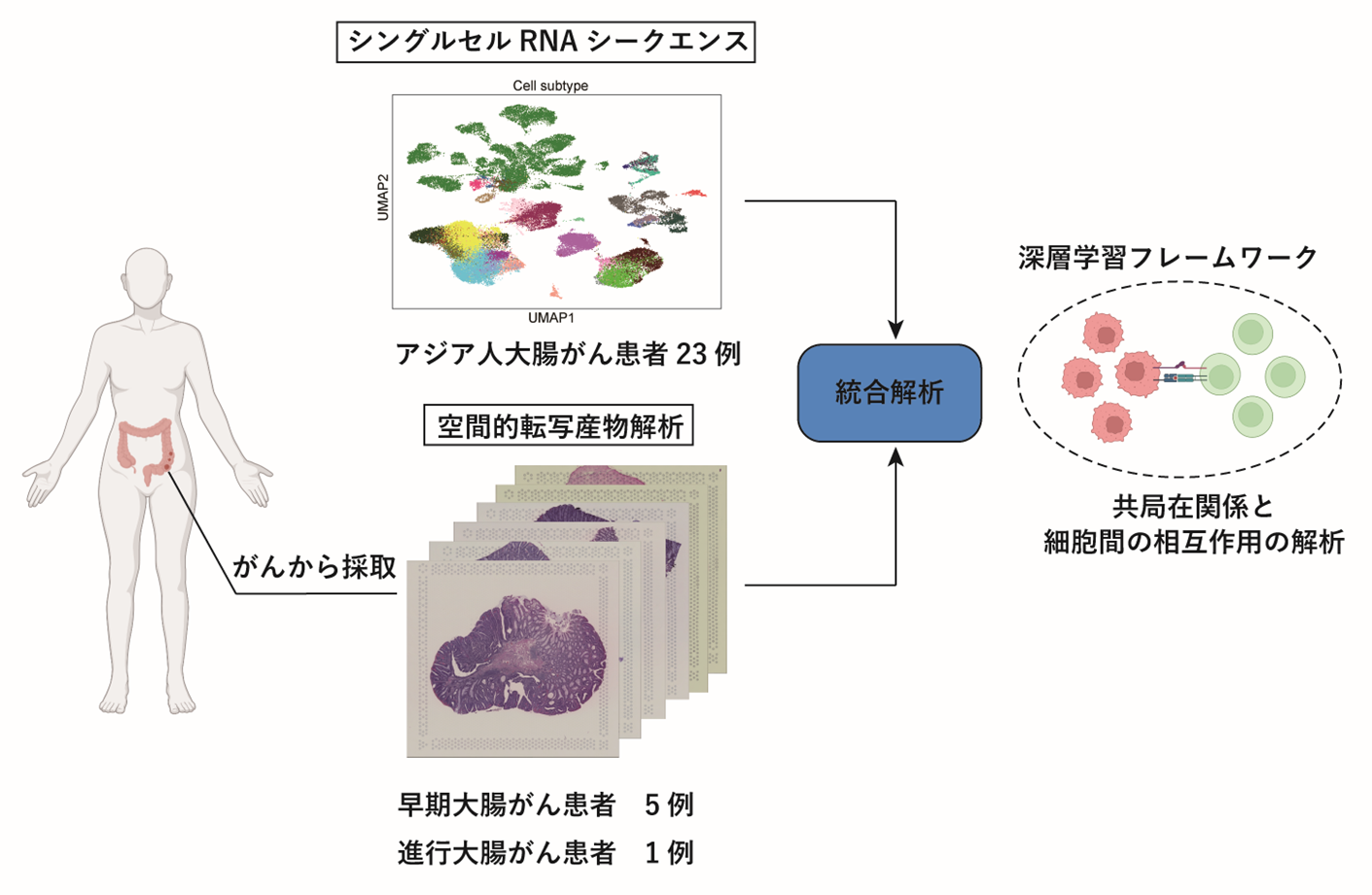
図1 scRNA-seqと空間的転写産物解析の統合解析
今後の展開
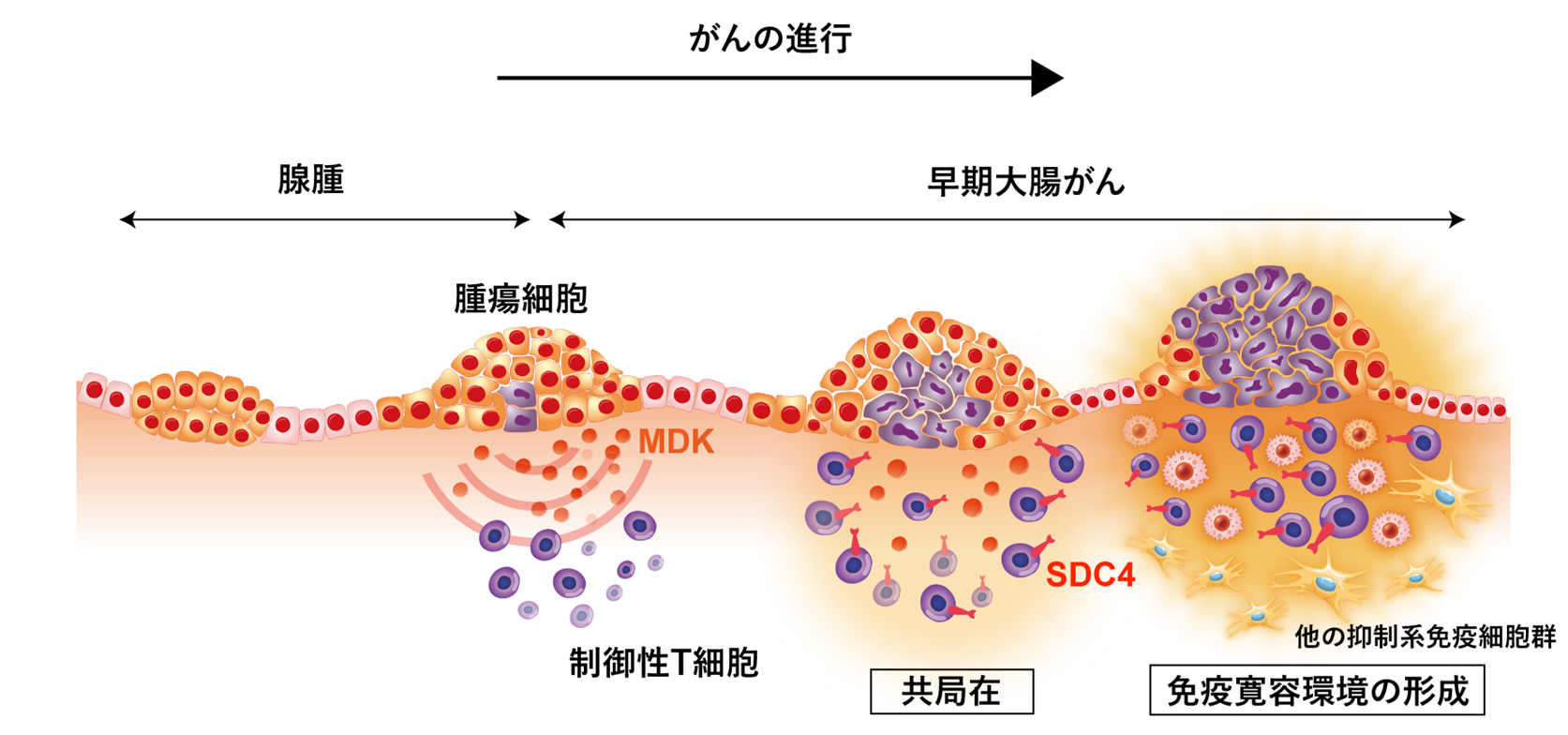
図2 早期大腸がんにおける前がん病変から開始する免疫寛容環境
前がん病変から腫瘍細胞からMDKを分泌することで、受容体であるSDC4と
相互作用し、制御性T細胞(Treg)を誘導し、組織内で共局在をします。それが、
免疫寛容を引き起こしがん微小環境の形成をしていると考えられました。
用語解説
(※1) 高頻度マイクロサテライト不安定性(MSI-high)
ゲノムDNAは常に突然変異を来たしているが、通常はその修復酵素が備わっており正常に修復される。しかしゲノム修復機構が破綻している細胞では、ゲノム変異が蓄積しがん化する。またゲノムには繰り返しマイクロサテライト配列が散在するが、ゲノム修復機構が破綻すると細胞複製時に不安定な結果をもたらす。この現象をマイクロサテライト不安定性(MSI)と呼び、このような機構でがん化した細胞は高頻度マイクロサテライト不安定性(MSI-high)を有する。
(※2) 免疫寛容
免疫が自己を攻撃しないようにするシステムのことで、異物と認識し排除するのではなく、受け入れて共存すること。
(※3) 深層生成モデル
深層学習を用いてデータ生成過程を記述した確率モデルであり、近年単一細胞レベルの解析への応用が進んでいる。
(※4) 共局在関係
異なる細胞同士が物理的に同一の組織内部位に位置していることであり、この関係は細胞間の相互作用の研究において重要である。
(※5) MDK
Midkineは、サイトカインの一種であり、がんの進行、細胞移動など様々な機能に関与する遺伝子の一つである。
(※6)一腫瘍多領域検体解析
一つの腫瘍において、複数箇所の検体をシークエンスし、統合解析を行い、どのような重要ながん遺伝子の変異が蓄積して進化しているかを解析する方法。
謝辞
論文情報
掲載誌: eBioMedicine
タイトル: Spatial and single-cell colocalisation analysis reveals MDK-mediated immunosuppressive environment with regulatory T cells in colorectal carcinogenesis
著者名: Masahiro Hashimoto, Yasuhiro Kojima, Takeharu Sakamoto, Yuki Ozato, Yusuke Nakano, Tadashi Abe, Kiyotaka Hosoda, Hideyuki Saito, Satoshi Higuchi, Yuichi Hisamatsu, Takeo Toshima, Yusuke Yonemura, Takaaki Masuda, Tsuyoshi Hata, Satoshi Nagayama, Koichi Kagawa, Yasuhiro Goto, Mitsuaki Utou, Ayako Gamachi, Kiyomi Imamura, Yuta Kuze, Junko Zenkoh, Ayako Suzuki, Kazuki Takahashi, Atsushi Niida, Haruka Hirose, Shuto Hayashi, Jun Koseki, Satoshi Fukuchi, Kazunari Murakami, Tomoharu Yoshizumi, Kenji Kadomatsu, Taro Tobo, Yoshinao Oda, Mamoru Uemura, Hidetoshi Eguchi, Yuichiro Doki, Masaki Mori, Masanobu Oshima, Tatsuhiro Shibata, Yutaka Suzuki, Teppei Shimamura, Koshi Mimori
DOI: 10.1016/j.ebiom.2024.105102
問い合わせ先
<研究に関すること>
九州⼤学病院別府病院 外科
教授 三森 功⼠
Mail:mimori.koshi.791[@]m.kyushu-u.ac.jp
大阪大学大学院医学系研究科 外科系臨床医学専攻 外科学講座消化器外科学
教授 土岐 祐一郎
Mail:ydoki[@]gesurg.med.osaka-u.ac.jp
東京医科歯科大学難治疾患研究所 計算システム生物学分野
教授 島村 徹平
Mail:shimamura.csb[@]tmd.ac.jp
東京大学大学院新領域創成科学研究科メディカル情報生命専攻
教授 鈴木 穣
Mail:ysuzuki[@]edu.k.u-tokyo.ac.jp
関西医科大学附属生命医学研究所 がん生物学部門
教授 坂本 毅治
Mail:sakamott[@]hirakata.kmu.ac.jp
<報道に関すること>
九州大学 広報課
Mail:koho[@]jimu.kyushu-u.ac.jp
大阪大学 大学院医学系研究科 広報室
Mail: medpr[@]office.med.osaka-u.ac.jp
東京医科歯科大学 総務部総務秘書課広報係
Mail:kouhou.adm[@]tmd.ac.jp
東京大学大学院新領域創成科学研究科 広報室
Mail:Press[@]k.u-tokyo.ac.jp
関西医科大学 広報戦略室
Mail:kmuinfo[@]hirakata.kmu.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

