「 IL-33/ST2経路および歯周組織常在型マクロファージの炎症制御 」【中島友紀 教授】
―歯周炎の新たな病態制御メカニズムを発見―

ポイント
- 本研究グループは、既存の結紮誘導型マウス歯周炎モデルを改良し、歯周組織を歯肉、歯根周囲ならびに歯槽骨組織へと分離することで、歯周炎発症の経時的で詳細な解析法を新たに構築しました。
- 網羅的な解析から、歯周病の急性炎症期におけるIL-33/ST2経路の関与と、歯周組織常在型マクロファージが歯周組織における炎症反応を制御している可能性が示されました。
- 本研究の成果は、炎症や骨破壊を伴う歯周病の新規治療法や予防法の開発に貢献することが期待されます。
研究の背景
歯周病は従来より細菌関連性疾患として認識されてきましたが、近年では宿主の免疫応答も重要であると考えられるようになり、その研究に注目が集まっています。しかしながら、既存研究の多くはモデル動物としてマウスの第二臼歯のみを対象とした結紮歯周炎モデル※1を使用し病態を模擬していたため、技術的および量的な制限から歯肉組織以外に対する解析は難しいものでした。歯周組織は歯肉、歯根膜、歯槽骨、セメント質からなる複合的組織であり、歯肉炎の段階では歯肉のみが影響を受けますが、歯周炎の病理過程においては連動的に破壊されることが知られています。特に、歯根膜と歯槽骨の破壊は歯周炎の診断基準ともされているため、それらに対する分析が欠如していた既存の研究結果は歯周炎の病態発生を部分的にしか反映できておらず、その全容に対する理解が制限されている現状にありました。
研究成果の概要
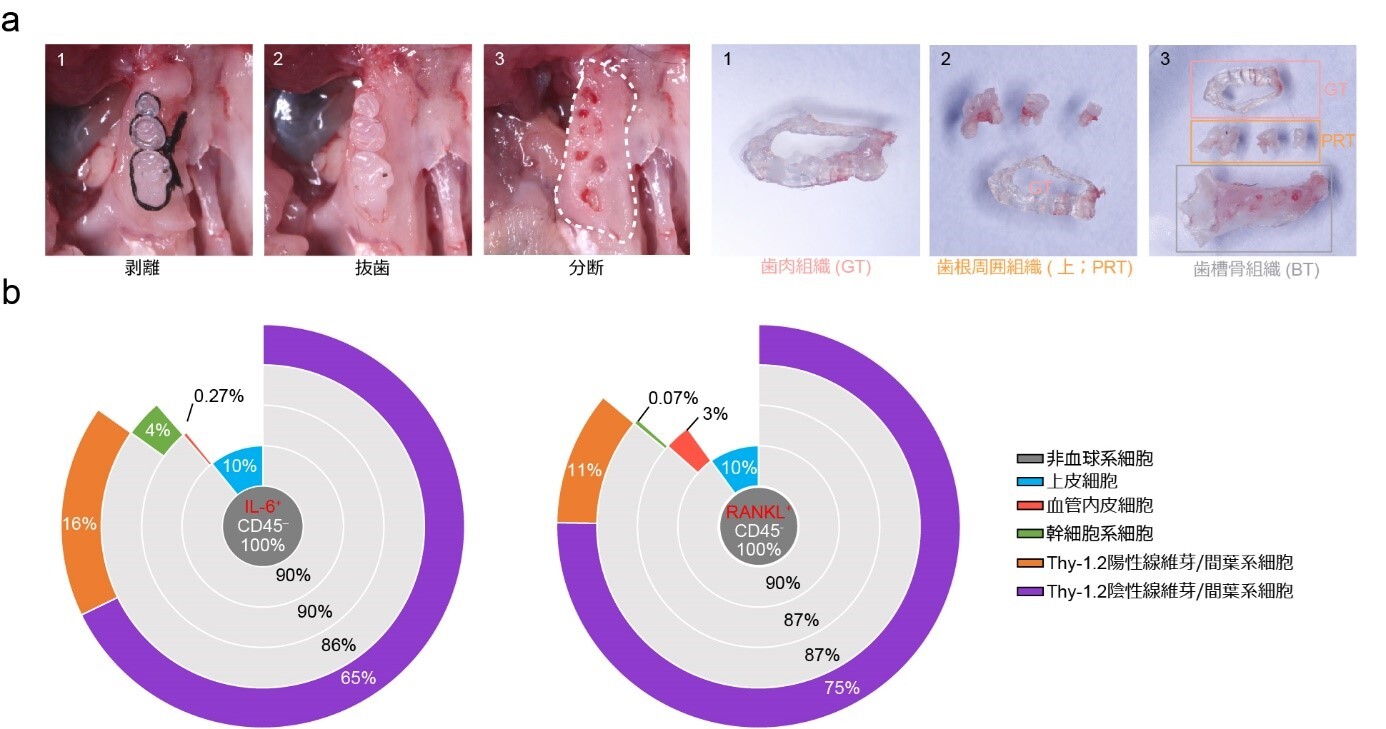
図1.a 改良型マウス結紮誘導型歯周炎モデルと歯肉、歯根周囲組織、歯槽骨組織への分離手順。特定の溶媒中にて根面より剥離を行う事で歯根周囲組織の採取。 b 結紮後5日目PRTにおけるCD45陰性細胞群内でのIL-6とRANKLの産生源。どちらもThy-1.2陰性の線維芽/間葉系細胞が産生源であった。
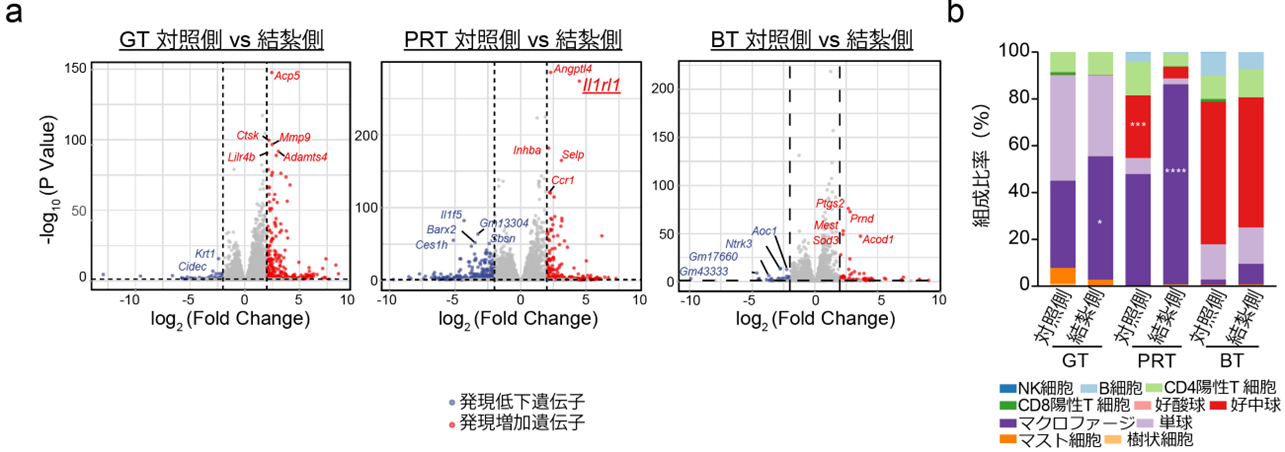
図2.a RNA-seqによる結紮後5日目のGT、PRT、BTにおける発現変動遺伝子の網羅的解析。PRTにおけるIl1rl1の発現変動が顕著であった。
b RNA-seqのデータに基づく組織内の免疫細胞比率予測。炎症惹起時ではPRTに顕著なマクロファージの増加傾向が観察された。
そのメカニズムをより明確にするため、mST2陽性細胞の組成を分析したところ、それらの多くはマクロファージ系の細胞でした。マクロファージは活性化の過程を得て、主にM1(炎症促進)とM2(炎症抑制)の2種類に分類されることが知られていますが、mST2を発現していた細胞はM1とM2両者の一部マーカーを同時に発現することや、炎症惹起前よりPRTに存在するなどの特殊性を有していたため、我々はそれらの細胞を歯周組織常在型マクロファージ(Periodontal Tissue-Resident Macrophage, PTRM)と定義しました(図3b)。また、炎症状態の評価基準の一つであるM1/M2マクロファージ比を調べた際には、M2マクロファージの減少により、ノックアウトマウスにおいては野生型マウスの2倍になっていたことから、炎症促進の方向へと傾いており(図3c)、好中球の増加(図3d)と共に炎症性骨破壊の増悪に寄与している要因だと考えられました。
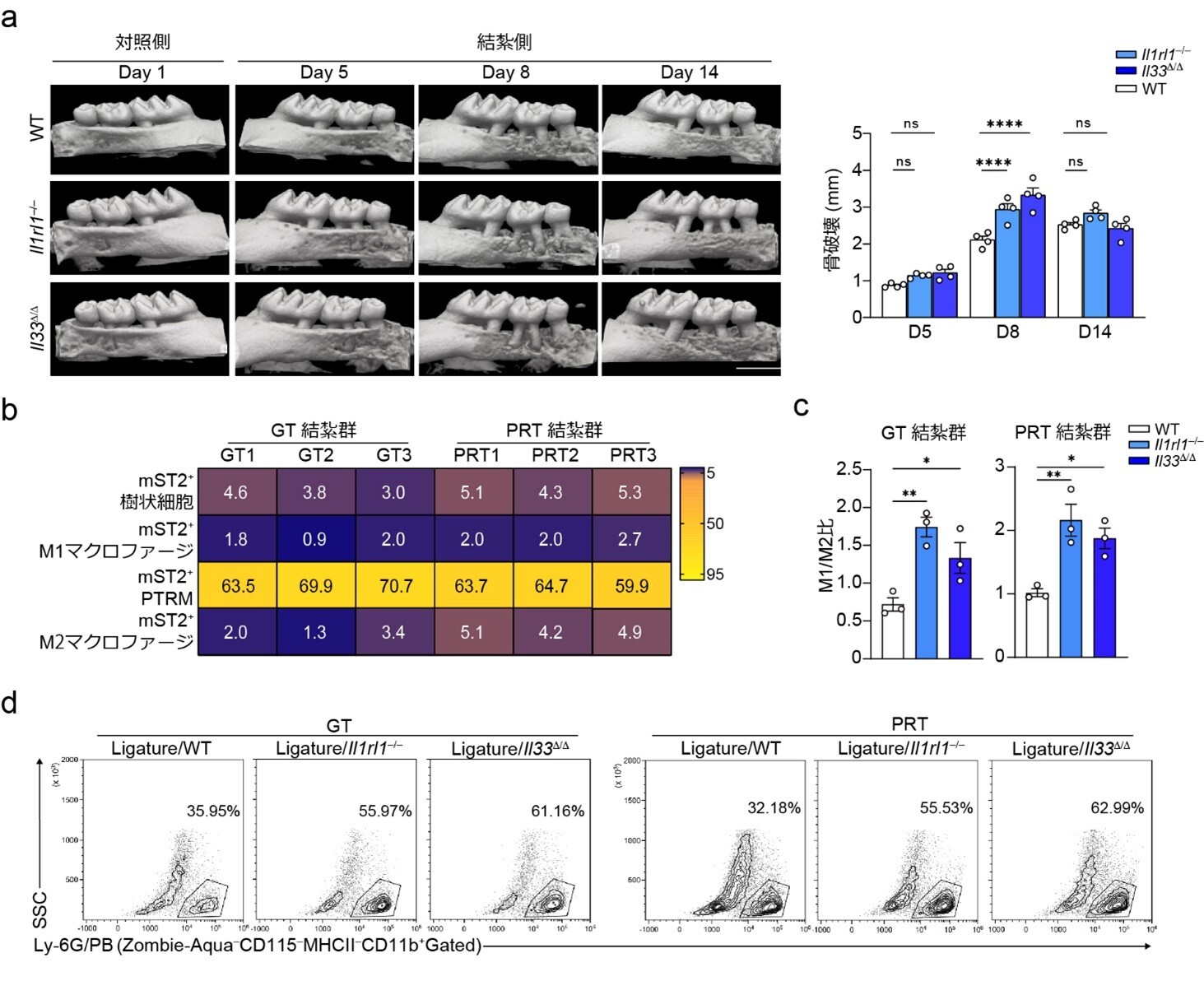
図3. a マイクロCTによる骨破壊量評価。ノックアウトマウスの骨破壊急性期(Day 8)における骨破壊量が野生型マウス(WT)と比較し、約1.5倍増加していた。 b 結紮後5日目のWTマウスにおけるmST2発現細胞の比率。PTRMが主な発現細胞群であった。 c 結紮後5日目の異なる遺伝子型のマウスにおけるM1/M2比率。どちらのノックアウトマウスでも約2倍に上昇していた。 d 結紮後5日目の異なる遺伝子型のマウスにおける好中球の比率。ノックアウトマウスでは顕著な上昇が見られた。
研究成果の意義
本研究の成果は、歯周病における炎症と骨破壊を調節する新規IL-33/ST2分子経路と歯根組織に存在する特定のマクロファージが関与する可能性を提示したことから、新たな歯周病治療および予防法開発につながることが期待されます(図4)
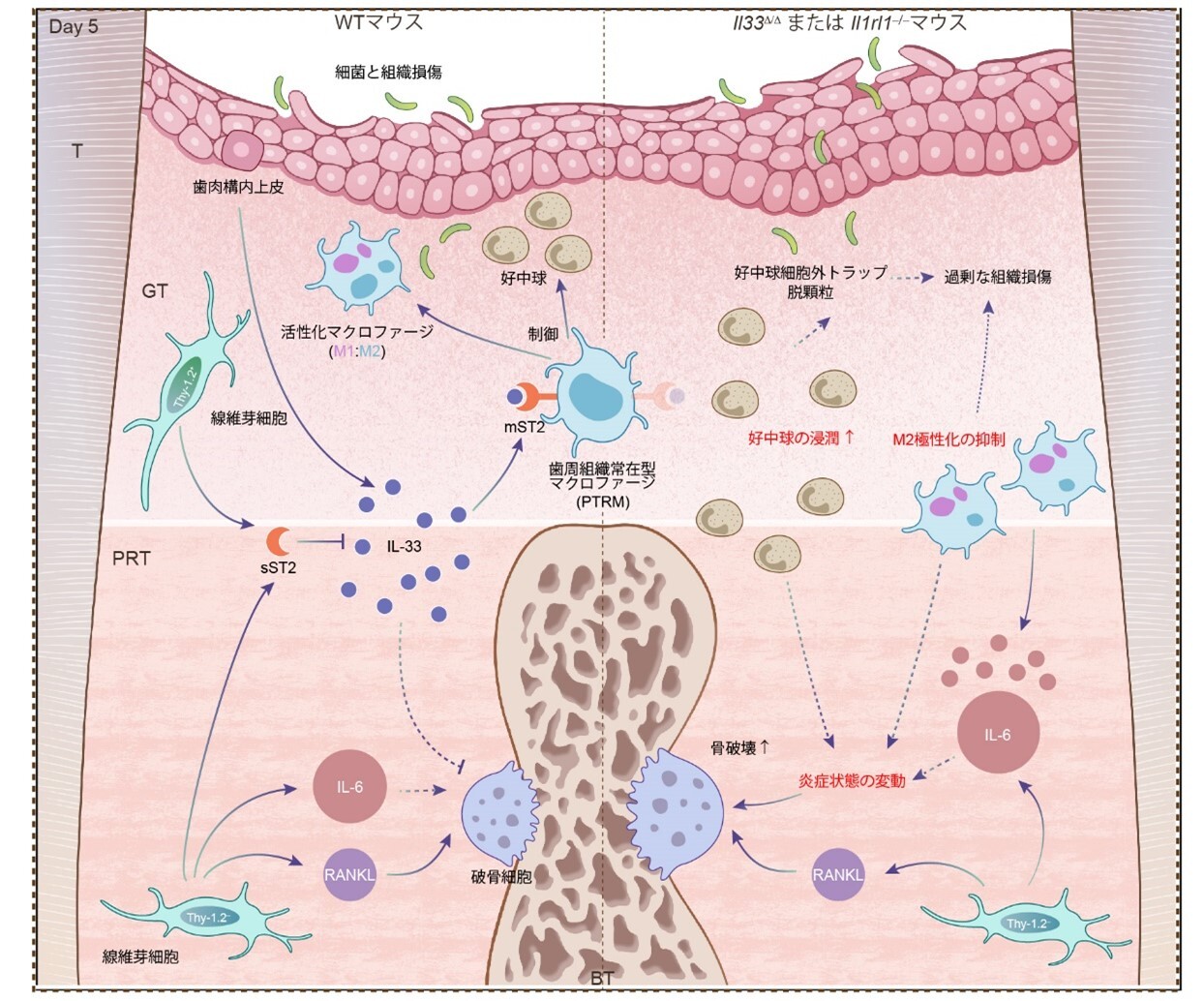
図4. 歯周炎発病過程の急性炎症進行期におけるIL-33/ST2経路の作用。
用語解説
※1マウス結紮誘導型歯周炎モデル
マウスの上顎臼歯に絹糸を結紮し、プラークを蓄積させることで歯周病を人為的に誘導する疾患モデル。2012年にHajishengallisらにより初めて提唱され、その有効性から現在歯周炎の研究で幅広く使用されている。
※2IL-33(インターロイキン-33)
IL-33はインターロイキン-1(IL-1)ファミリーに属し、ST2(遺伝子名:Il1rl1)を受容体とするサイトカイン。その作用は宿主防御、免疫調節、神経損傷、炎症など多岐にわたることが知られている。
※3ノックアウトマウス
遺伝子操作により特定の遺伝子を欠損させたマウス。遺伝子産物の機能が不明な場合にその機能を推定するために作製、使用される。
論文情報
掲載誌: Nature Communications
論文タイトル: The IL-33/ST2 axis is protective against acute inflammation during the course of periodontitis
DOI: https://doi.org/10.1038/s41467-024-46746-2
研究者プロフィール

中島 友紀 (ナカシマ トモキ) Tomoki Nakashima
東京医科歯科大学歯学部 教授
・研究領域
骨生物学、骨代謝学、分子生物学

林 幹人 (ハヤシ ミキヒト) Mikihito Hayashi
東京医科歯科大学 大学院医歯学総合研究科
分子情報伝達学分野 准教授
・研究領域
骨代謝学、分子生物学

岩田 隆紀 (イワタ タカノリ) Takanori Iwata
東京医科歯科大学 大学院医歯学総合研究科
歯周病学分野 教授
・研究領域
歯周治療系歯学、再生医用工学・再生歯学

劉 安豪 (リュウ アンハオ) Anhao Liu
東京医科歯科大学 大学院医歯学総合研究科
歯周病学分野 大学院生
・研究領域
歯周治療系歯学、骨代謝学、分子生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学歯学部
中島 友紀 (ナカシマ トモキ)
E-mail:naka.csi[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

