「 損傷ミトコンドリアがオートファジーで選択的に分解される作用機序を解明 」【山野晃史 准教授】
―ALSの原因タンパク質がオートファジーの初期膜形成に必須―
ポイント
- 損傷ミトコンドリアの適切な排除ができないとパーキンソン病※1などの神経変性疾患を発症する可能性が注目されています。
- 筋萎縮性側索硬化症(ALS)※2の原因タンパク質TBK1が損傷ミトコンドリアの排除に必要であることは示唆されていましたが、その分子機構は不明でした。
- 今回の研究で、同じくALSの原因タンパク質であるOptineurinが損傷ミトコンドリアとオートファジー膜の接触部位を形成し、TBK1を活性化することを発見しました。
- 損傷ミトコンドリアの分解を制御できる、OPTNに対する人工抗体を開発し、TBK1の活性化メカニズムを明らかにしました。
研究の背景
機能分子病態学分野の研究グループは、遺伝性パーキンソン病の原因遺伝子に注目して研究を開始し、これまでに「損傷ミトコンドリアはユビキチン鎖※3で修飾され、オートファジー※4で選択的に分解されること、これによって細胞の恒常性が維持され、パーキンソン病の発症を抑えていること」を明らかにしてきました(図1)。しかし、ダイナミックな膜動態を示すオートファジーの分子機構は非常に複雑で、なぜ損傷ミトコンドリアの周辺のみでオートファジーの膜構造が出現・伸張するかについては多くの謎が残されていました。
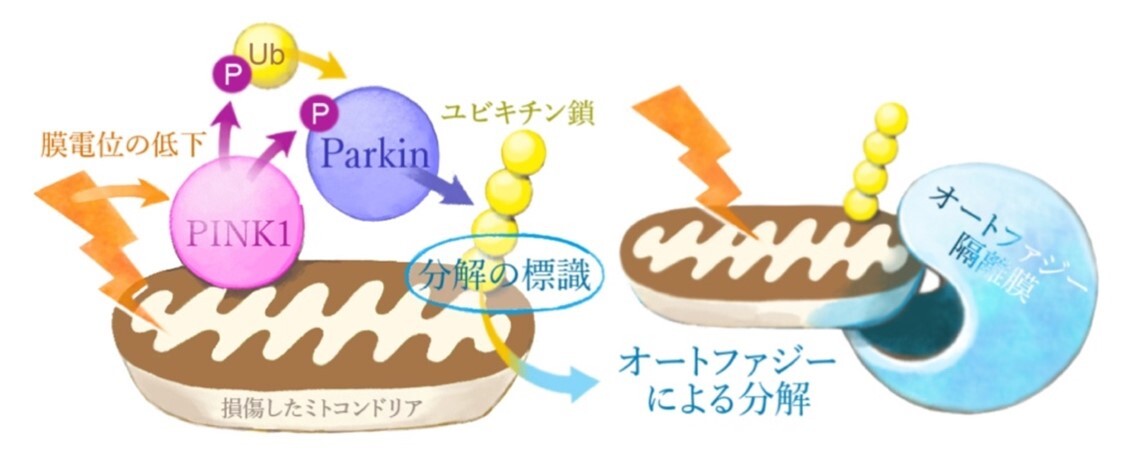
図1:膜電位の低下に伴い、ミトコンドリアが損傷すると、PINK1とParkinが協調して損傷ミトコンドリアにユビキチン鎖を付加し、オートファジー依存的な分解へと導く。
研究成果の概要
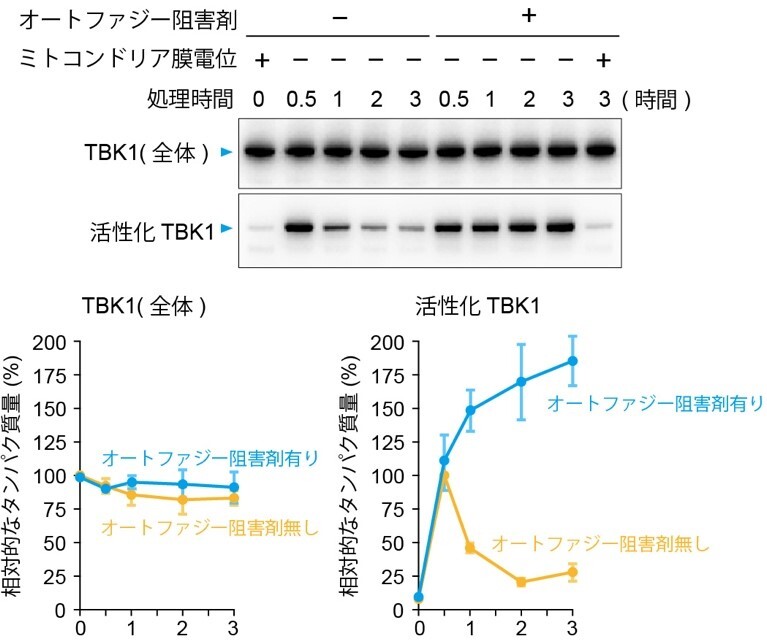
図2:人為的にミトコンドリアを損傷させるとTBK1が活性化し、活性化TBK1は速やかにオートファジーで分解される。
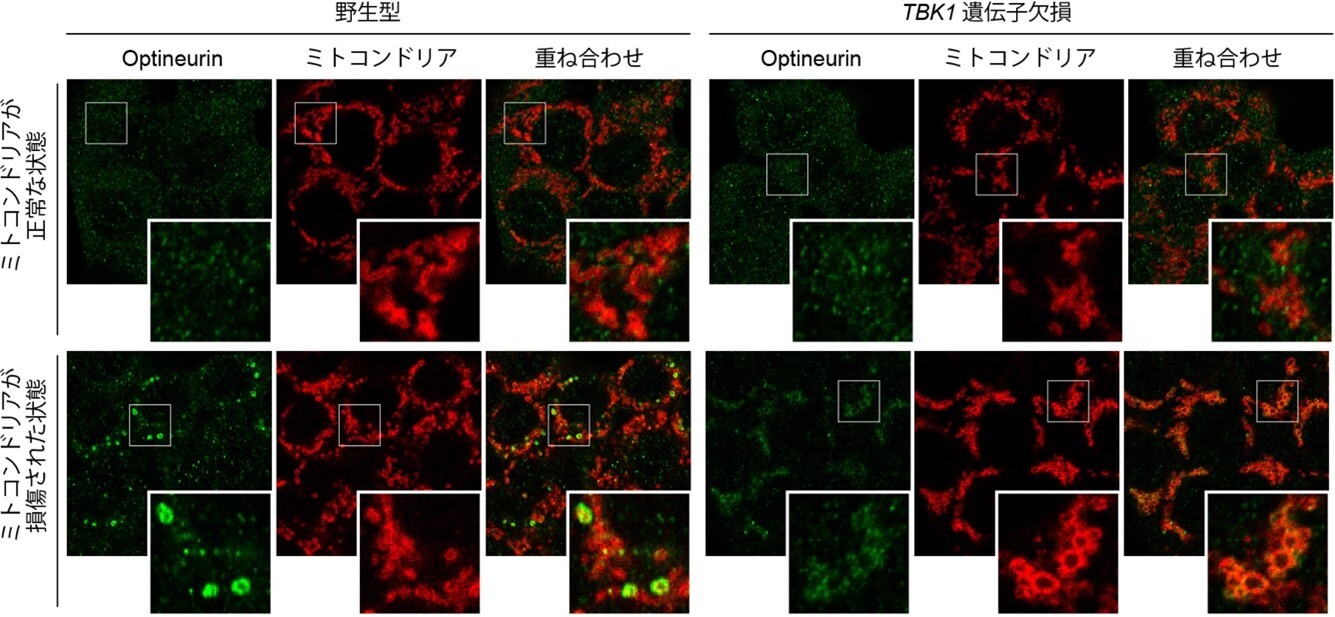
図3:損傷ミトコンドリアの近傍にOptineurinは集積するが、TBK1の欠損でその集積が抑制される。
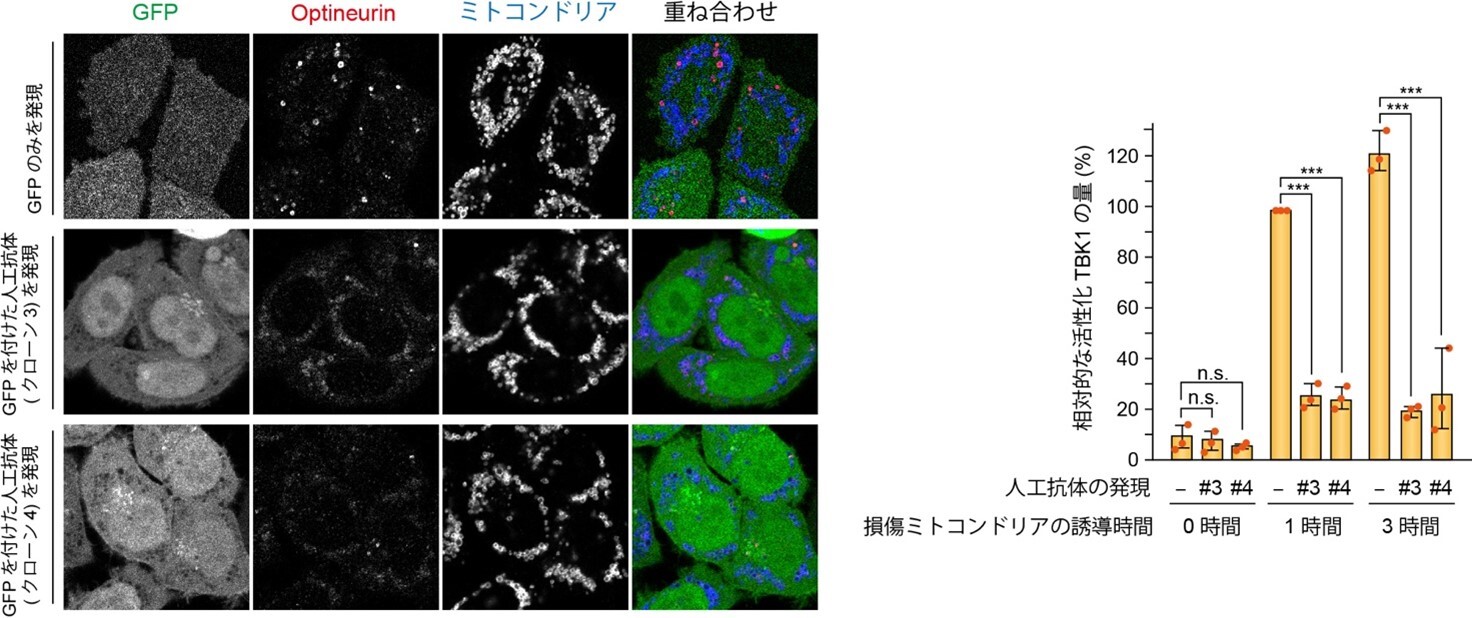
図4:Optineurinに結合する人工抗体を発現させると、Optineurinの損傷ミトコンドリアへの集積が阻害される(左図)。Optineurinの人工抗体を発現させると、活性化TBK1の誘導が阻害される(右図)。
研究成果の意義
損傷ミトコンドリアの選択的分解は、超高齢化社会を迎える日本において、健康寿命を考える上で非常に重要な課題です。また、世界中でも精力的に研究がなされています。本研究で得られた知見に基づき、パーキンソン病と筋萎縮性側索硬化症の発症機序・分子機構の共通点を見出し、引き続き、神経変性疾患の根幹に潜む分子機構の解明に取り組んでいきます。
用語解説
※2筋萎縮性側索硬化症・・・・・・・・運動ニューロンが変性脱落する進行性の神経変性疾患です。全身の筋肉が徐々に萎縮して筋力が低下していく難病であり、発症の根本的な原因も不明で、治療法の確立も難航しています。
※3ユビキチン・・・・・・・・細胞の中で他のタンパク質に結合する小さなタンパク質です。タンパク質性の翻訳後修飾因子として知られ、ユビキチン同士が数珠状に結合したユビキチン鎖となって、分解の目印として機能します。ユビキチン修飾を受けたタンパク質はプロテアソームと呼ばれる装置で分解されることは古くから知られていましたが、ミトコンドリアのような膜構造体をオートファジーで分解する目印にもなることがわかってきました。
※4オートファジー・・・・・・・・細胞内のタンパク質を分解するための仕組みです。分解対象物を膜で囲み、リソソームと融合することで内容物を分解します。オートファジーは個体の発生、神経変性疾患や癌の抑制に関与することが知られています。オートファジーの仕組みを解明した功績により、大隈良典博士は2016年、ノーベル生理学・医学賞を受賞しました。
論文情報
掲載誌:EMBO Journal
論文タイトル:Optineurin provides a mitophagy contact site for TBK1 activation
DOI:https://doi.org/10.1038/s44318-024-00036-1
研究者プロフィール

東京医科歯科大学 難治疾患研究所
機能分子病態学分野 准教授
・研究領域
生化学、分子細胞生物学
東京医科歯科大学 医歯学総合研究科
医歯理工保健学専攻 大学院生
・研究領域
生化学、分子細胞生物学
林 剛介(ハヤシ ゴウスケ) Gosuke Hayashi
名古屋大学 大学院工学研究科
生命分子工学専攻 准教授
・研究領域
タンパク質化学合成、進化分子工学
村上裕(ムラカミ ヒロシ) Hiroshi Murakami
名古屋大学 大学院工学研究科
生命分子工学専攻 教授
・研究領域
生物分子科学
田中啓二(タナカ ケイジ) Keiji Tanaka
公益財団法人 東京都医学総合研究所 理事長
・研究領域
生化学、分子細胞生物学

東京医科歯科大学 難治疾患研究所
機能分子病態学分野 教授
・研究領域
生化学、分子細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
機能分子病態学分野 山野 晃史(ヤマノ コウジ)
E-mail:kojibiom[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

