「 タンパク質が別のタンパク質と相互作用する部位を特定する新しい方法を開発 」【横山三紀 准教授】
公開日:2023.11.27
「 タンパク質が別のタンパク質と相互作用する部位を特定する新しい方法を開発 」
―ダノン病の治療やシャペロン依存性オートファジーのメカニズム解明への新知見―
―ダノン病の治療やシャペロン依存性オートファジーのメカニズム解明への新知見―

ポイント
- タンパク質同士の接触面がどこにあるかを知るための、多くのタンパク質に適用できる新しい方法を開発しました。
- 本研究では開発した方法をリソソームの主要な膜タンパク質であるLAMP-2に適用して、LAMP-2が三量体以上の複合体を形成できることを明らかにしました。
- 本研究の結果はLAMP-2を必要とするタンパク質分解経路(シャペロン依存性オートファジー)の分子機構の解明に寄与します。
- LAMP-2の変異を原因とする指定難病であるダノン病の新規治療法開発への応用が期待できます。
東京医科歯科大学 大学院医歯学総合研究科 病態生化学分野の横山 三紀准教授、寺澤 和恵連携研究員(リベロセラ社研究員)、歯周病学分野の清家 達朗大学院生、構造生物学講座の横山 茂之教授の研究グループは、理化学研究所、東京大学との共同研究で、タンパク質同士の接触面がどこにあるかを知るための新しい方法を開発しました。この研究は文部科学省科学研究費補助金等の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Protein Scienceに、2023年10月31日にオンライン版で発表されました。
研究の背景
タンパク質分子はいくつかが合体してあたかも一つの分子のように挙動したり、緩やかに集まったものが変幻自在に形を変えたりします。そのときタンパク質同士がどの部分で結合しているかは重要な情報で、その知見があれば疾患の原因となる不都合なタンパク質の挙動を抑制する治療薬の開発が可能です。結晶構造解析はタンパク質同士が相互作用する部位を知るために極めて有力ですが、タンパク質を細胞から単離すると相互作用が消失してしまう場合には適用できません。タンパク質間の相互作用が細胞内という状況下で起こる時に適用できる方法に、部位特異的光架橋があります。細胞において、光反応性の架橋部位を導入したタンパク質Aと相手側のタンパク質Bとの間で架橋が形成されれば両者が直接的に相互作用していることを示すことができます。そして架橋部位を導入した位置はタンパク質Aがタンパク質Bと結合する接触面の近傍にあると考えられます。しかしこの方法では相手側タンパク質Bのどの部位と架橋が形成されたかを知ることは困難でした。
LAMP-2※1は細胞内での分解反応を担当する細胞内小器官であるリソソームの膜に豊富に存在する高度に糖鎖付加された膜タンパク質です。LAMP-2はリソソームの形成やオートファジーの進行に重要で、LAMP-2の遺伝子変異はヒトのダノン病 (心筋症、ミオパチー、精神遅延を特徴とするX連鎖性遺伝疾患)の原因となります。研究グループは部位特異的光架橋を用いてリソソーム膜上でLAMP-2同士が複合体を形成することを示し、複合体の構造モデルを提唱してきましたが、そのモデルを検証するために架橋の相手側を同定する方法を開発する必要がありました。
LAMP-2※1は細胞内での分解反応を担当する細胞内小器官であるリソソームの膜に豊富に存在する高度に糖鎖付加された膜タンパク質です。LAMP-2はリソソームの形成やオートファジーの進行に重要で、LAMP-2の遺伝子変異はヒトのダノン病 (心筋症、ミオパチー、精神遅延を特徴とするX連鎖性遺伝疾患)の原因となります。研究グループは部位特異的光架橋を用いてリソソーム膜上でLAMP-2同士が複合体を形成することを示し、複合体の構造モデルを提唱してきましたが、そのモデルを検証するために架橋の相手側を同定する方法を開発する必要がありました。
研究成果の概要
本研究で開発した方法は相手側タンパク質Bに予め部位特異的な「切断部位」を仕込んでおくことで、タンパク質Aとの架橋が形成された部位を決めるものです。拡張遺伝暗号を用いた非天然アミノ酸の導入技術※2を利用して、光反応性の架橋部位が入ったタンパク質Aと、アルカリ処理で自発的に切断が起こる切断部位が入ったタンパク質Bを細胞に作らせます。架橋部位と切断部位をそれぞれ狙った位置に入れられる点がポイントです。細胞内でタンパク質Aとタンパク質Bが直接結合している場合には、細胞に紫外線を照射すると両者の架橋物が形成されます。架橋物をアルカリ処理した時に、タンパク質Bの末端に入れた目印が残る場合には、切断部位と目印の間で架橋が形成されています(図1の上の場合)。反対に目印が残らない場合には、架橋は切断部位を入れた位置よりも目印から遠いところで形成されています(図1の下の場合)。切断部位の位置を変えていくことで、架橋が形成された範囲を絞り込むことができます。
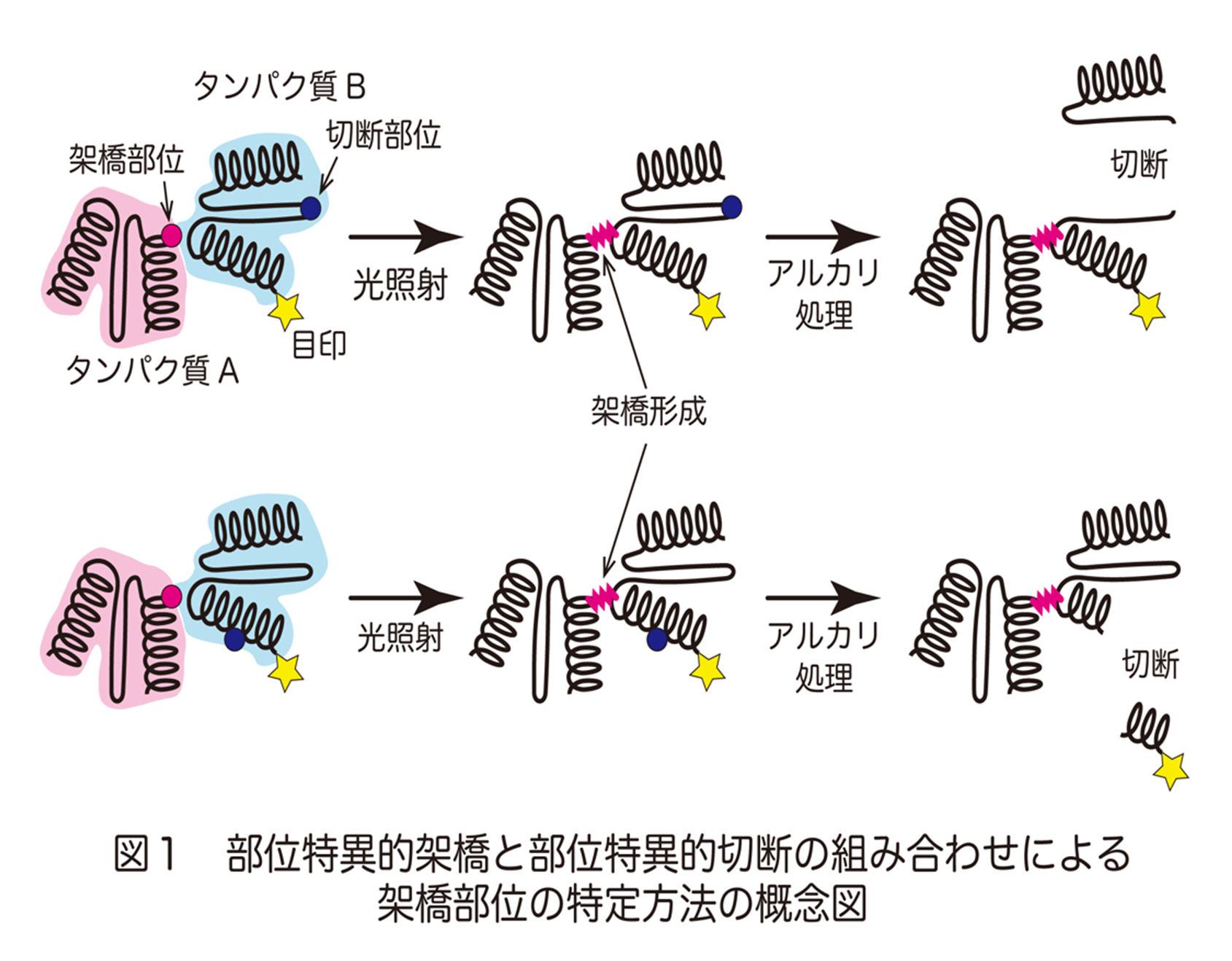
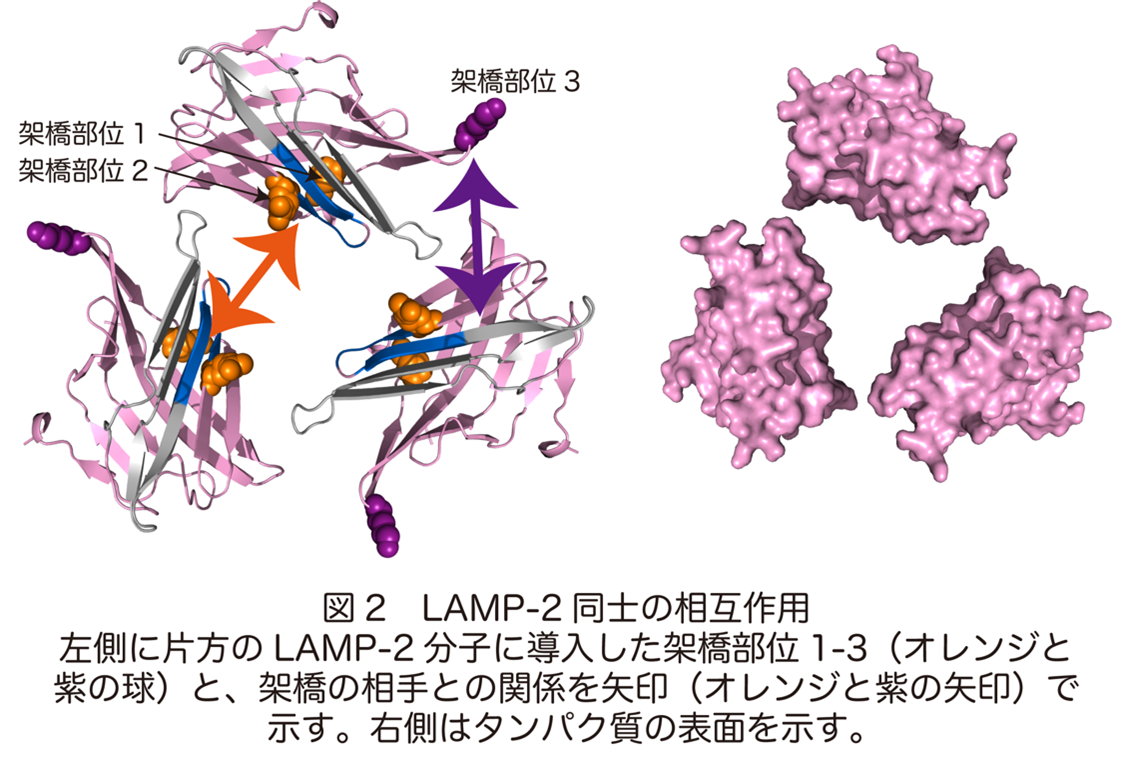
この方法をLAMP-2同士の複合体に適用して、これまでに検出した架橋が相手側LAMP-2のどの部位との間に形成されたかを調べました。その結果、1分子のLAMP-2に対して両隣のLAMP-2は異なる方向から接触すること、すなわちLAMP-2は少なくとも三量体以上の多量体を形成できること、が明らかになりました(図2)。
研究成果の意義
本研究で開発した手法は部位特異的光架橋の課題であった、「架橋の相手を決めること」に対する解決策となります。またこの方法で用いる-ヒドロキシ酸※3を切断部位として導入する行程は、正常な高次構造が出来上がってからタンパク質を切断できる点で、欠失体の作成では得られない情報が得られることが考えられます。
本研究では新しく開発した方法を用いてLAMP-2には多量体化能があることを明らかにしました。LAMP-2はシャペロン依存性オートファジーと呼ばれるリソソームでのタンパク質分解経路の必須因子です。シャペロン依存性オートファジーは生体の調節機構に重要であり、低下すると神経変性疾患や代謝疾患、過剰に亢進するとがんなどの病態を引き起こすことが報告されています。しかし分子機構には未解明の部分が多く残されています。またLAMP-2を責任遺伝子とするダノン病で筋細胞に自己貪食空胞が生じる理由も解明されていません。LAMP-2のリソソーム内での多量体化能の意味に着目することが新しい手がかりになると期待されます。
本研究では新しく開発した方法を用いてLAMP-2には多量体化能があることを明らかにしました。LAMP-2はシャペロン依存性オートファジーと呼ばれるリソソームでのタンパク質分解経路の必須因子です。シャペロン依存性オートファジーは生体の調節機構に重要であり、低下すると神経変性疾患や代謝疾患、過剰に亢進するとがんなどの病態を引き起こすことが報告されています。しかし分子機構には未解明の部分が多く残されています。またLAMP-2を責任遺伝子とするダノン病で筋細胞に自己貪食空胞が生じる理由も解明されていません。LAMP-2のリソソーム内での多量体化能の意味に着目することが新しい手がかりになると期待されます。
用語解説
※1LAMP-2
Lysosome-associated membrane protein-2 (LAMP-2)は1回膜貫通タンパク質で、タンパク質の大部分はリソソームの内腔側に存在する。LAMP-2にはC末端側の配列の異なる3種類のスプライスバリアント (LAMP-2A/2B/2C)があり、それらは膜貫通領域および細胞質側に突き出した約11アミノ酸基の短いペプチド部分の配列が異なる。
※2拡張遺伝暗号を用いた非天然アミノ酸の導入技術
通常はアミノ酸に翻訳されない終止コドンを非天然のアミノ酸に対応させてタンパク質を生合成する技術。Genetic code expansion (GCE)とも呼ばれる。終止コドンを認識するサプレッサーtRNAと、そのtRNAに非天然アミノ酸を付加できるように触媒部位を改変したアミノアシルtRNA合成酵素から成る人工的タンパク質合成系を用いる。本研究では片方のLAMP-2遺伝子の特定の部位のコドンをTAG (amber終止コドン)に変えて光反応性架橋部位となるpBpa: p-benzoyl- L-phenylalanineを、もう片方ではTGA (opal終止コドン)に変えて切断部位となるAllocLys-OH: Nε-allyloxycarbonyl-a-hydroxyl-L-lysine)を導入した。
※3a-ヒドロキシ酸
ヒドロキシ基を持つカルボン酸のこと。a-ヒドロキシ酸であるAllocLys-OHはアミノ基がヒドロキシ基であるため、AllocLys-OHがタンパク質に取り込まれた部分の主鎖はペプチド結合がエステル結合になり、アルカリ処理で切断される。
Lysosome-associated membrane protein-2 (LAMP-2)は1回膜貫通タンパク質で、タンパク質の大部分はリソソームの内腔側に存在する。LAMP-2にはC末端側の配列の異なる3種類のスプライスバリアント (LAMP-2A/2B/2C)があり、それらは膜貫通領域および細胞質側に突き出した約11アミノ酸基の短いペプチド部分の配列が異なる。
※2拡張遺伝暗号を用いた非天然アミノ酸の導入技術
通常はアミノ酸に翻訳されない終止コドンを非天然のアミノ酸に対応させてタンパク質を生合成する技術。Genetic code expansion (GCE)とも呼ばれる。終止コドンを認識するサプレッサーtRNAと、そのtRNAに非天然アミノ酸を付加できるように触媒部位を改変したアミノアシルtRNA合成酵素から成る人工的タンパク質合成系を用いる。本研究では片方のLAMP-2遺伝子の特定の部位のコドンをTAG (amber終止コドン)に変えて光反応性架橋部位となるpBpa: p-benzoyl- L-phenylalanineを、もう片方ではTGA (opal終止コドン)に変えて切断部位となるAllocLys-OH: Nε-allyloxycarbonyl-a-hydroxyl-L-lysine)を導入した。
※3a-ヒドロキシ酸
ヒドロキシ基を持つカルボン酸のこと。a-ヒドロキシ酸であるAllocLys-OHはアミノ基がヒドロキシ基であるため、AllocLys-OHがタンパク質に取り込まれた部分の主鎖はペプチド結合がエステル結合になり、アルカリ処理で切断される。
論文情報
掲載誌:Protein Science
論文タイトル: Site-specific photo-crosslinking/cleavage for protein–protein interface identification reveals oligomeric assembly of lysosomal-associated membrane protein type 2A in mammalian cells
DOI:https://doi.org/10.1002/pro.4823
研究者プロフィール

寺澤 和恵 (テラサワ カズエ) Terasawa Kazue
東京医科歯科大学 大学院医歯学総合研究科
病態生化学分野 連携研究員
リベロセラ社 研究員
・研究領域
生化学
東京医科歯科大学 大学院医歯学総合研究科
病態生化学分野 連携研究員
リベロセラ社 研究員
・研究領域
生化学

清家 達朗 (セイケ タツロウ) Seike Tatsuro
東京医科歯科大学 大学院医歯学総合研究科
歯周病学分野 大学院生
・研究領域
歯周病学、口腔生化学
東京医科歯科大学 大学院医歯学総合研究科
歯周病学分野 大学院生
・研究領域
歯周病学、口腔生化学

横山 三紀 (ヨコヤマ ミキ) Yokoyama Miki
東京医科歯科大学 大学院医歯学総合研究科
病態生化学分野 准教授
・研究領域
生化学、構造生物学
東京医科歯科大学 大学院医歯学総合研究科
病態生化学分野 准教授
・研究領域
生化学、構造生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 横山 三紀 (ヨコヤマ ミキ)
E-mail:m.yokoyama.bch[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

