「がん微小環境ネットワークを遮断することで腫瘍形成が阻害されることを発見」【渡部徹郎 教授、井上カタジナアンナ 助教】
― 副作用が少ない新規がん治療薬の開発に期待 ―

ポイント
- がん微小環境に豊富に存在するトランスフォーミング増殖因子(TGF-β)※1を阻害する新規Fc融合タンパク質※2を開発し、口腔がん細胞による腫瘍形成を抑制することを見出しました。
- このTGF-β阻害剤は、がん細胞や腫瘍血管に作用して、腫瘍形成を促進する様々な因子の発現を低下させて、がん微小環境ネットワーク※3を遮断することで腫瘍形成を阻害することをつきとめました。
- このTGF-β阻害剤による副作用は観察されず、TGF-βが関連する様々な疾患に対する新規治療薬の開発への応用が期待できます。
研究の背景
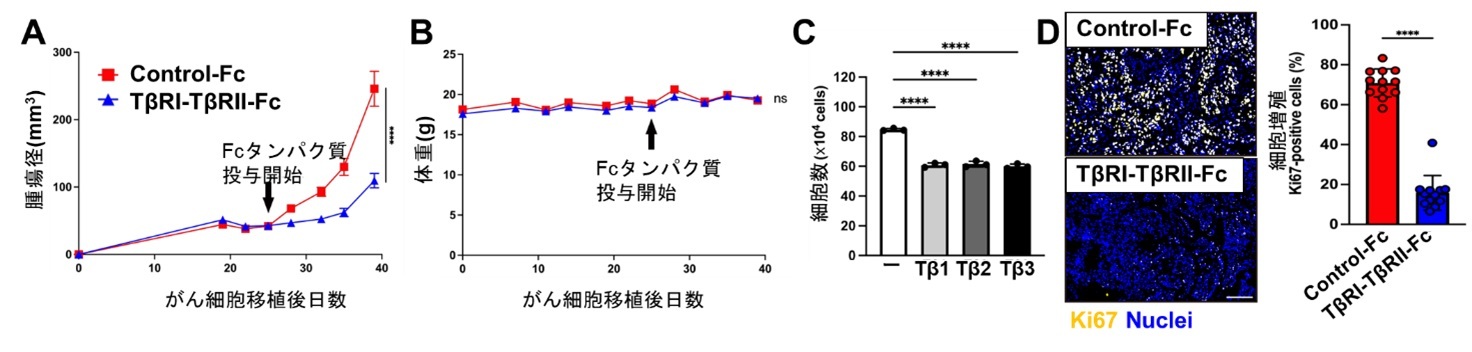
図1 TGF-β阻害Fc融合タンパク質は、がん細胞の増殖を低下させることで腫瘍形成を阻害した
(A・B) ヒト口腔がん細胞を移植した免疫不全マウスにTGF-β阻害Fc融合タンパク質(TβRI-TβRII-Fc:青線)を投与したところ、コントロール(Control-Fc:赤線)と比較して腫瘍形成が阻害された(A)。また、 Fcタンパク質による体重減少などの副作用は観察されなかった(B)。(C) 培養口腔がん細胞にTGF-β(Tβ)の3つのアイソフォームを添加すると、細胞数は減少した。(D) TGF-β阻害Fc融合タンパク質を投与したマウスの腫瘍組織において、がん細胞の増殖(増殖マーカーであるKi67染色により計測)が低下していた。
研究成果の概要
このパラドックスを解明するために、研究グループはまず腫瘍組織における血管新生に着目しました。腫瘍組織における血管は酸素や栄養分を供給することで、がん細胞の増殖を促進することが知られていますが、TGF-β阻害Fc融合タンパク質の投与により腫瘍血管新生が低下していることが明らかとなりました(図2A)。さらに、腫瘍組織における遺伝子の発現をRNAシークエンシングの手法で解析しました(図2)。その結果、TGF-β阻害Fc融合タンパク質の投与により、ヒトがん細胞ならびにマウス間質において EMTが阻害され、細胞増殖を促進するKRASシグナルが低下していることが明らかとなりました (図2B)。さらに、腫瘍組織におけるTGF-βシグナルの阻害により、がん細胞の増殖や血管新生を促進する作用があるヘパリン結合性上皮細胞成長因子(HB-EGF)※7などの発現が低下してい ることが明らかとなりました(図2C・図3A)。
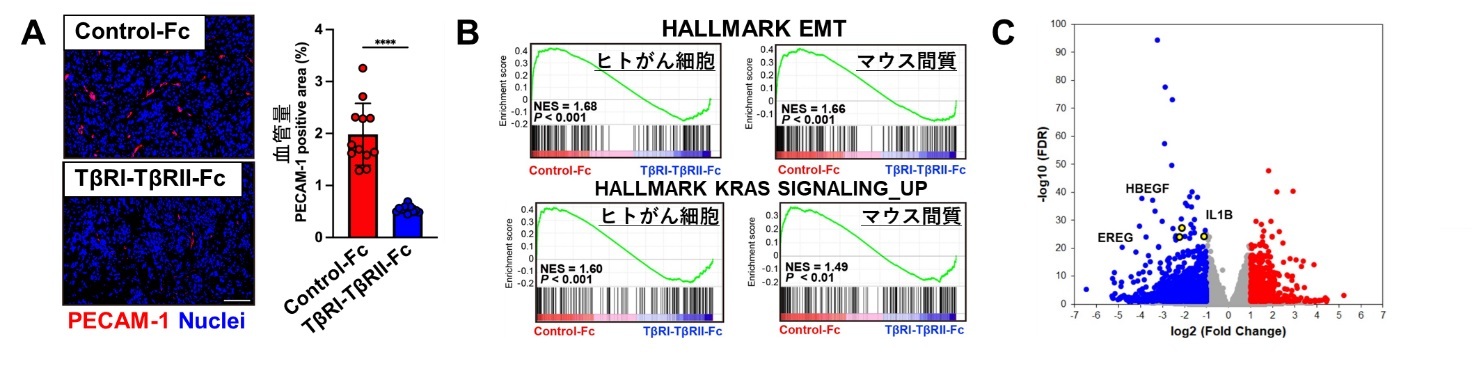
図2 TGF-β阻害Fc融合タンパク質は、がん微小環境に作用して、がん細胞の増殖や腫瘍血管新生を抑制した
(A) TGF-β阻害Fc融合タンパク質(TβRI-TβRII-Fc)を投与したヒト口腔がん細胞由来の腫瘍組織における血管新生(血管内皮細胞マーカーであるPECAM-1染色により計測)は低下していた。(B・C)腫瘍組織における遺伝子発現をRNAシークエンシングにより解析した。(B) Gene Set Enrichment Analysis (GSEA)により、TGF-β阻害Fc融合タンパク質投与により、ヒトがん細胞ならびにマウス間質において上皮間葉移行(EMT)が阻害され、細胞増殖を促進するKRASシグナルが低下していることが明らかとなった。(C) さらにTGF-β阻害Fc融合タンパク質投与により発現が上昇する遺伝子(赤)と低下する遺伝子(青)を解析した結果、HB-EGF、IL-1β、EREGなどのがん細胞の増殖や腫瘍血管新生を促進する因子の発現が低下していることが明らかとなった。
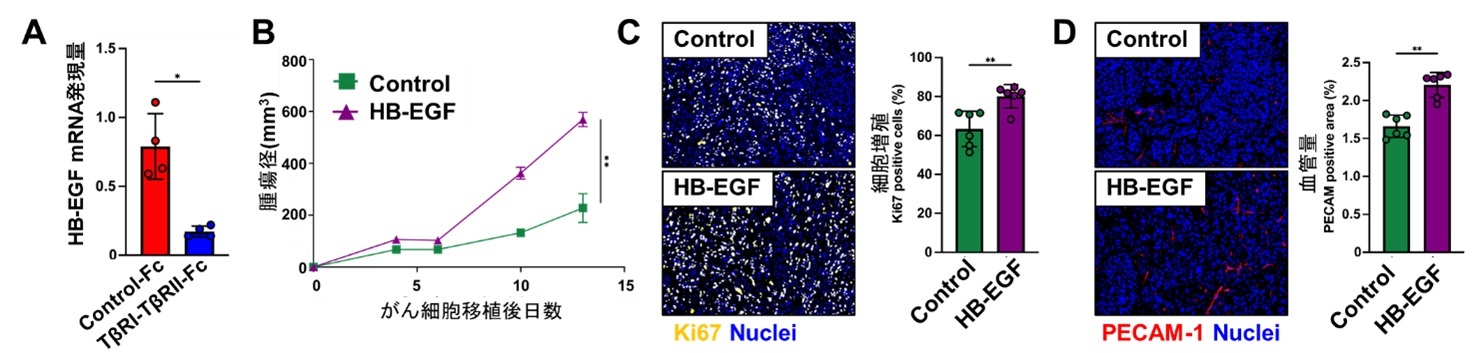
図3 ヘパリン結合性上皮細胞成長因子(HB-EGF)は、がん細胞の増殖と腫瘍血管新生を促進することで腫瘍形成を亢進する
(A)TGF-β阻害Fc融合タンパク質(TβRI-TβRII-Fc)を投与したヒト口腔がん細胞由来の腫瘍組織におけるHB-EGFの発現が低下していることが定量的RT-PCRにより明らかとなった。(B-D) HB-EGFの発現を上昇させたヒト口腔がん細胞を免疫不全マウスに移植して、その作用を解析したところ、HB-EGFの発現により、腫瘍形成は促進されるとともに(B)、腫瘍組織におけるがん細胞の増殖(C:増殖マーカーであるKi67染色により計測)と血管新生(D:血管内皮細胞マーカーであるPECAM-1染色により計測)が上昇していることが明らかとなった。
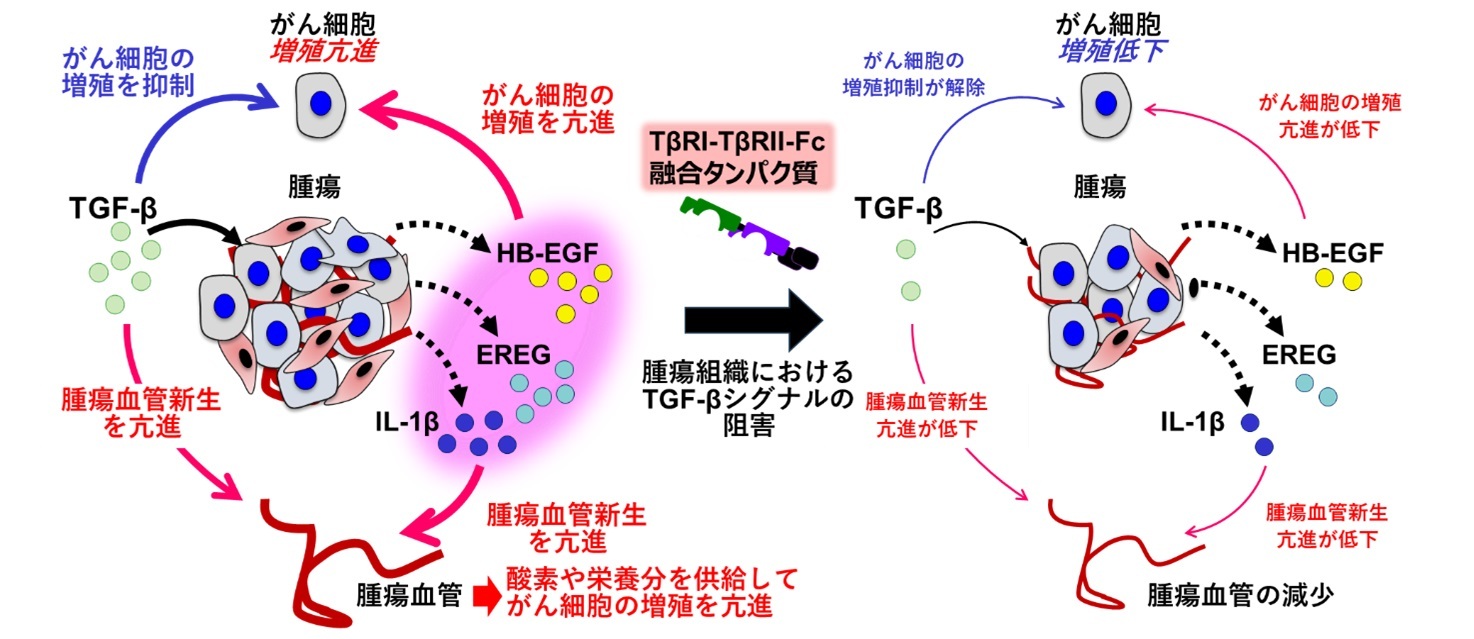
図4 TGF-β阻害Fc融合タンパク質はがん微小環境ネットワークを遮断することで腫瘍形成を阻害する
がん微小環境におけるTGF-βシグナルは、がん細胞の増殖を抑制するが、同時にがん細胞やがん間質などに作用してHB-EGFなどの、がん細胞の増殖や腫瘍血管新生を亢進する因子の発現を上昇させることで間接的にがん細胞の増殖を亢進する(図左)。TGF-β阻害Fc融合タンパク質(TβRI-TβRII-Fc)は、腫瘍組織におけるTGF-βシグナルを阻害してHB-EGFなどの発現を低下させることで、がん微小環境ネットワークが遮断され、がん細胞の増殖の低下や腫瘍血管の減少を介して、結果として腫瘍形成が阻害されることが明らかとなった。
研究成果の意義
がん微小環境中のサイトカインを阻害する分子標的治療薬の候補として、サイトカイン受容体の細胞外領域を用いたFc融合タンパク質に注目が集まっています。Fc融合タンパク質などのタンパク質製剤は血中半減期が多くの低分子医薬品よりも長いことが知られており、治療薬としての優位性があることがわかっています。本研究の成果により、TGF-βの全てのアイソフォームを阻害できるFc融合タンパク質が、腫瘍形成をより効率良く抑制できることが示されたため、将来口腔がんのみならず、神経膠芽腫などのTGF-β2の発現が高いがん種におけるがん微小環境ネットワークシグナルを標的とした新たながん治療法への導出が期待されます。
用語解説
※2 Fc融合タンパク質: 受容体細胞外ドメイン等の機能性タンパク質と抗体イムノグロブリン(IgG)のFc領域を融合させたタンパク質。これまでに、エタネルセプト(腫瘍壊死因子α受容体の細胞外領域を利用した関節リウマチなどの治療薬)などが承認されている。
※3がん微小環境ネットワーク: 腫瘍組織に存在する、がん細胞、腫瘍血管やがん関連線維芽細胞(CAF)などの様々な種類の細胞から構成されるネットワークを指す。これらの細胞は、TGF-βなどのサイトカインや成長因子を分泌することで相互作用し、がんの進展を制御している。
※4 サイトカイン:細胞から分泌される低分子のタンパク質で生理活性物質の総称。細胞間相互作用に関与し、周囲の細胞に影響を与える。
※5上皮間葉移行(EMT):上皮細胞が間葉系細胞へと分化する過程で、細胞は細胞間接着分子であるE-cadherinなどの発現を消失し、Vimentinなどの発現や高い運動・浸潤能などの間葉系細胞の形質を獲得する。EMTは発生過程で見られる生理的な現象だが、組織の線維化やがん転移などの病態の進展にも関与する。
※6 腫瘍血管新生:腫瘍が成長するためには栄養と酸素を供給して老廃物・代謝産物を運び出すことが必要であり、腫瘍内への新しい血管の侵入、すなわち血管新生が必要となる。血管新生は血管内皮増殖因子(VEGF)などにより制御され、腫瘍内に侵入した新生血管はがん細胞の遠隔臓器への転移の主要経路となる。
※7 ヘパリン結合性上皮細胞成長因子(Heparin-Binding Epidermal growth factor-like Growth Factor: HB-EGF): EGFファミリーに属するヘパリン結合性の増殖因子。HB-EGFは他のEGFファミリーと同様に、膜型タンパク質(proHB-EGF)として合成され、細胞接着を介した細胞間情報伝達に機能する一方、酵素的切断を受け、細胞外に放出される分泌型(sHB-EGF)がEGF受容体に結合し、細胞増殖・運動など種々のシグナルを伝達する。HB-EGFは心臓の発生や機能維持など様々な生理的過程に関与しながら、がんの発症・進展などの様々な病理的過程で重要な働きをしていることが明らかとなっている。
論文情報
掲載誌:Cancer Science
-
論文タイトル:Inhibition of transforming growth factor-β signals suppresses tumor formation by regulation of tumor microenvironment networks
研究者プロフィール

東京医科歯科大学大学院医歯学総合研究科
顎口腔腫瘍外科学分野・病態生化学分野 大学院生
・研究領域
がん生物学、口腔外科学

東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
がん生物学、生化学

東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 教授
・研究領域
がん生物学、血管生物学、生化学
問い合わせ先
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 渡部 徹郎 (ワタベ テツロウ)
E-mail: t-watabe.bch[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

