「慢性腎臓病による“血液脳関門の機能障害”と”タウタンパク質の不溶化”を発見」【内田信一 教授、萬代新太郎 助教】
― 認知症のメカニズム解明に貢献しうる知見 ―

ポイント
- 慢性腎臓病は認知症のリスク因子として知られますが、その分子病態メカニズムは不明な点が多いのが現状でした。
- 慢性腎臓病モデル動物の脳に起こる変化を追究した結果、アルツハイマー病と類似して、血液脳関門の透過性の亢進、タウタンパク質の不溶化が起こることを発見しました。
- 腎臓病によって血液中に増える尿素が、マトリックスメタロプロテアーゼ2を活性化し、血液脳関門の機能異常と脳への物質の透過性亢進に関わることが分かりました。
- 腎臓病による血管障害や認知症メカニズムの解明や治療法の開発に貢献しうる知見が得られました。
研究の背景
CKDは、やがて透析を必要とする前段階から、全身の臓器に影響を及ぼすことが分かってきました。研究グループはこれまで、CKDに潜在する複雑病態・multi-morbidity(多併存症)を克服するための研究や1,2)、CKDによる血管障害などの腎外臓器合併症(臓器連関)のメカニズムを科学的に解明して治療開発に繋げるための研究を行ってきました3)(東京医科歯科大学プレスリリース発2021.11.4、2022.8.19、2023.2.13)。
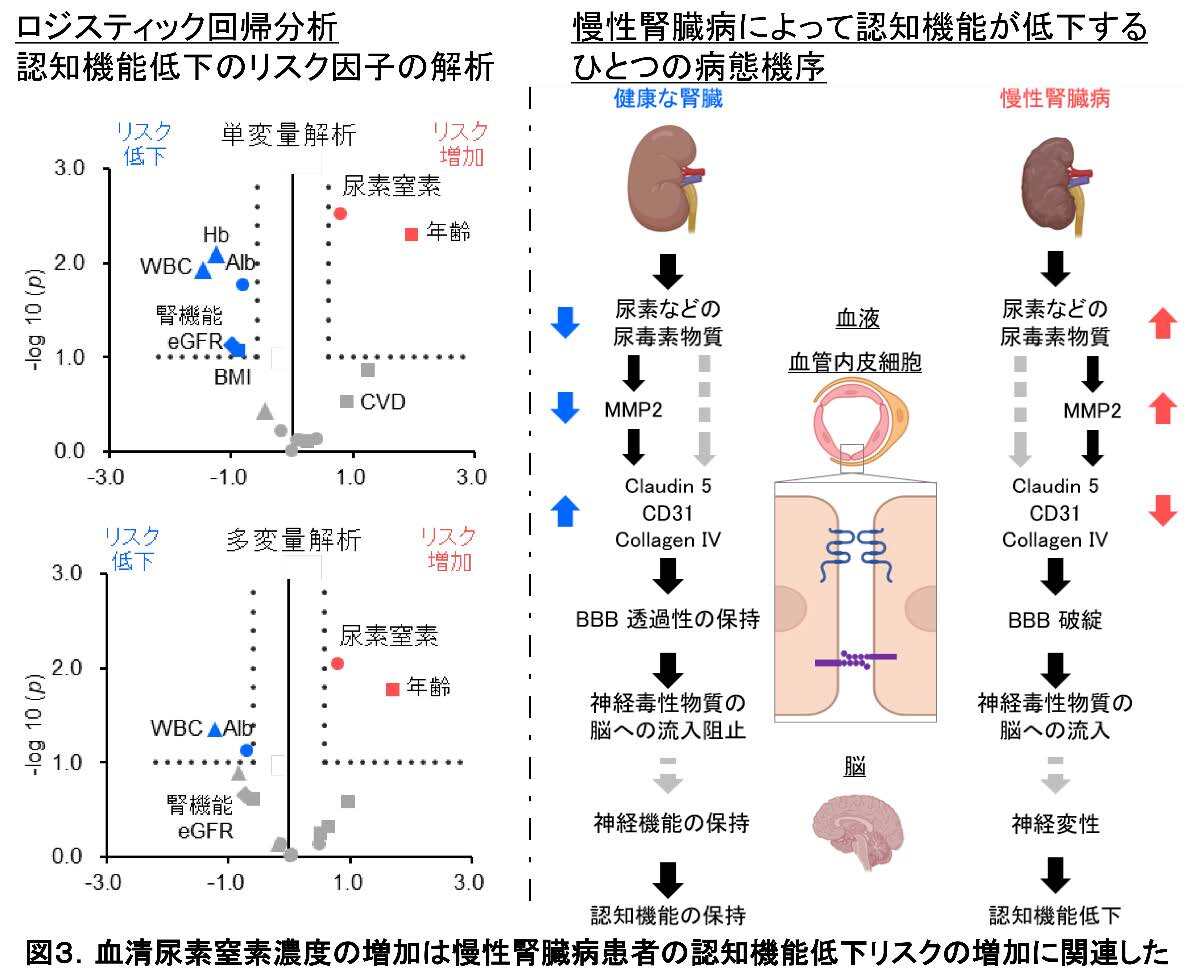
CKDは、睡眠障害、気分障害、むずむず足症候群、認知機能障害など様々な神経学的合併症を引き起こすことが知られています。特に認知症については、eGFR※2低下やアルブミン尿が独立したリスク因子と報告されており、最近の大規模な観察研究でも、認知症の原因として10 %程度がCKDで説明できるとされます4)。しかしながら、CKDによって認知症が起こりやすくなる分子メカニズムは十分には分かっていませんでした。
とりわけ認知症の代表格であるアルツハイマー病では、アミロイドβやタウなどのタンパク質が不溶化、蓄積することがその病態の根幹をなすと考えられていますが、病初期には血液脳関門(blood-brain barrier、BBB)の破綻が起こっていることも注目されています5)。BBBは循環血液と中枢神経系を隔てる構造物です。アミノ酸、グルコースのような脳にとって重要な栄養素などをのぞいて、自由な物質透過をゆるさないゲートキーパーです。BBBが機能障害を起こすことは疾患の発症に繋がる一方で、中枢神経系の治療薬がBBBを超えて脳に移行しやすくさせる創薬研究もとても重要です。従って、BBBの透過性が変化するメカニズムが分かることは、2つの側面から重要な意味を持ちます。研究グループは今回、認知症の病態理解のため、新たな切り口で、CKDによって脳血管の障害と神経変性の分子病態が惹起される可能性に着目しました。
研究成果の概要
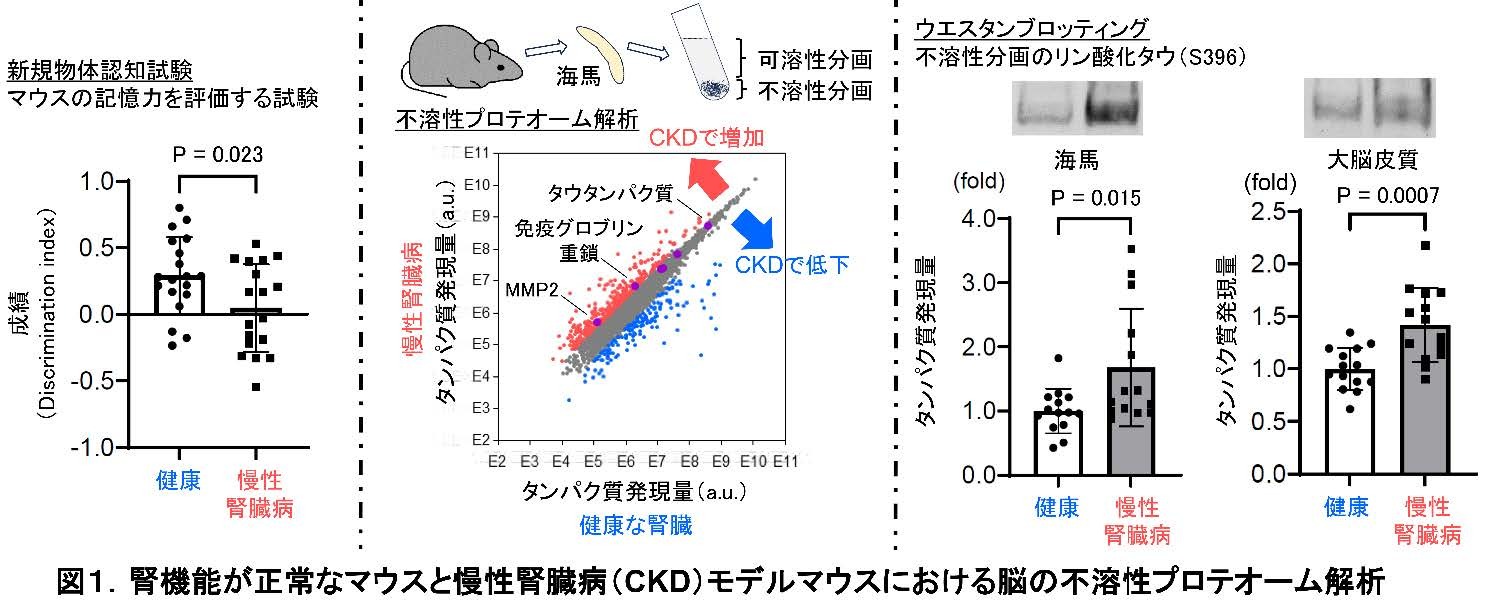
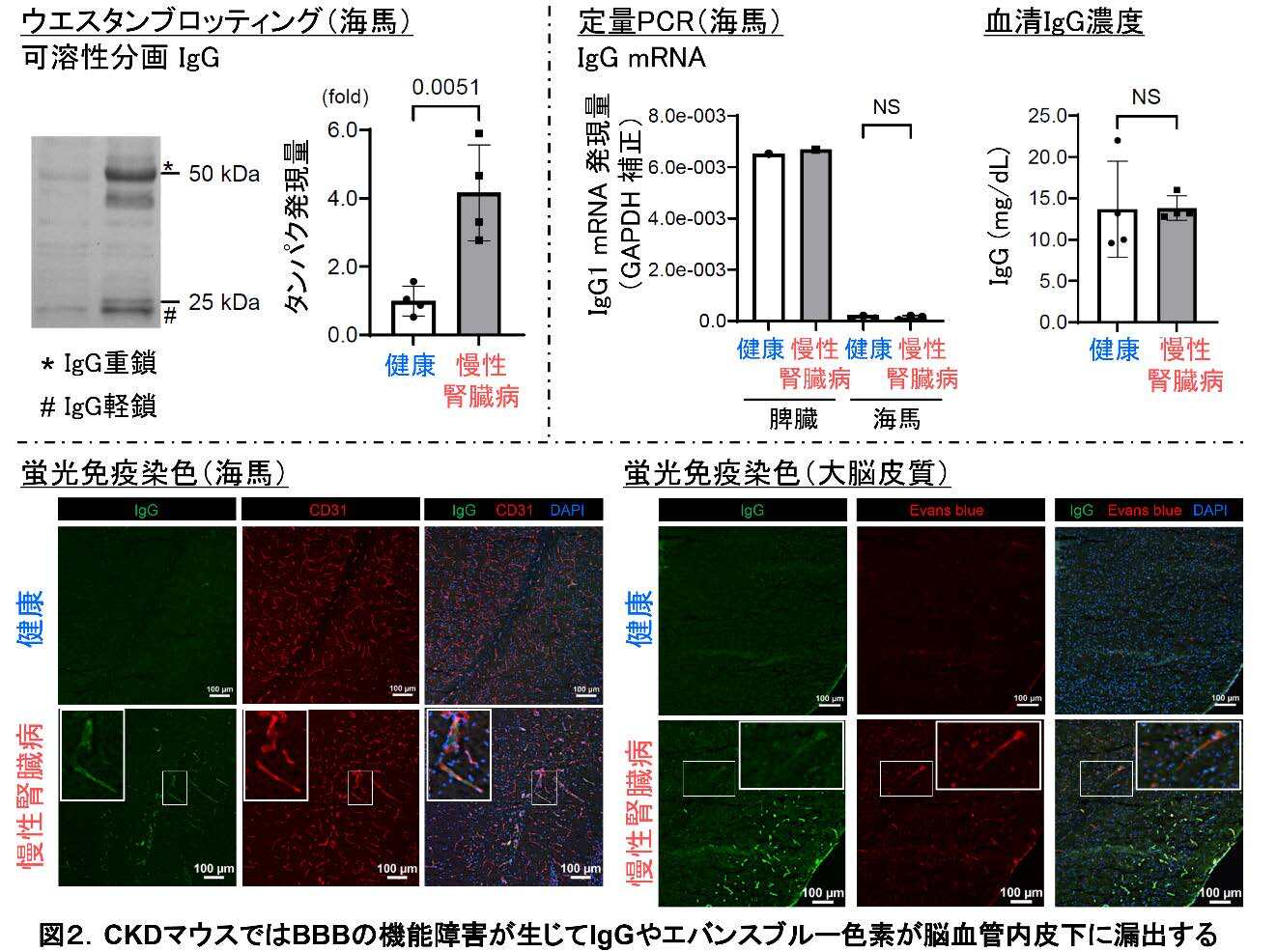
プロテオーム解析のもうひとつ着目すべき所見として、可溶性および不溶性分画ともに、免疫グロブリンの重鎖がCKD マウス群で増加していることが明らかとなりました。これはBBBの機能障害によって、物質の透過性が亢進することを示唆する所見です。ウエスタンブロッティングで免疫グロブリンG(immunoglobulin G、IgG)がCKD脳で増加することが確認できました(図2左上)。脳内で作られるIgGのメッセンジャーRNA発現量に差は無く、血液中のIgG 濃度にも差はなかったことから(図2右上)、IgGは血液中から脳実質に流入することが分かりました。血液を灌流して除いた上で蛍光免疫染色を実施したところ、CKD マウス脳では脳間質の血管内皮細胞下にIgG が沈着しており、外因性に投与したエバンスブルー色素※4とも部分的に一致していました。これらの結果から、CKDを罹患したマウスではBBBの機能障害が起きた結果、IgGやエバンスブルー色素がBBBを超えて脳に漏出したと考えられました(図2下)。
BBBの主な構成細胞の血管内皮細胞は、上皮細胞(組織の表面側にある細胞の総称)とも呼ばれます。上皮細胞は一般的に密着結合(タイトジャンクション, TJ)と接着結合(アドヘレンスジャンクション, AJ)が共同して、互いに細胞の側面を強く接着させてバリアを作ります。BBBでも重要な構造です。蛍光免疫染色を行うと、TJ構成タンパク質であるクローディン5、AJ構成タンパク質であるPECAM-1(CD 31)、基底膜の構成タンパク質である4型コラーゲンの発現量が、いずれもCKDマウスで低下していました。このメカニズムを追究すべく、マウス脳血管内皮細胞(bEnd.3)を使って尿毒症性物質を複数投与しました。すると、尿素の投与によって、用量依存的にクローディン5やCD31のタンパク質発現量が低下しました。クローディン5、CD31、4型コラーゲン などのBBB構成タンパク質群を基質に持つタンパク質分解酵素MMP(matrix metalloproteinase、MMP)※5に着目しました。特に、不溶性プロテオーム解析でもヒットしたMMP2(図1)に着目しました。CKDマウスの血清投与下に培養したbEnd.3 細胞では、ゼラチンザイモグラフィーを行うとMMP2の活性亢進が確認され、蛍光免疫染色では、CKDマウス脳の血管内皮細胞のMMP 2発現量が増加していることが分かりました。bEnd.3 細胞で、尿素投与により低下したクローディン5のタンパク質発現量は、MMP阻害薬投与で改善することも確認されました。これらの結果から、尿素によるMMP2の活性化に伴うBBB構成タンパク質群の分解が、CKDにおけるBBB透過性亢進に関与していることが明らかになりました。
研究成果の意義
本研究は、CKD脳において血液脳関門の機能障害と不溶化タウタンパク質の蓄積といった神経変性疾患と類似の変化が起きていることと、尿素が重要な因子として関与することを明らかにしました。BBBの物質透過性について新たなメカニズムが分かった事は、BBBの機能障害を起こす様々な疾患(アルツハイマー病を始めとした神経変性疾患やてんかんなど)の病態理解や治療開発、逆にBBBを透過しやすい創薬に寄与する可能性があります。
血液中の尿素窒素濃度の上昇は、CKDとCKD状態下のタンパク質の過剰摂取、CKDが無い場合も脱水症などで引き起こされることが多いです。このため、夏季を中心に脱水状態を未然に防ぐことや、CKD患者さんにおけるタンパク質摂取制限、透析患者さんにおける透析効率の強化などが、尿素の血中濃度上昇や体内蓄積を軽減する事ができるため、ひいてはCKDによる血管障害や認知機能低下を予防するひとつの治療法につながる可能性があります。
本研究の知見は、動物実験を中心に得られた知見である点、尿素以外の尿毒症性物質の影響をすべて解析したものではない点が、主な課題点です。尿素は確かにCKD環境下で血清濃度が上昇し、体内に蓄積する物質である一方で、生物の進化の過程で獲得、活用されてきたアンモニアを解毒するための重要な物質です。尿素が毒性を持つのか、それはどの文脈なのか(CKD環境下のみなのか)、再考を促す研究結果も散見されるようになりました。更なる研究によってこの問いの答えを発見することが、将来の診療への応用に繋がると期待されます。
用語解説
※1 慢性腎臓病・・・・・Chronic kidney disease の頭文字からCKD と呼称される。腎臓の働き(eGFR )が健康な人にくらべて約60 %未満(60 mL/分/1.73 m2 未満)に低下した状態、または蛋白尿が出るなどの腎臓の異常が3ヵ月以上継続した状態を指す。CKD を罹患しても自覚症状が生じづらいため、健康診断や病院受診で初めて診断されることも多い。本邦では毎年推計4万人が末期腎不全に至り、新規に透析を開始している。
※2 eGFR・・・・・・・・腎臓には糸球体(しきゅうたい)と呼ばれる毛細血管でできた球形の構造物が100万個ずつ含まれている。eGFRはestimated glomerular filtration rateの略称で、老廃物を1分間にろ過できる量(推算糸球体ろ過量)を指します。eGFRの数値を基準にして、CKDの重症度がステージG1~ステージG5の5段階に分けられる。eGFRの数値が低いほどステージが進み、腎臓の機能が低下していることになる。
※3 プロテオーム解析・・・生物のもつタンパク質(プロテイン)の発現量を網羅的に解析する手法であり、これによって疾患の診断バイオマーカーや創薬対象をみつけるきっかけとなりうる。アルツハイマー病を始めとした神経変性疾患では様々な不溶化タンパクの蓄積が起こることが知られており、タンパク質の抽出方法を工夫して、不溶性分画をプロテオーム解析にかける(sub-proteome)手法も行われている。
※4 エバンスブルー色素・・生体に毒性の少ない色素であり、血中に入ると速やかにアルブミンに結合する。アルブミンと結合した色素は血管内皮を透過することができないが、透過性が亢進すると血管内皮を透過して組織に沈着する。このことを利用して、色素の漏出の程度をBBBなどの血管透過性の指標としている。
※5 MMP・・・・・・・・・Matrix metalloproteinase の頭文字からMMPと呼称される。タンパク質分解酵素であるプロテアーゼの中でも、活性のために金属イオンが必要なメタロプロテアーゼの一群である。コラーゲンなどの細胞外基質の分解など様々な生理活性を持つ。MMPの活性を評価する上で、しばしばゼラチンザイモグラフィーが用いられる。MMP2は全身の組織に発現しており、がん細胞が転移/浸潤する際に必要な酵素でもあるため、抗癌剤の創薬標的として研究開発も行われている。
文献
2) Nakano Y, Mandai S, Genma T, Akagi Y, Fujiki T, Ando F, Susa K, Mori T, Iimori S, Naito S, Sohara E, Uchida S, Fushimi K, Rai T. Nationwide mortality associated with perioperative acute dialysis requirement in major surgeries. Int J Surg. 2022; 104: 106816.
3) Koide T, Mandai S, Kitaoka R, Matsuki H, Chiga M, Yamamoto K, Yoshioka K, Yagi Y, Suzuki S, Fujiki T, Ando F, Mori T, Susa K, Iimori S, Naito S, Sohara E, Rai T, Yokota T, Uchida S. Circulating Extracellular Vesicle-Propagated microRNA Signature as a Vascular Calcification Factor in Chronic Kidney Disease. Circ Res. 2023; 132(4): 415-431.
4) Xu H, Garcia-Ptacek S, Lindholm B, Eriksdotter M, Carrero JJ. Kidney Function, Kidney Function Decline, and the Risk of Dementia in Older Adults: A Registry-Based Study. Neurology. 2021; 96: e2956-65.
5) Nation DA, Sweeney MD, Montagne A, Sagare AP, D'Orazio LM, Pachicano M, Sepehrband F, Nelson AR, Buennagel DP, Harrington MG, Benzinger TLS, Fagan AM, Ringman JM, Schneider LS, Morris JC, Chui HC, Law M, Toga AW, Zlokovic BV. Blood-brain barrier breakdown is an early biomarker of human cognitive dysfunction. Nat Med. 2019; 25: 270–6.
論文情報
掲載誌:Aging (Albany NY)
論文タイトル:Chronic kidney disease causes blood–brain barrier breakdown via urea-activated matrix metalloproteinase-2 and insolubility of tau protein
DOI:https://doi.org/10.18632/aging.205164
研究者プロフィール

萬代 新太郎 (マンダイ シンタロウ) Shintaro Mandai
東京医科歯科大学 大学院医歯学総合研究科
腎臓内科学分野 助教
・研究領域
腎臓 水・電解質輸送 サルコペニア

東京医科歯科大学 大学院医歯学総合研究科
腎臓内科学分野 教授
・研究領域
腎臓 水・電解質輸送

東京医科歯科大学大学院医歯学総合研究科
腎臓内科学分野 大学院生
・研究領域
腎臓 水・電解質輸送
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
腎臓内科学分野 氏名 萬代新太郎(マンダイ シンタロウ)
氏名 内田信一(ウチダ シンイチ)
TEL:03-5803-5214 FAX:03-5803-5215
E-mail:smandai.kid[at]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[at]tmd.ac.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。

