「 NAFLD関連肝がんにおける脂肪毒性への耐性獲得機序の解明 」【田中真二 教授、秋山好光 講師】
― 新規治療標的として有望なKDM6B-G0S2-ATGL経路の同定―

ポイント
- 近年増加している非アルコール性脂肪性肝疾患(NAFLD)関連肝がんにおいて、ヒストン脱メチル化酵素KDM6Bの発現が特異的に低下していることを突き止めました。
- KDM6Bはエピジェネティック機構を介して脂質代謝システムをコントロールしており、がん細胞が脂肪毒性に対する耐性を獲得する新しい分子機序を解明しました。
- KDM6B発現低下による脂肪毒性耐性機序の解明は、NAFLD関連肝がんの病態解明と新規治療法開発への応用が期待できます。
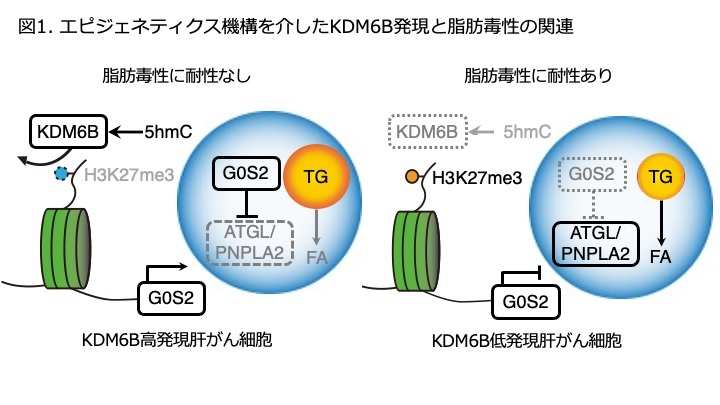
研究の背景
NAFLD関連肝がんでは、ウイルス性肝がんに比べ、ゲノム異常が少ないことが報告されています。また肝がんの発生にはエピゲノム※1異常が関わっていることが知られていますが、ヒストン修飾※2などエピゲノム異常に基づくNAFLD関連肝がんの分子機序は未だに不明です。本研究では、臨床ヒト肝がん検体及びマウスNASH肝がんモデルを用いた遺伝子発現解析により、NAFLD関連肝がんでは特異的にヒストン脱メチル化酵素KDM6Bの発現が低下していることを見出しました。KDM6BはヒストンH3K27部位を脱メチル化することで、下流遺伝子の発現を亢進することが知られています。今回我々はNAFLD関連肝がんにおけるKDM6Bの役割を調べ、NAFLD関連肝がん治療の新しい治療標的を探索しました。
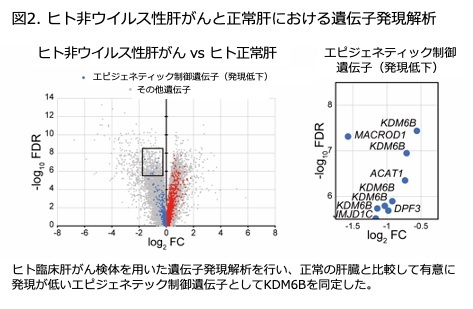
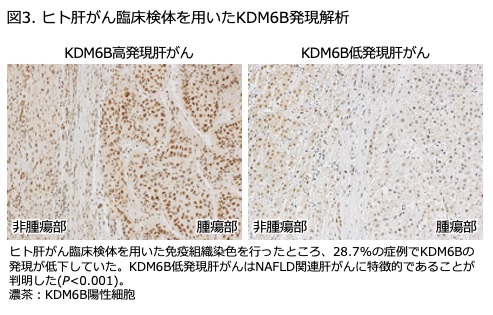
研究成果の概要
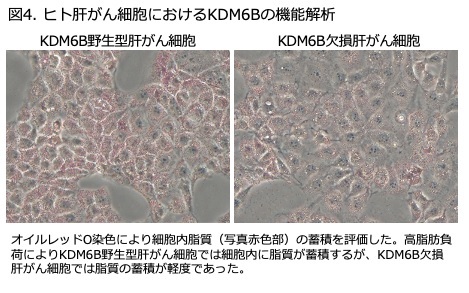
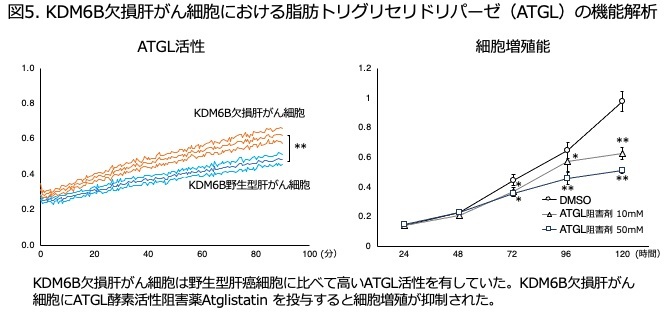
研究成果の意義
用語解説
※1エピゲノム機構
エピゲノム(エピジェネティクス)機構はDNA塩基配列の変化を伴わない遺伝子発現制御の仕組みであり、DNAメチル化、ヒストン修飾およびクロマチン再構築の3つが柱となっている。
※2ヒストン修飾
ヒストンはクロマチンの基本単位であるヌクレオソームを構成する塩基性タンパク質である。ヒストンのN末端とC末端側にはヒストンテールが存在し、その部分のリジン残基(K)にメチル化やアセチル化修飾が起こると遺伝子発現が活性化または不活性化する。H3K27(ヒストンH3の27番目のリジン)に3個のメチル基がつくことをH3K27me3と呼ぶ。KDM6Bは脱メチル化酵素であり、メチル基を取り除く作用を持っている。この修飾は遺伝子発現活性化に働く。
※35hmC
DNAエピゲノム修飾の一種。5-hydroxymethylcytosine (5-ヒドロキシメチルシトシン)はメチル化されたシトシンのメチル基が除去される過程で生成されるシトシン修飾体の1つであり、遺伝子発現の活性化に働く。5hmCは加齢、ストレス、代謝異常などの環境要因や多くのがんで変化が認められる代表的なDNA脱メチル化の指標である。
論文情報
掲載誌:Hepatology Communications
論文タイトル: Loss of KDM6B epigenetically confers resistance to lipotoxicity in nonalcoholic fatty liver disease-related hepatocellular carcinoma
DOI:https://doi.org/10.1097/HC9.0000000000000277
研究者プロフィール
田中 真二(タナカ シンジ) Tanaka Shinji
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 教授
・研究領域
分子腫瘍医学、消化器外科学
波多野 恵 (ハタノ メグミ) Hatano Megumi
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 助教
・研究領域
分子腫瘍医学、内分泌代謝学
秋山好光 (アキヤマ ヨシミツ) Akiyama Yoshimitsu
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 講師
・研究領域
分子腫瘍医学、癌エピジェネティクス
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子腫瘍医学分野
田中 真二(タナカ シンジ)
秋山 好光(アキヤマ ヨシミツ)
E-mail: tanaka.monc[at]tmd.ac.jp
yakiyama.monc[at]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[at]tmd.ac.jp
※E-mailは上記アドレス[at]の部分を@に変えてください。

