「PARK22 遺伝子変異によるパーキンソン病の発症メカニズムの解明」【清水重臣 教授、鳥居 暁 プロジェクト准教授】

清水 重臣(しみず しげおみ)難治疾患研究所 病態細胞生物学分野 教授(左)
鳥居 暁(とりい さとる)難治疾患研究所 病態細胞生物学分野 プロジェクト准教授(右)
国立大学法人東京医科歯科大学
学校法人順天堂 順天堂大学
― 異常なα-シヌクレインのリン酸化を誘導する新たな経路 ―

ポイント
- パーキンソン病※1は中脳黒質のドーパミン作動性ニューロンの消失に起因する神経変性疾患※2です。
- 今回、PARK22/CHCHD2 ※3変異によるパーキンソン病発症メカニズムを明らかにしました。
- この制御にはカゼインキナーゼ1(CK1)※4によるα-シヌクレイン※5のリン酸化が関わっており、カゼインキナーゼ1の阻害剤によって病態が改善されることを見いだしました。
研究の背景
研究成果の概要
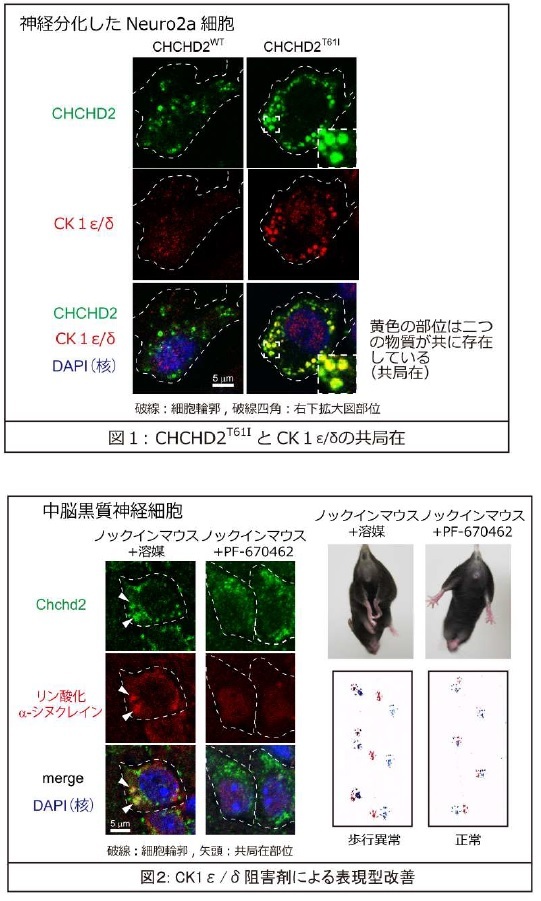
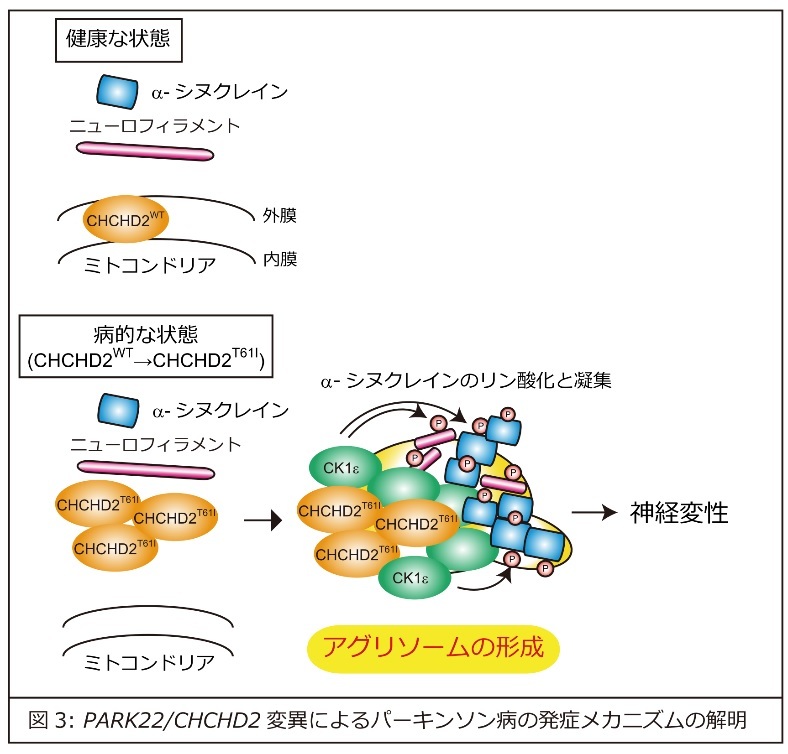
研究成果の意義
用語解説
※1 パーキンソン病
振戦、無動、筋固縮、姿勢反射障害などの運動機能障害を起こす神経変異疾患です。原因として中脳黒質緻密部のドーパミン作動性ニューロンの脱落があることがわかっています。患者の約10%が家族性の遺伝子変異により発症することが知られており、残りは孤発性で発症原因はわかっていません。
※2神経変性疾患
遺伝子変異や、種々の環境要因により脳や脊髄の神経細胞が変性(神経細胞死)し、徐々に失われることで認知症や運動機能障害などを引き起こす病気です。アルツハイマー病やパーキンソン病、ハンチントン病などが知られています。
※3 PARK22/CHCHD2
coiled-coil-helix-coiled-coil-helix domain containing 2。CHCHD2タンパク質はN末端側にミトコンドリア移行シグナル、C末端側にCHCHドメインを持ち、ミトコンドリアの内膜と外膜の間の内腔に局在します。
※4カゼインキナーゼ1
真核生物が持つセリン・スレオニンキナーゼファミリー分子です。ある特定のタンパク質のセリンもしくはスレオニンにリン酸基を付与する酵素です。いくつかの類似した機能を持つアイソフォームが存在し、シグナル伝達、概日リズム、転写因子の核細胞質間移行などに関与します。
※5α-シヌクレイン
SNCA(PARK1/4)によってコードされるタンパク質で、その変異や遺伝子重複によって家族性パーキンソン病を発症させることが知られています。孤発性パーキンソン病やLewy小体型認知症にも関与し、患者の神経細胞内に見られるLewy小体や細胞内封入体の主要成分はリン酸化され異常蓄積したα-シヌクレインであることがわかっています。
※6アグリソーム
老化や神経変性疾患で蓄積することが知られている変性タンパク質の凝集体です。βシートを持つ繊維構造(フィブリル)を内包しています。
論文情報
論文タイトル:Involvement of casein kinase 1 epsilon/delta (Csnk1e/d) in the pathogenesis of familial Parkinson’s disease caused by CHCHD2
DOI:https://doi.org/10.15252/emmm.202317451
研究者プロフィール

東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 プロジェクト准教授
・研究領域
オートファジー
細胞死
シグナル伝達

順天堂大学大学院 医学研究科 神経学
先任准教授
・研究領域
パーキンソン病
神経内科一般

順天堂大学大学院 医学研究科 神経学
教授
・研究領域
パーキンソン病
神経内科一般

東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 教授
・研究領域
オートファジー
細胞死
オルガネラ・バイオロジー
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所 病態細胞生物学分野
清水 重臣(シミズ シゲオミ)
E-mail:shimizu.pcb[@]mri.tmd.ac.jp
鳥居 暁(トリイ サトル)
E-mail:toripcb[@]tmd.ac.jp
順天堂大学大学院医学研究科 神経学
TEL:03-3813-3111(代表)
服部 信孝
佐藤 栄人
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
順天堂大学 総務局 総務部 文書・広報課
〒113-8510 東京都文京区本郷2-1-1
TEL:03-5802-1006
E-mail: pr[@]juntendo.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

