「 脂肪酸代謝を介した脳の修復メカニズムを発見 」【七田 崇 教授】

七田 崇(しちた たかし) 難治疾患研究所 神経炎症修復学分野 教授
公開日:2023.7.25
国立大学法人東京医科歯科大学
公益財団法人東京都医学総合研究所
国立大学法人東京医科歯科大学
公益財団法人東京都医学総合研究所
「 脂肪酸代謝を介した脳の修復メカニズムを発見 」
― 脂質を投与することにより脳梗塞後の神経症状が改善 ―
― 脂質を投与することにより脳梗塞後の神経症状が改善 ―

ポイント
- 脳梗塞後の脳内において、脂肪酸の一種ジホモ-ガンマ-リノレン酸(DGLA)およびその代謝物15-HETrEの量が増えていました。
- DGLAや15-HETrEには、シトルリン化酵素PADI4を神経細胞に発現させる働きがありました。
- PADI4がヒストンタンパク質をシトルリン化することにより、神経の修復で働く遺伝子の発現を開始させることがわかりました。
- DGLAや15-HETrEを脳梗塞モデルマウスに投与すると神経症状が改善したことから、脳卒中の新規治療法開発への応用が期待できます。
東京医科歯科大学 難治疾患研究所 神経炎症修復学分野の中村 朱里大学院生、酒井 誠一郎助教、七田 崇教授らと、東京大学大学院医学系研究科の村上誠教授らの研究グループは、東京都医学総合研究所、慶應義塾大学との共同研究で、脳梗塞後に産生される脂肪酸代謝物が脳梗塞巣周辺部に生き残った神経細胞に作用してシトルリン化酵素PADI4の発現を誘導し、PADI4によるヒストンタンパク質がシトルリン化されることによって神経修復で働く遺伝子の発現が増加する新たな神経修復メカニズムを発見しました(図1)。また、PADI4の発現を誘導する神経修復性の脂質を脳梗塞モデルマウスに投与すると、脳梗塞後の神経症状が改善されることを示しました。この研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業AMED-CREST「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」およびAMED-PRIME「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」、文部科学省科学研究費補助金、東レ科学振興会、武田科学振興財団、上原記念生命科学財団、MSD生命科学財団、千里ライフサイエンス振興財団、小野医学研究財団の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Neuronに、2023年7月24日にオンライン版で発表されました。
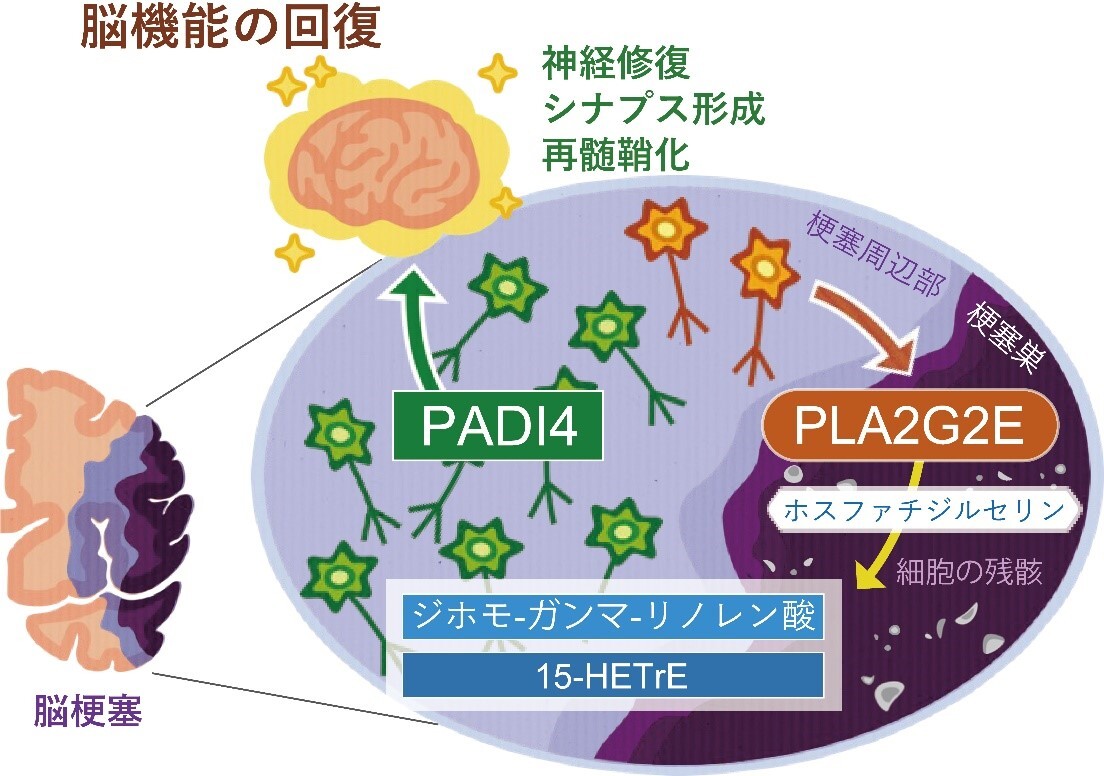
図1:脂肪酸代謝物によって神経修復が誘導されるメカニズム
研究の背景
脳卒中は、脳の血管が詰まって脳組織が壊死する脳梗塞と、脳の血管が破れて出血する脳出血に分けられますが、いずれも発症すると神経細胞がダメージを受けて、手足を上手く動かせなくなったり、感覚が鈍くなったり、上手く話せなくなったりするなど様々な脳の機能に障害が生じます。脳卒中によって失われた脳の機能はリハビリテーションによってある程度回復しますが、このとき脳の中ではシナプスが新たに作られるなどして、失われた脳の機能を代償するための神経修復が起こっていると考えられています。このように、傷ついた脳は自ら修復する能力を持っていますが、脳卒中で生き残った神経細胞がどのようなメカニズムでこのような修復能力を獲得するのかはわかっていませんでした。
組織の損傷によって死んだ細胞からは細胞内のタンパク質などが放出され、それらが免疫細胞に作用することで炎症が起こります。脳卒中においても、死んだ神経細胞から放出された細胞内の物質が炎症を引き起こし、脳に更なるダメージを与えることがわかっています。これら炎症を引き起こす物質が脳内から取り除かれることで炎症が収束し、神経の修復へと移行します。また、組織損傷後に産生される様々な脂質が炎症の制御に関わっていることが知られており、炎症を促進する脂質や炎症を抑制する脂質がこれまでに報告されています。本研究では、脳損傷後の神経修復において脳内の脂質が重要な役割を担っているのではないかと考え、神経修復の引き金となる脂質を探索し、脂質代謝を介した神経修復のメカニズムを調べました。
組織の損傷によって死んだ細胞からは細胞内のタンパク質などが放出され、それらが免疫細胞に作用することで炎症が起こります。脳卒中においても、死んだ神経細胞から放出された細胞内の物質が炎症を引き起こし、脳に更なるダメージを与えることがわかっています。これら炎症を引き起こす物質が脳内から取り除かれることで炎症が収束し、神経の修復へと移行します。また、組織損傷後に産生される様々な脂質が炎症の制御に関わっていることが知られており、炎症を促進する脂質や炎症を抑制する脂質がこれまでに報告されています。本研究では、脳損傷後の神経修復において脳内の脂質が重要な役割を担っているのではないかと考え、神経修復の引き金となる脂質を探索し、脂質代謝を介した神経修復のメカニズムを調べました。
研究成果の概要
本研究では、脳梗塞モデルマウス※1を用いて、脳梗塞発症から1週間後までの脳内にどのような脂質が存在するかをまず解析しました。脳梗塞巣周辺部の組織から脂質を抽出し、質量分析法※2により脂質の種類と量を調べた結果、脳梗塞発症3日から6日後に不飽和脂肪酸※3の量が増加していました。そこで、細胞膜を構成するリン脂質から不飽和脂肪酸を切り出す酵素ホスホリパーゼA2(PLA2)を欠損するマウスにおいて、脳梗塞の症状が変化しているかマウスの行動評価と脳組織の染色により調べました。数種類のPLA2欠損マウスを用いて検討した結果、PLA2G2Eを欠損するマウスでのみ、脳梗塞後の神経症状の悪化と脳梗塞体積の増加が見られました(図2)。また、野生型マウスとPLA2G2Eを欠損マウスで脳梗塞巣周辺部の遺伝子発現を比較したところ、PLA2G2E欠損マウスでは神経修復で働く遺伝子の発現量が低下していましたが、特にシトルリン化酵素PADI4※4の発現が顕著に低下していました。脳梗塞モデルマウスおよびヒト脳梗塞患者におけるPLA2G2EとPADI4の発現を免疫組織染色によって調べたところ、脳梗塞発症3日から1週間後に脳梗塞巣周辺部に生き残っていた神経細胞でPLA2G2EおよびPADI4の発現が見られました。PLA2G2Eは細胞外に放出されて働く酵素であり、脳梗塞巣周辺部の神経細胞からPLA2G2Eが放出されて、死んだ神経細胞の細胞膜残骸から不飽和脂肪酸を産生していると考えられます。
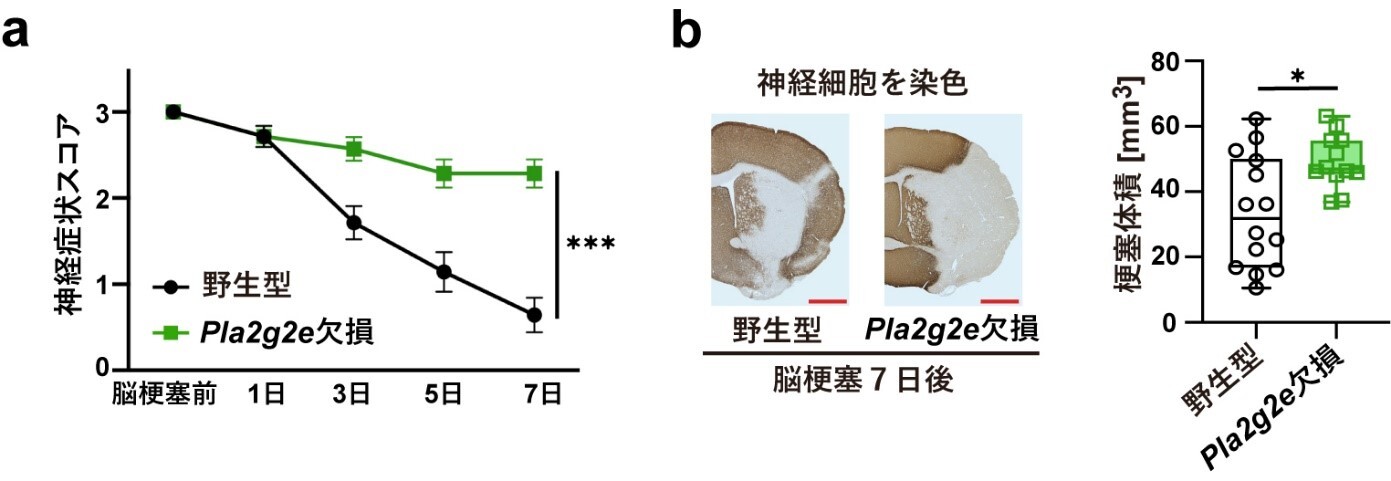
図2:PLA2G2E欠損マウスにおける脳梗塞後の神経症状の悪化
次に、神経細胞で特異的にPADI4を欠損するマウスを用いて脳梗塞の症状を調べたところ、PADI4欠損マウスでは野生型マウスと比較して脳梗塞による神経細胞死が増えており、脳梗塞後の神経症状の悪化と脳梗塞体積の増加が見られました。また、脳梗塞周辺部から神経細胞を単離して、次世代シークエンス解析※5によって単一細胞レベルで遺伝子発現を調べた結果、脳梗塞発症4日後の野生型マウスでは神経修復で働く遺伝子の発現量が神経細胞で全体的に増加していましたが、神経細胞特異的にPADI4を欠損したマウスでは神経修復で働く遺伝子の発現量があまり見られませんでした(図3)。ゲノムDNAはヒストンタンパク質※6に巻き付いたクロマチン構造としてコンパクトに核内に収納されていますが、PADI4がヒストンタンパク質をシトルリン化することによってクロマチンの構造が緩んで遺伝子の転写が活性化されることが他の幹細胞研究などで報告されています。そこで、脳梗塞後の神経細胞における修復性の遺伝発現変化もPADI4によるヒストンのシトルリン化が寄与しているのではないかと考え、ゲノムDNAのどの領域に結合しているヒストンがシトルリン化されているか次世代シークエンス解析によって調べました。その結果、神経修復で働く遺伝子の転写調節領域※7にあるヒストンがPADI4によってシトルリン化されており、遺伝子の発現が活性化していることがわかりました。
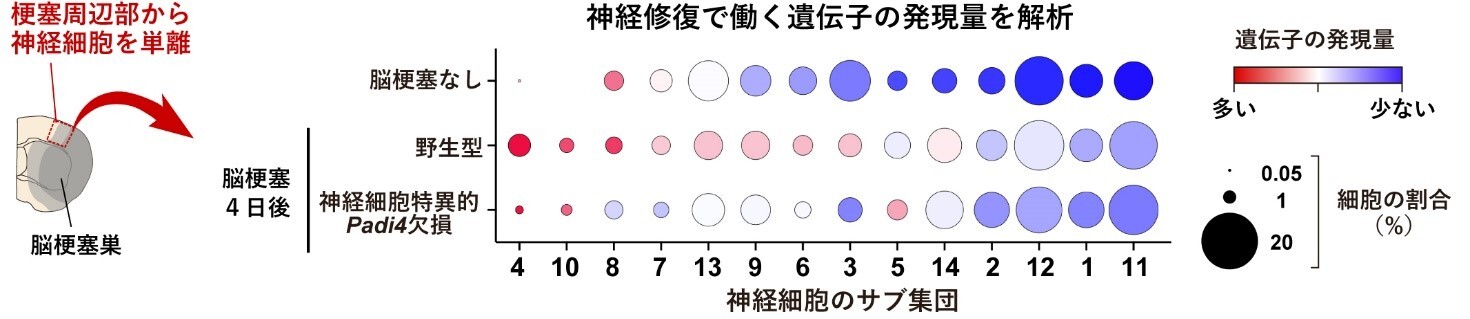
図3:神経細胞におけるPADI4依存的な修復遺伝子の発現
脳梗塞後に増加していた不飽和脂肪酸のうちジホモ-ガンマ-リノレン酸(DGLA)の量がPLA2G2E欠損マウスで低下していたので、PADI4を介した脳梗塞後の神経修復メカニズムにDGLAが関与しているのではないかと考えました。そこで、脳梗塞を作製したPLA2G2E欠損マウスにDGLAを経口投与したところ、脳梗塞巣周辺部の神経細胞でPADI4の発現が増加し、脳梗塞後の神経症状の改善と脳梗塞体積の減少が見られました。また、培養神経芽腫細胞※8の培地に様々な脂肪酸代謝物を添加してPADI4の発現量が変化するか調べたところ、DGLA代謝物の一つ15-HETrE (15-hydroxy eicosatrienoic acid)の添加によってPADI4の発現量が大きく増加しました。15-HETrEを脳梗塞モデルマウスに投与すると、脳梗塞巣周辺部の神経細胞でPADI4および神経修復で働く遺伝子の発現が増加し、脳梗塞後の神経症状の改善と脳梗塞体積の減少が見られました。以上の結果から、DGLAおよびその代謝物である15-HETrEにはPADI4を介した神経修復を促進する働きがあることがわかりました。
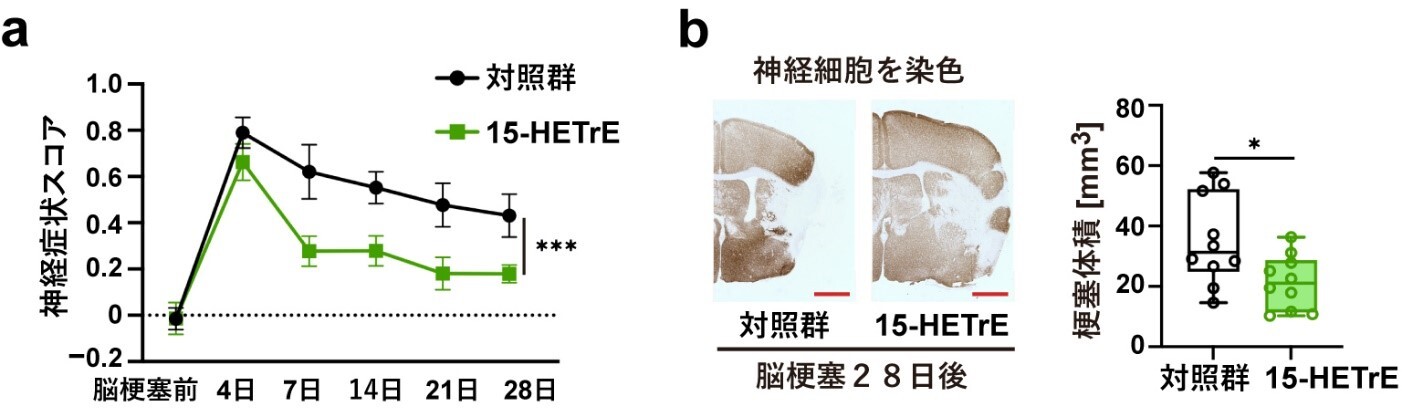
図4:15-HETrE投与による脳梗塞後の神経症状の改善
研究成果の意義
脳損傷後に神経の修復が起こって脳機能がある程度回復することは知られていましたが、どのような分子メカニズムで神経の修復が開始されるのかはこれまでわかっておりませんでした。本研究では、脳梗塞後の産生される脂肪酸代謝物が神経修復の引き金となり、PADI4によるヒストンのシトルリン化を介して神経修復で働く遺伝子の発現が誘導される神経修復の新たなメカニズムを発見しました。本研究により、組織損傷後における脂質の機能として炎症の制御に加えて、神経の修復においても脳内の脂質が重要な役割を担っていることが初めて示されました。神経細胞にPADI4の発現を誘導させる修復性の脂質であるDGLAや15-HETrEには、神経修復を促進して脳梗塞後の神経症状を改善させる働きがありました。これら脂質は食事による摂取が可能であり、修復性の脂質を食事で摂取することで脳卒中後の機能予後を向上させる新たな治療法に応用されることが期待されます。
用語解説
※1脳梗塞モデルマウス・・・・・・・・脳の血流を人為的に止めて脳梗塞を作製したマウス。本研究では、大脳を走る大きな血管である中大脳動脈を一時的に閉塞させたモデルマウスを主に使用した。
※2質量分析法・・・・・・・・検査対象となる物質をイオン化させて電圧をかけた空間中を飛ばし、検出器に到達するまでの時間から質量を測る(質量の大きな物質ほど到達までの時間がかかる)。脂質の種類によって質量が異なるので、質量分析法により脂質の種類と量を調べることができる。
※3不飽和脂肪酸・・・・・・・・炭素が複数連なって結合した炭素鎖の中に二重結合をもつ脂肪酸の総称。PLA2によって細胞膜のリン脂質から切り出されることによって遊離し、様々な生理活性を示す。リノレン酸、アラキドン酸、ドコサヘキサエン酸(DHA)などが不飽和脂肪酸としてよく知られている。
※4シトルリン化・・・・・・・・シトルリン化酵素PAD(PADI)によってタンパク質中のアルギニン残基がシトルリンに変換される反応。ヒストンタンパク質のシトルリン化は遺伝子発現の制御や白血球の免疫反応に関わっていることが知られている。他にも、関節に存在するタンパク質がシトルリン化されることがリウマチの原因となっているが知られている。
※5次世代シークエンス解析・・・・・・・・数千万~数十億本のDNA断片の塩基配列を一度に読むことができる技術で、遺伝子発現やゲノムDNAの情報を網羅的に調べることが可能である。本研究では、遺伝子の転写産物であるRNAの配列を読んで遺伝子発現を網羅的に調べるRNA-Seq、単一細胞レベルで遺伝子発現を調べるシングルセルRNA-Seq、クロマチン構造が緩んで転写が活性化しているゲノム領域を調べるATAC-Seq、ヒストンの修飾がされている領域を調べるCut&Tagといった解析を行った。
※6ヒストン・・・・・・・・核内でDNAを巻き付けているタンパク質で、DNAが巻き付いた構造をクロマチン構造と呼ぶ。クロマチンは凝集してコンパクトにゲノムDNAを収納しているが、転写が活性化している領域ではクロマチンが緩んでいる。ヒストンタンパク質のアミノ酸残基がメチル化、アセチル化、シトルリン化などの修飾を受けてクロマチンの構造が変化することにより遺伝子の発現が制御されている。
※7転写調節領域・・・・・・・・遺伝子の転写を制御している領域のことで、遺伝子のすぐ近傍にあるプロモーターや少し離れた場所にあるエンハンサーといた領域がある。活性化している転写調節領域では、クロマチンの構造が緩んで、転写調節を担う様々なタンパク質(転写調節因子)がDNAに結合している。
※8培養神経芽腫細胞・・・・・・・・マウスの神経芽細胞腫から確立されたNeuro2a細胞。神経細胞に近い性質を持っており、培養や遺伝子導入が容易なので、神経細胞の代わりとして薬剤の効果を検証する実験などに用いられる。
※2質量分析法・・・・・・・・検査対象となる物質をイオン化させて電圧をかけた空間中を飛ばし、検出器に到達するまでの時間から質量を測る(質量の大きな物質ほど到達までの時間がかかる)。脂質の種類によって質量が異なるので、質量分析法により脂質の種類と量を調べることができる。
※3不飽和脂肪酸・・・・・・・・炭素が複数連なって結合した炭素鎖の中に二重結合をもつ脂肪酸の総称。PLA2によって細胞膜のリン脂質から切り出されることによって遊離し、様々な生理活性を示す。リノレン酸、アラキドン酸、ドコサヘキサエン酸(DHA)などが不飽和脂肪酸としてよく知られている。
※4シトルリン化・・・・・・・・シトルリン化酵素PAD(PADI)によってタンパク質中のアルギニン残基がシトルリンに変換される反応。ヒストンタンパク質のシトルリン化は遺伝子発現の制御や白血球の免疫反応に関わっていることが知られている。他にも、関節に存在するタンパク質がシトルリン化されることがリウマチの原因となっているが知られている。
※5次世代シークエンス解析・・・・・・・・数千万~数十億本のDNA断片の塩基配列を一度に読むことができる技術で、遺伝子発現やゲノムDNAの情報を網羅的に調べることが可能である。本研究では、遺伝子の転写産物であるRNAの配列を読んで遺伝子発現を網羅的に調べるRNA-Seq、単一細胞レベルで遺伝子発現を調べるシングルセルRNA-Seq、クロマチン構造が緩んで転写が活性化しているゲノム領域を調べるATAC-Seq、ヒストンの修飾がされている領域を調べるCut&Tagといった解析を行った。
※6ヒストン・・・・・・・・核内でDNAを巻き付けているタンパク質で、DNAが巻き付いた構造をクロマチン構造と呼ぶ。クロマチンは凝集してコンパクトにゲノムDNAを収納しているが、転写が活性化している領域ではクロマチンが緩んでいる。ヒストンタンパク質のアミノ酸残基がメチル化、アセチル化、シトルリン化などの修飾を受けてクロマチンの構造が変化することにより遺伝子の発現が制御されている。
※7転写調節領域・・・・・・・・遺伝子の転写を制御している領域のことで、遺伝子のすぐ近傍にあるプロモーターや少し離れた場所にあるエンハンサーといた領域がある。活性化している転写調節領域では、クロマチンの構造が緩んで、転写調節を担う様々なタンパク質(転写調節因子)がDNAに結合している。
※8培養神経芽腫細胞・・・・・・・・マウスの神経芽細胞腫から確立されたNeuro2a細胞。神経細胞に近い性質を持っており、培養や遺伝子導入が容易なので、神経細胞の代わりとして薬剤の効果を検証する実験などに用いられる。
論文情報
掲載誌:Neuron
論文タイトル:PLA2G2E-mediated lipid metabolism triggers brain-autonomous neural repair after ischemic stroke
DOI:https://doi.org/10.1016/j.neuron.2023.06.024
論文タイトル:PLA2G2E-mediated lipid metabolism triggers brain-autonomous neural repair after ischemic stroke
DOI:https://doi.org/10.1016/j.neuron.2023.06.024
研究者プロフィール
中村 朱里 (ナカムラ アカリ) Nakamura Akari
東京医科歯科大学 大学院医歯学総合研究科
都医学研疾患分子生物学分野 大学院生
・研究領域
神経科学、生化学、分子細胞生物学
酒井 誠一郎 (サカイ セイイチロウ) Sakai Seiichiro
東京医科歯科大学 難治疾患研究所
神経炎症修復学分野 助教
・研究領域
神経科学、生理学、分子細胞生物学
東京医科歯科大学 大学院医歯学総合研究科
都医学研疾患分子生物学分野 大学院生
・研究領域
神経科学、生化学、分子細胞生物学
酒井 誠一郎 (サカイ セイイチロウ) Sakai Seiichiro
東京医科歯科大学 難治疾患研究所
神経炎症修復学分野 助教
・研究領域
神経科学、生理学、分子細胞生物学

七田 崇 (シチタ タカシ) Shichita Takashi
東京医科歯科大学 難治疾患研究所
神経炎症修復学分野 教授
・研究領域
免疫学、神経科学、脳卒中学
東京医科歯科大学 難治疾患研究所
神経炎症修復学分野 教授
・研究領域
免疫学、神経科学、脳卒中学
村上 誠(ムラカミ マコト) Murakami Makoto
東京大学大学院医学系研究科 疾患生命工学センター
健康環境医工学部門 教授
・研究領域
脂質生物学、生化学
東京大学大学院医学系研究科 疾患生命工学センター
健康環境医工学部門 教授
・研究領域
脂質生物学、生化学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
神経炎症修復学分野 七田 崇 (シチタ タカシ)
E-mail:shichita-tk[@]cmn.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
東京都医学総合研究所 事務局研究推進課
〒156-8506 東京都世田谷区上北沢2-1-6
E-mail: koho[@]igakuken.or.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

