「 オートファジー活性測定が可能な蛍光試薬の開発 」【清水重臣 教授】
― オートファジーやGOMEDの進行度を可視化できる新手法の開発 ―

ポイント
- オートファジーやGOMED※1進行度を可視化・評価できる実験系を新規開発しました。
- 開発した試薬を用い、生きたままゼブラフィッシュ※2生体内のオートファジーを可視化できました。
研究の背景
オートファジーやGOMEDが進行する時、その初期から中期において、分解対象を隔離膜とよばれる膜で包み込こんで隔離します(図A上段)。その後、後期にかけて、この隔離された構造体(オートファゴソーム)とリソソームが融合して、分解対象物がリソソーム酵素によって分解されます。オートファジーやGOMEDの多寡を評価するためには、進行過程の各ステップを定量的に評価することが必要であり、オートファジーに関しては、LC3※3と呼ばれる分子を蛍光で可視化して、その動態観察により解析を行うことができます。ただし、この解析のためには遺伝子操作が必要であり、生体での研究は困難でした。また、GOMEDに関しては、これまで適切な評価法がありませんでした。そこで我々は、遺伝子導入を必要とせずに、オートファジーやGOMEDの多寡を評価できる測定法の構築を目指しました。
研究成果の概要
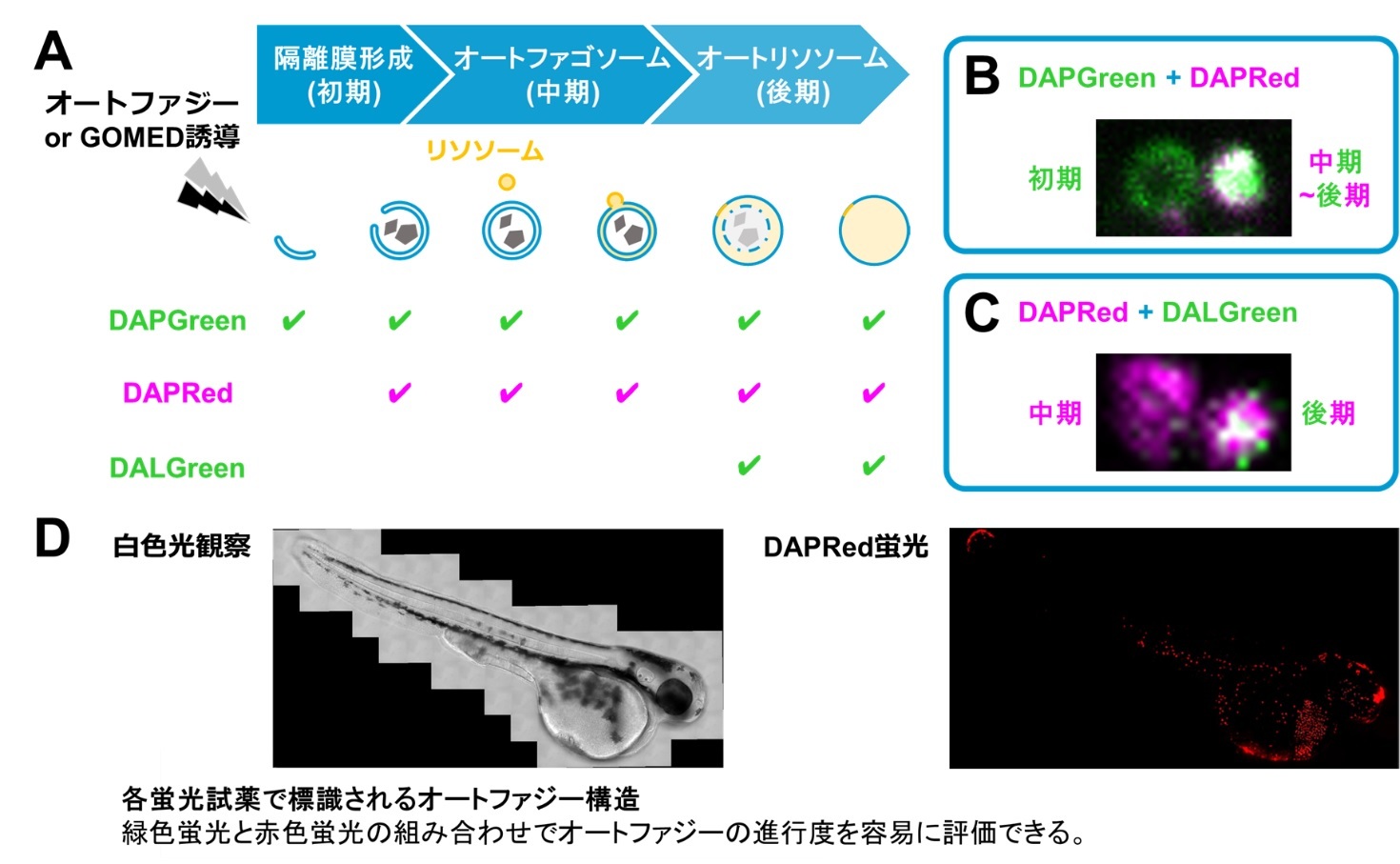
研究成果の意義
用語解説
オートファジーが主に細胞質成分を分解するのに対し、GOMEDは分泌タンパク質や細胞膜局在タンパク質の分解に関わる。
※2ゼブラフィッシュ
脊椎動物のモデル動物。稚魚時には全身が透明なために容易に生きたまま隅々までの観察ができる。
※3LC3
オートファジーの鍵分子。オートファジー進行に伴ってタンパク質形状や特性が変化するため、オートファジー進行度を評価するためによく用いられる。
論文情報
掲載誌:iScience
論文タイトル:Development of small fluorescent probes for the analysis of autophagy kinetics
研究者プロフィール

桜井 一 (サクライ ハジメ) Sakurai Hajime
東京医科歯科大学 難治疾患研究所
病態細胞生物分野 プロジェクト助教 (研究当時)
(現職:兵庫県立大学 理学研究科
生体物質化学Ⅱ分野 助教)
・研究領域
オートファジー、細胞生物学

岩下 秀文 (イワシタ ヒデフミ) Iwashita Hidefumi
株式会社同仁化学研究所
開発部主任
(現職:福岡大学 理学部 化学科
生物有機化学研究室 助教)
・研究領域
ケミカルバイオロジー、生物有機化学

株式会社同仁化学研究所
取締役 試薬開発本部長
・研究領域
オートファジー、細胞生物学

清水重臣 (シミズ シゲオミ) Shimizu Shigeomi
東京医科歯科大学 難治疾患研究所
病態細胞生物分野 教授
・研究領域
オルガネラバイオロジー、細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 教授 清水 重臣 (シミズ シゲオミ)
E-ail:shimizu.pcb[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

