最前線で胃を守れ ~胃粘膜を保護する幹細胞分化制御のしくみを解明~
国立大学法人東京医科歯科大学
国立研究開発法人理化学研究所
概要
今回の研究では、理化学研究所が開発した世界最高精度の1細胞RNAシーケンス法「Quartz-Seq2」[2]を用いてマウスの胃を構成する様々な細胞の遺伝子の発現を1細胞レベルで精密に解析しました。この遺伝子発現解析データを用いることで、胃の幹細胞が分化する過程で活性化するシグナル伝達[3]経路が予測可能になりました。さらに3次元培養した胃の幹細胞に予測されたシグナル経路の促進剤や阻害剤を添加して検証することで、胃が正常な働きを保つ恒常性維持のしくみの一部を解明することに成功しました。本研究成果は、幹細胞制御機構の破綻によって生じる胃がんやその前がん病変である化生[4]の発生メカニズムの理解にもつながると期待されます。
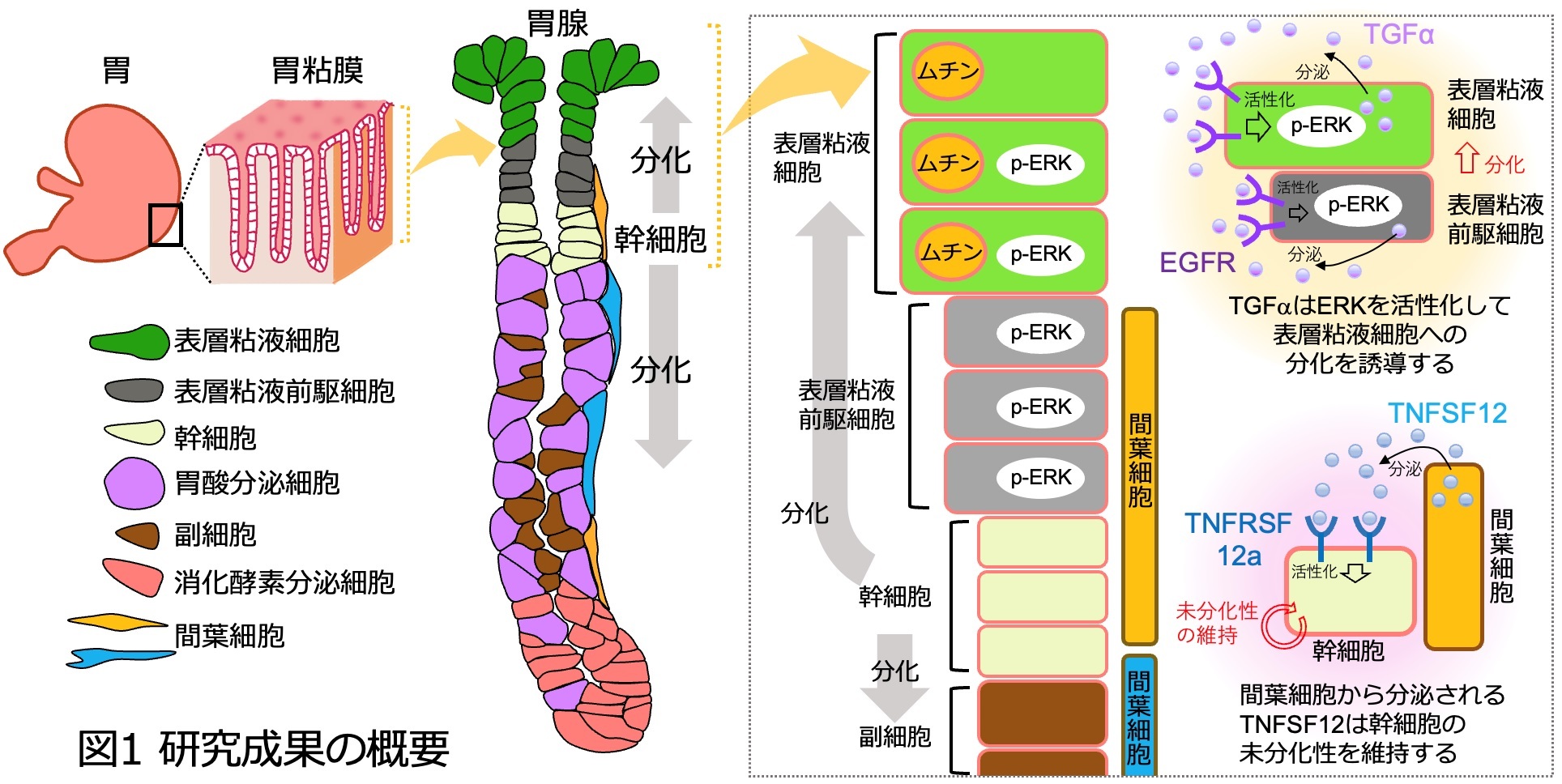
胃袋の表面は胃腺という大量の分泌腺で覆われており、そこには食物を分解する酵素や胃酸を分泌する細胞が存在します。胃腺の出口付近は、胃酸をさえぎるベールのような胃粘液を分泌する表層粘液細胞で覆われているものの、これらの細胞は数日間の短いサイクルで次々と新たな細胞に置き換わっています。胃粘膜の最前線で働く表層粘液細胞は、外界からのストレスにさらされるため、細胞を常に新しくすることで健康な胃粘膜を保っていると考えられます。この活発な新陳代謝を支えるのが胃腺に存在する幹細胞です。幹細胞は分裂して自分と同じ幹細胞を複製(自己複製)するとともに、表層粘液細胞へと分化する能力を持っていますが、そのメカニズムについては、未解明な点が多く残されていました。
今回私たちは、成体マウスの胃腺を構成する細胞をバラバラにし、1細胞RNAシーケンス法Quartz-Seq2により得られた遺伝子発現データを用いて、幹細胞から表層粘液細胞への分化に伴って発現が変動する遺伝子を同定するとともに、幹細胞の分化を制御するシグナル伝達経路を予測しました。さらに、幹細胞を3次元培養した胃上皮オルガノイド[5]を用いて、予測した分化制御シグナルを増強したり、阻害したりする実験を繰り返して幹細胞の分化状態を検証しました。その結果、細胞増殖因子(タンパク質)であるEGFファミリーの一種、TGFα[6]シグナルが幹細胞から表層粘液細胞への分化を促進すること、その一方でサイトカインの一種であるTNFSF12[7]シグナルが幹細胞の未分化状態を維持することを突き止めました(図1)。今回の研究で明らかにした、正常胃組織の幹細胞を制御するしくみは、様々な胃疾患を解析する上で重要なリファレンスとなるものであり、今後の胃疾患研究の発展と治療法開発につながる可能性があります。
<掲載論文>
タイトル: Single-cell transcriptomics uncovers EGFR signaling-mediated gastric progenitor cell differentiation in stomach homeostasis
著者: 高田仁実1,*、笹川洋平2,3,*、芳村美佳2、田中かおり2、岩山佳美2,3、林哲太郎2、的場綾子2、二階堂愛2,3,4,#、栗崎晃1,#
1: 奈良先端科学技術大学院大学 先端科学技術研究科 幹細胞工学研究室
2: 理化学研究所 生命機能科学研究センター バイオインフォマティクス研究開発チーム
3: 東京医科歯科大学 難治疾患研究所 ゲノム機能情報分野
4: 筑波大学
*共筆頭著者
#責任著者
掲載誌: Nature Communications 14, 3750 (2023)
DOI: https://dx.doi.org/10.1038/s41467-023-39113-0
背景
一方、胃の幹細胞の分化異常は胃疾患の発症と密接に関係しています。例えばピロリ菌感染によって誘導される萎縮性胃炎では胃酸分泌細胞の数が顕著に減少することや、胃粘膜が肥厚するメネトリエ病では表層粘液細胞の異常増加が見られることなどが知られています。
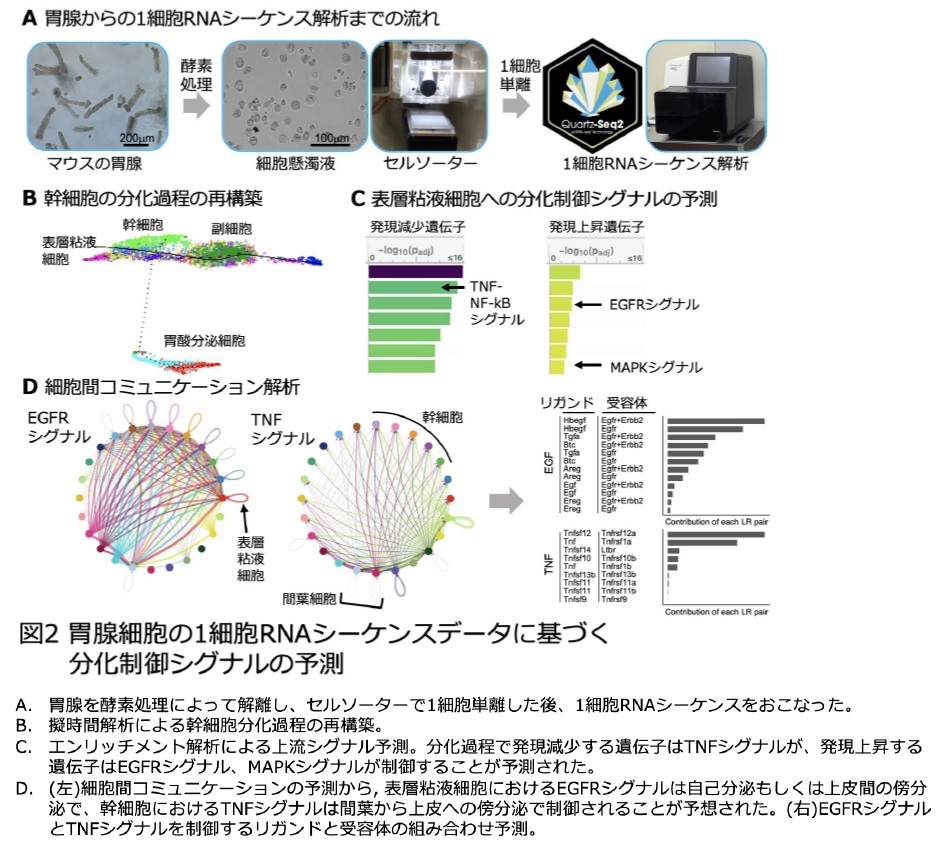
これまで正常胃組織における幹細胞分化メカニズムについては、特定の分化因子の遺伝子を破壊したノックアウトマウスを用いた解析などが行われていましたが、多くの細胞が複雑に相互作用する胃腺では、どの細胞がどの分化シグナルによって制御されているのか不明な点が多く残されていました。そこで本研究では、1細胞RNAシーケンス法で1細胞ごとにシグナル特異的応答遺伝子の発現パターンを詳細に解析することで、胃の個々の細胞が受けている分化シグナルを特定し、複雑な組織の細胞分化制御のしくみを解明することに挑戦しました。
研究手法と成果
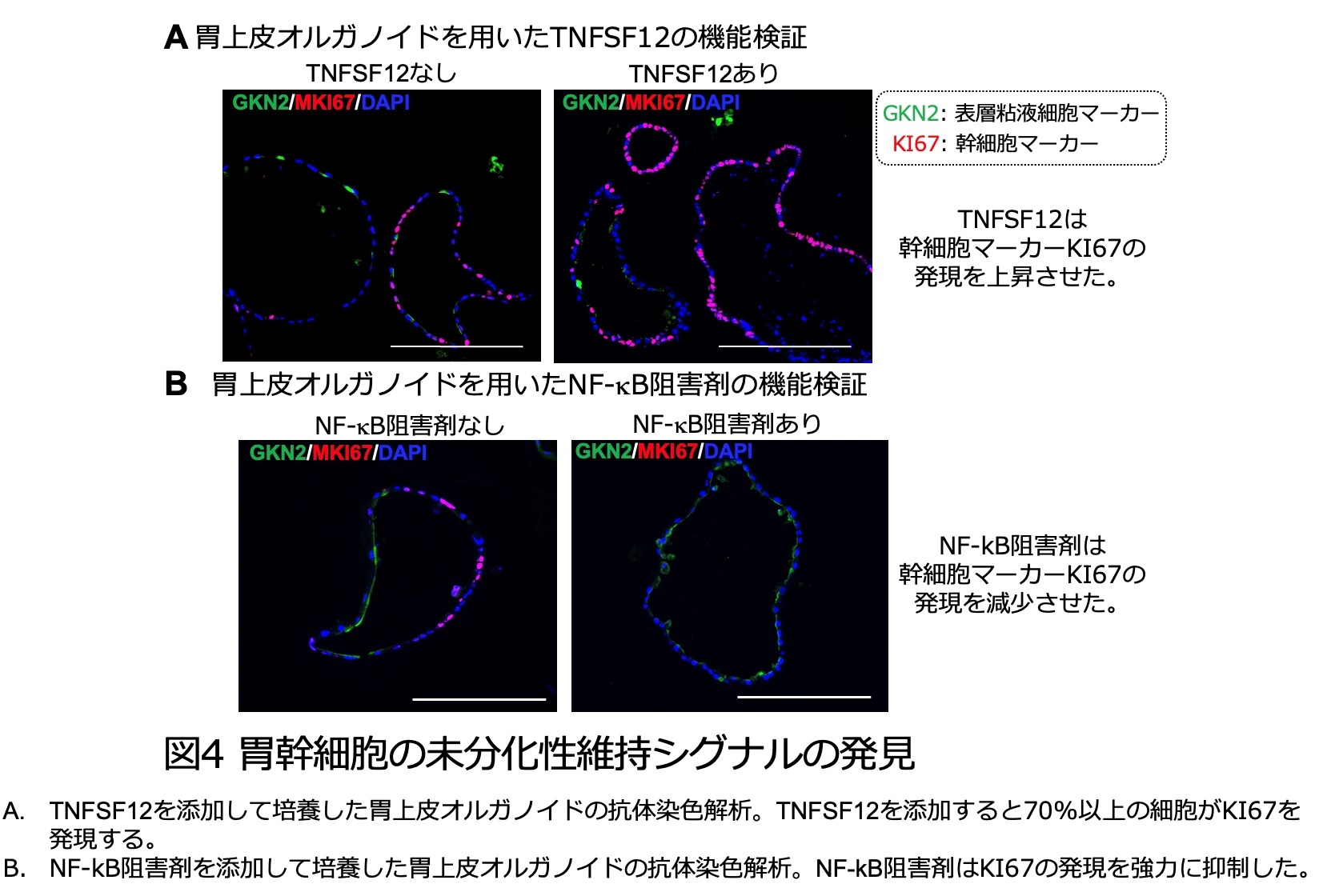
続いて、1細胞遺伝子発現データを用いて細胞間コミュニケーションの予測を行い、各細胞における細胞増殖因子と受容体の発現パターンと照らし合わせました。その結果、表層粘液細胞で活性化するEGFRシグナルは、表層粘液細胞が分泌するTGFαという細胞増殖因子と、その受容体EGFRによって制御されていることが予想されました。また、幹細胞で活性化するTNF-NF-kBシグナルは、間葉細胞[9]が分泌するTNFファミリーのTNFSF12という生理活性タンパク質と、その受容体TNFRSF12aによって制御されると予想されました(図2D)。
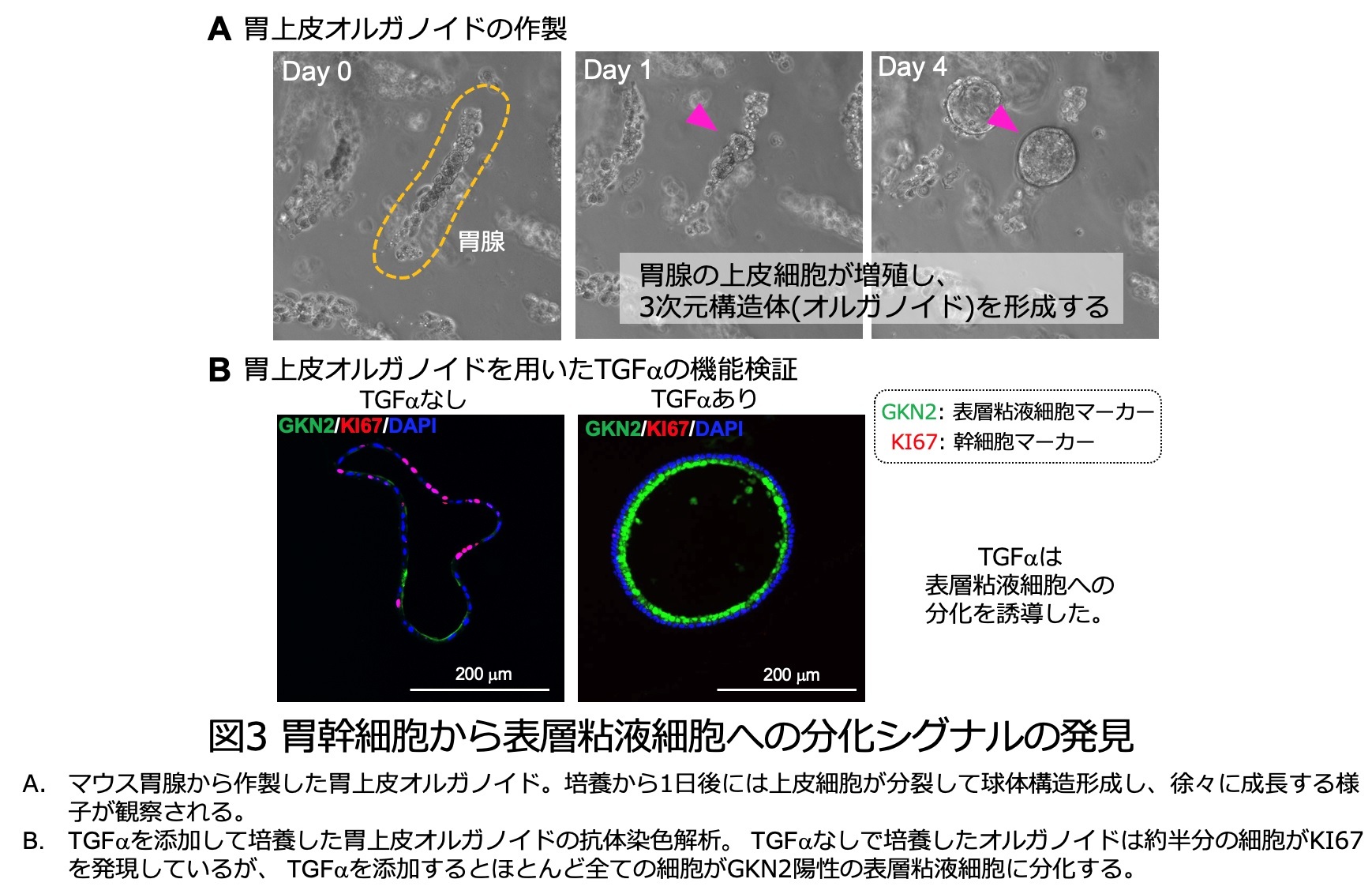
さらにこれらの予想が正しいことを検証するため、試験管内で培養した胃上皮オルガノイドを用いて検証実験を行いました。私たちの人工合成培地で培養した胃オルガノイドは、大半が幹細胞で構成されています。細胞増殖因子TGFαを培地に添加したところ、オルガノイドを構成するほとんど全ての細胞が表層粘液細胞に分化しました(図3)。逆にTGFα受容体であるEGFRの活性を阻害する薬剤を入れて培養すると、表層粘液細胞に分化せず、むしろ幹細胞の数が増加することから、TGFα-EGFRシグナルは表層粘液細胞への分化誘導シグナルであることが分かりました。
最後に成体マウスにEGFRシグナル阻害剤のエルロチニブを投与したところ、コントロールマウスと比較して表層粘液細胞の数が減少することが分かりました。すなわち、成体マウスにおいても、幹細胞から表層粘液細胞への分化にEGFRシグナルが必要であることが確認されました。
今後の展開
用語解説
[1]胃の幹細胞:胃腺の峡部に存在する組織幹細胞の一種。胃腺に存在する表層粘液細胞、副細胞、胃酸分泌細胞、内分泌細胞などに分化すると言われている。
[2]1細胞RNAシーケンス法Quartz-Seq2:1細胞が持つRNAを高精度かつ低コストでシーケンスする方法。2018年に理化学研究所の笹川洋平研究員、團野宏樹研究員、二階堂愛ユニットリーダー(研究当時)らが開発した。1細胞RNAシーケンス法の国際的な性能比較研究で、世界最高成績を収めた。特に、検出される遺伝子数が他の手法の1.5-5倍と、細胞機能の違いを計測するのに優れる。
[3]シグナル伝達:細胞膜の受容体が細胞外のシグナル分子を感知して、細胞内のシグナル分子に情報を伝えるプロセスのこと。最終的に、核内にシグナルが伝わり、様々な応答遺伝子が発現して細胞外の情報が遺伝子発現に変換される。その結果、細胞の増殖や分化、形態変化など、様々な細胞の応答現象が誘導される。
[4]化生:分化した細胞が別の機能を持つ細胞に変化すること。胃では、ピロリ菌感染により炎症が持続すると、胃酸分泌細胞や消化酵素分泌細胞が粘液細胞に置き換わる幽門線化生や、胃の上皮細胞が腸の上皮に置き換わる腸上皮化生がおこる。
[5]胃上皮オルガノイド:胃の幹細胞や幹細胞から分化した細胞で構成される3次元構造体。胃の組織から回収した胃腺を3次元培養することで得られる。小腸、大腸、脳、肺、腎臓など、さまざまな臓器由来の上皮オルガノイドが報告されている。
[6]TGFα:細胞増殖因子の1種の上皮成長因子(EGF)ファミリーに属するタンパク質。受容体であるEGFRに結合して、下流のシグナル経路を活性化する。
[7]TNFSF12:TNFスーパーファミリーに属する分泌性の生理活性タンパク質。受容体であるTNFRSF12Aに結合し、下流のシグナル経路を活性化する。
[8]擬時間解析:各細胞の遺伝子発現パターンがどれぐらい類似しているかを指標にして細胞を並べて比較し、細胞の分化や変性過程など細胞状態の遷移を可視化する方法。
[9]間葉細胞:線維芽細胞などの結合組織を構成する主要な細胞。様々な臓器で上皮細胞は間葉細胞に裏打ちされており、上皮と間葉の相互作用が上皮細胞の分裂や分化を制御すると言われている。
発表者

お問い合わせ先
<研究に関すること>
奈良先端科学技術大学院大学 先端科学技術研究科 バイオサイエンス領域 幹細胞工学研究室
役職 (助教) 氏名 高田 仁実
(教授) 氏名 栗崎 晃
E-mail:akikuri[@]bs.naist.jp
研究室紹介ホームページ:https://bsw3.naist.jp/kurisaki/
<報道に関すること>
奈良先端科学技術大学院大学 企画総務課 渉外企画係
E-mail:s-kikaku[@]ad.naist.jp
東京医科歯科大学 総務部 総務秘書課 広報係
E-mail:kouhou.adm[@]tmd.ac.jp
理化学研究所 広報室 報道担当
E-mail:ex-press[@]ml.riken.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

