「 腎臓切除後の代償性腎肥大のメカニズムを網羅的解析で解明 」 【菊池寛昭 助教】
― 世界初の単離尿細管を用いたATAC-seqに成功 ―
ポイント
- 手術などにおける腎臓切除後、失われた機能を補うために残った腎臓が肥大化する代償性肥大の仕組みを、多種類の網羅的解析(RNA-seq、transposase-accessible chromatin using sequencing (ATAC-Seq)、 プロテオミクス、リピドミクス)を用いて解明しました。
- 単離尿細管を用いたクロマチンアクセシビリティ解析(ATAC-Seq)を世界で初めて成功させました。
- 腎臓尿細管肥大は細胞の肥大化と細胞増殖双方の機序によって引き起こされますが、尿細管の部位によって細胞肥大、細胞増殖の比重が異なることが示されました。
- 本研究成果により腎臓の部分的切除や、障害を負った後の機能回復・亢進にペルオキシソーム増殖剤応答性受容体α(PPARα)が重要であることが示され、この仕組みをターゲットにした治療法開発などの医療応用が今後期待されます。
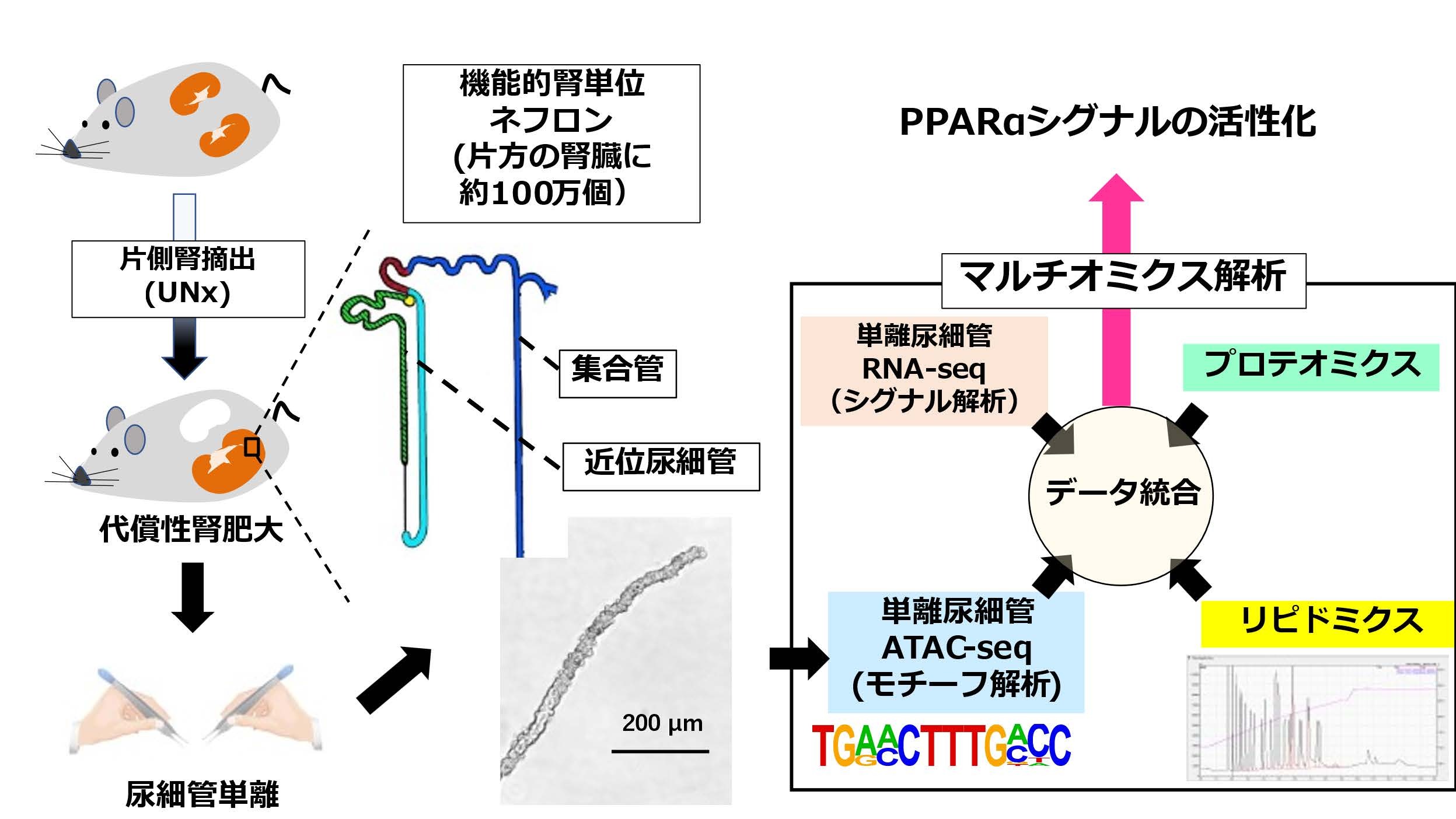
(図)単離尿細管を用いたマルチオミクス解析
片側腎摘出(UNx)によって、残された腎臓は代償性に肥大します。コントロール腎と肥大腎それぞれから、近位尿細管と皮質集合管を単離し、RNA-seqとATAC-seqを行いました。また、腎臓そのものを用いて、プロテオミクスとリピドミクスを施行し、データを統合し、尿細管の肥大に影響を及ぼすシグナルを絞り込みました。
研究の背景
研究成果の概要
PPARαは、肝臓、腎臓、筋肉など脂肪酸異化活性の高い組織で高発現している、DNAに結合するリガンド依存的な転写調節因子、核内受容体であり、PPARα のリガンドとなる生体内分子としては、炭素数14から20の飽和および不飽和脂肪酸が考えられています。研究グループはガスクロマトグラフィー質量分析法(GC/MS)を用いた解析から、肥大した腎臓においてこれらの脂肪酸がより多く認められることを明らかにしました。最後に、PPARαのノックアウトマウスを用いた検証から、PPARαの活性化が代償性尿細管肥大の原因となっている事を明らかにしました。
研究成果の意義
用語解説
※1 ATAC-seq: ATAC(Assay for Transposase-Accessible Chromatin)-seqは、ゲノム全体でオープンクロマチン構造を選択的に検出・シーケンスすることによってクロマチンへのアクセシビリティーをマッピングすることができる実験手法です。真核生物の染色体は、ヒストンタンパク質の4量体がDNA2本鎖を巻き付けているヌクレオソームが多数連なるクロマチン構造によって構成されています。クロマチン構造がきつく凝集している領域はヘテロクロマチンと呼ばれ、逆にクロマチン構造が緩まっている領域はユークロマチンと呼ばれます。ヘテロクロマチン領域に存在する遺伝子はヌクレオソームが転写因子のDNAへのアクセスを阻害するため転写が抑制された状態にありますが、その一方、ユークロマチン領域に存在する遺伝子は転写が活発に行われています。これらのエピジェネティックな構造変換に伴うオープンクロマチン領域にある遺伝子の転写が活性化することによって遺伝子発現がオンオフされています。ATAC-seqではTn5 トランスポゼースを用いて、オープンクロマチン領域の解析を行うことができます。
※2 ネフロン: 腎臓の構造上・機能上の単位です。腎臓の皮質部分から髄質部分に渡って長くヘアピン状に弯曲した管状構造物で、個々の腎小体とそれに続く1本の尿細管からなります。人間の場合は左右の腎臓には合わせて2百万個ほどのネフロンが規則正しく配列しています。腎小体は毛細血管の塊である糸球体とそれを包むボーマン嚢という袋からなり、尿細管は近位尿細管、ヘンレループ、遠位尿細管、集合管などの複数のセグメントから構成されます。現時点では少なくとも14種類の尿細管セグメントが存在するといわれています。
※3 MTORシグナル: アミノ酸や増殖因子、エネルギー状態など細胞内外の情報を感知して、細胞のサイズや増殖を調節するシグナルです。アミノ酸や増殖因子が豊富に存在すると、mTORシグナルが活性化してタンパク質や脂質の合成が促進され、細胞が肥大化・増殖します。
論文情報
論文タイトル:Signaling mechanisms in renal compensatory hypertrophy revealed by multi-omics
DOI: https://doi.org/10.1038/s41467-023-38958-9
研究者プロフィール

東京医科歯科大学 大学院医歯学総合研究科
茨城県腎臓疾患地域医療学講座 助教
・研究領域
腎疾患
トランスクリプトーム解析、エピゲノム解析
尿細管生理
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
茨城県腎臓疾患地域医療学講座 菊池 寛昭 (キクチ ヒロアキ)
腎臓内科学分野 内田 信一 (ウチダ シンイチ)
TEL:03-5803-5214 FAX:03-5803-5215
E-mail:hkikuchi.kid[@]tmd.ac.jp
suchida.kid[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

