DNA損傷ストレスによる新たな細胞応答メカニズムの解明【清水重臣 教授、辻岡政経 プロジェクト講師】
公開日:2023.4.11
DNA損傷ストレスによる新たな細胞応答メカニズムの解明
― がん悪性化を促進する細胞接着のストレス応答 ―
― がん悪性化を促進する細胞接着のストレス応答 ―
ポイント
- DNA損傷ストレスに対する細胞応答の新たなメカニズムを発見しました。
- この細胞応答は、細胞接着を増強するもので、本研究において、その仕組みを明らかにしました。
- この細胞応答は、細胞接着のコア分子であるFAKが、別のタンパク質FRNKに置き換わるものです。
- マウスを用いた実験により、この細胞応答はDNA損傷ストレスから生体組織を守る働きをしていることがわかりました。
- 一方、がんにおいては、その進展や転移を促進することをつきとめました。
- FRNKタンパク質を標的とした、新たながん治療法開発への応用が期待できます。
東京医科歯科大学難治疾患研究所病態細胞生物学分野の清水 重臣教授と辻岡 政経プロジェクト講師の研究グループは、兵庫医科大学 大村谷 昌樹教授、近畿大学 早坂 晴子准教授、大阪大学 水島 恒和教授、金沢大学 福間 剛士教授の研究グループとの共同研究で、DNA損傷ストレスに対する細胞応答の新規メカニズムを明らかにしました。この応答では、DNA損傷ストレスに反応した細胞が、FRNKと呼ばれるタンパク質の作用により接着を増強します。さらに研究グループは、この応答が、DNA損傷ストレスから生体組織を守る一方、がんの悪性化を促進することをつきとめました。FRNKを標的とした新たながん治療への応用が期待されます。この研究は文部科学省科学研究費補助金ならびに日本医療研究開発機構(AMED)の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Cell Death & Diseaseに、2023年4月8日にオンライン版で発表されました。
研究の背景
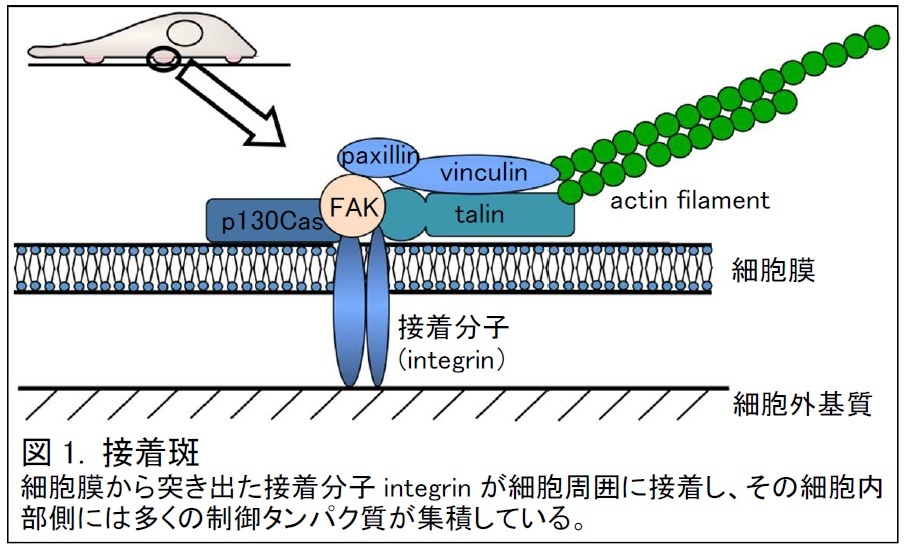
私達の体を構成する細胞の中には、遺伝情報を保持するDNAが含まれています。DNAは、放射線や太陽光に含まれる紫外線、体内で産生される活性酸素等、DNA損傷ストレスと呼ばれる様々な要因により傷つけられます。日常にありふれたこのストレスによるDNA損傷の蓄積は、がんをはじめ、様々な疾患の原因となるため、細胞にはDNA損傷ストレスに対処する仕組みが備わっています。例えば、紫外線を浴びると肌が黒くなりますが、これは、皮膚細胞がメラニンを生成して紫外線を吸収し、DNAを守るためです。DNAが傷ついた場合にも、素早く修復したり、修復しきれない程の損傷を受けると、アポトーシスと呼ばれる細胞自死機構により、細胞ごと組織から取り除かれて、がん細胞などの異常細胞の出現を防ぎます。このように、DNA損傷ストレス応答は広く解析されていますが、本研究グループは、新たにDNA損傷ストレスにより細胞接着力が増強するという現象を見出しました。細胞は、その表面の特定領域で細胞外基質に接着しています。接着斑と呼ばれるこの領域には多くのタンパク質が集積して接着の調節をしており、FAK分子はその中心にあります(図1)。細胞接着は、がん細胞の生着や転移を促進する原因になり得る細胞活動で、がん治療の放射線療法において、生き残ったがん細胞の接着力や運動能が上がることにより、かえってがんの悪性化を招く可能性も報告されています。
研究成果の概要
研究グループはまず、培養細胞にDNA損傷ストレスを与える薬剤を加えて接着斑を解析することにより、接着斑に集積するタンパク質のうち、FAKと呼ばれるタンパク質が消失し、新たに発現したFRNKと呼ばれるFAKの類似タンパク質と入れ替わることを見出しました。すなわち、DNA損傷ストレスにより、接着斑の構成に変化が起こることが分かりました。類似分子の入れ替えによる接着斑の改変は、これまでに知られていなかったユニークなものです。
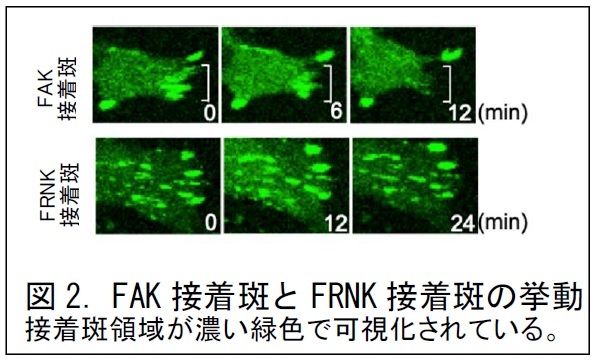
FAKとFRNKの入れ替わりが、細胞接着にどのような影響をもたらすのか検討するため、FAKの集積する接着斑のみを持つ細胞と、FRNKの集積する接着斑のみを持つ細胞を作製し、それぞれの接着斑をGFP※1により可視化して観察しました。接着斑は通常、細胞の形態変化や運動に伴って消失したり、新たに形成されたりします。FAKの集積する通常の接着斑は、本研究グループの観察でも、10分程度の観察時間の間に消失して、その領域の接着が解消される様子が観察されました(図2、上段)。一方、FRNKの集積する接着斑は、20分以上の観察時間の間にも消失が見られず、接着斑の寿命が長いことが分かりました(図2、下段)。このため、FRNKの接着斑を持つ細胞は、接着領域の面積が大きくなり、細胞接着力が強くなっていました。したがって、FRNKには、細胞接着を増強する役割があり、DNA損傷ストレスによって接着力が増強される仕組みが分かりました。
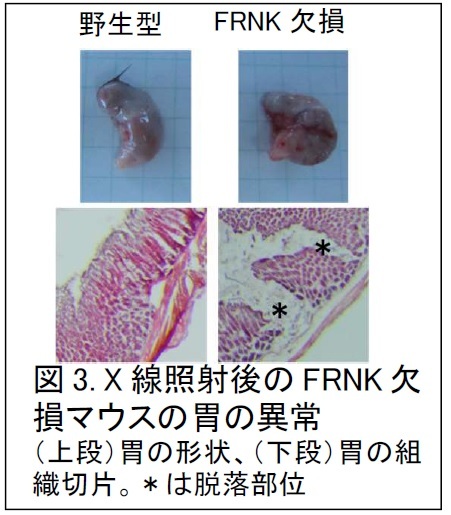
次に、この細胞応答の生体内での役割を検討しました。X線照射によりマウスにDNA損傷ストレスを与えると、胃の粘膜組織でFRNKが発現することが分かりました。この発現の意義を調べるため、FRNKタンパク質を欠損するマウスを作製し、同様にX線を照射し、正常マウスの胃粘膜組織と比較しました。X線照射後のFRNK欠損マウスの胃は、赤く腫れて、急性胃炎の様相を呈しており(図3、上段)、さらに詳しく粘膜組織を観察すると、上皮細胞※2がところどころ剥がれ落ちていました(図3、下段)。正常マウスの胃は、X線照射後でもそのような異常は見られませんでした。すなわち、FRNKは、DNA損傷ストレス下で細胞間の接着を補強し、胃粘膜組織を正常に維持する役割があると考えられます。
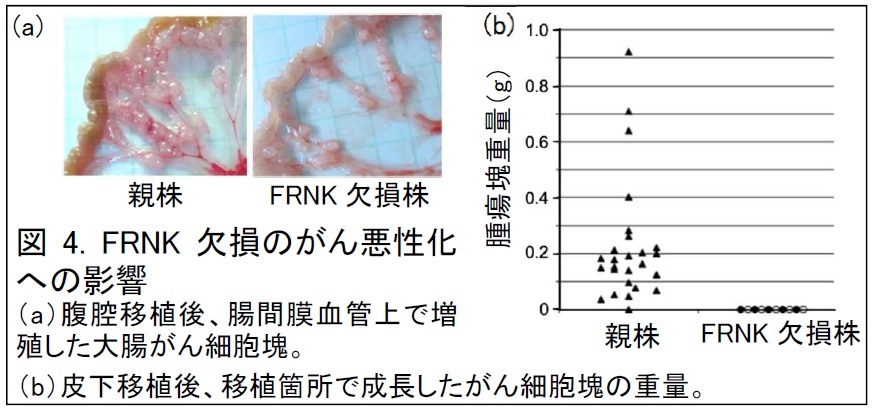
細胞接着とそれを介した細胞運動は、がんの生着、転移を促進する要素であり、がん組織中の細胞にはDNA損傷ストレスが入っていることが以前から報告されているため、研究グループは、今回発見したDNA損傷ストレス応答の、がんへの影響を検討しました。様々ながん細胞株※3にDNA損傷ストレスを与えると、約30 %の細胞で、FRNKの発現が確認されました。このうち、マウスの大腸がん細胞株CT26と、そのFRNK欠損細胞を、それぞれマウスの腹腔に移植しました。すると、腹腔全体に散らばったがん細胞塊の量が、FRNK欠損細胞では著しく減少していました(図4a)。マウスのリンパ系がん細胞株p53KO-Tと、そのFRNK欠損細胞の皮下移植実験でも、FRNK欠損細胞では、移植箇所でのがん細胞塊の成長が完全に抑えられていました(図4b)。さらに、ヒトのがん組織では、原発巣※4より転移組織の方で、より頻繁にFRNKの発現が確認されました。これらの結果から、FRNKは、DNA損傷ストレス下にあるがん組織において、細胞の接着を増強し、その生着、転移を促進していると予想されます。
研究成果の意義
今回の研究により、DNA損傷ストレスに対する細胞応答の新たなメカニズムが明らかにされました。この応答は、細胞接着の増強を介したものでした。DNA損傷ストレスによって細胞の接着が増強されるという報告はこれまでにもありましたが、その仕組みの一端が解明されました。DNA損傷ストレスは、日常にありふれたストレスであり、DNA損傷は様々な疾患の原因ともなるため、今回の成果、およびさらなるメカニズムの解明が、臨床医療への幅広い応用につながることが期待されます。特に、本研究では、このメカニズムのがん悪性化促進効果を明らかにしています。FRNKをはじめ、このメカニズムの関連分子を標的とした抗がん治療への応用は、既存の抗がん療法に効果がない場合の有力な代替手段となることが期待されます。また、多くの抗がん治療では標的とする分子が、通常の組織でも重要な働きをしていることが多く、これが副作用の原因となっていますが、FRNKの発現は、がん組織やDNA損傷ストレスを受けた組織に限定的であり、FRNK欠損マウスにも顕著な異常が見られないため、副作用の少ない抗がん治療法開発のための格好の標的であると期待しています。
用語解説
※1GFP・・・・・・・・オワンクラゲ由来の、緑色蛍光を発するタンパク質。調べたいタンパク質に繋げて、そのタンパク質の挙動を観察できる。今回の研究では、FAKとFRNKに繋げている。
※2上皮細胞・・・・・・・・体表面を覆う「表皮」、内臓の粘膜を構成する「上皮」などを総称した細胞の名称。
※3がん細胞株・・・・・・・・個体のがん組織から取り出し、試験管内で培養可能にした細胞集団。
※4原発巣・・・・・・・・最初にがんが発生した病変部位。
※2上皮細胞・・・・・・・・体表面を覆う「表皮」、内臓の粘膜を構成する「上皮」などを総称した細胞の名称。
※3がん細胞株・・・・・・・・個体のがん組織から取り出し、試験管内で培養可能にした細胞集団。
※4原発巣・・・・・・・・最初にがんが発生した病変部位。
論文情報
掲載誌:Cell Death & Disease
論文タイトル: Identification of a novel type of focal adhesion remodelling via FAK/FRNK replacement, and its contribution to cancer progression
DOI:https://doi.org/10.1038/s41419-023-05774-4
研究者プロフィール

辻岡 政経 (ツジオカ マサツネ) Tsujioka Masatsune
東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 プロジェクト講師
・研究領域
細胞接着、細胞運動、細胞生物学

清水 重臣 (シミズ シゲオミ) Shimizu Shigeomi
東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 教授
・研究領域
オルガネラバイオロジー、細胞生物学
東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 教授
・研究領域
オルガネラバイオロジー、細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学難治疾患研究所
病態細胞生物学分野 辻岡 政経(ツジオカ マサツネ) E-mail:tsumpcb[@]tmd.ac.jp
清水 重臣(シミズ シゲオミ) E-mail:shimizu.pcb[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

