細胞内の脂肪酸組成を調節することが白血病治療につながる可能性を発見
公開日:2023.3.16
国立大学法人筑波大学
国立大学法人東京医科歯科大学
国立大学法人筑波大学
国立大学法人東京医科歯科大学
急性骨髄性白血病(AML)の治癒率は向上しましたが、その恩恵を受けてきたのは主に、副作用に耐えられる50歳代以下の若・壮年者です。しかしAMLを発症しやすいのは60歳代以降で、こうした患者にも適用できる副作用の少ない新規治療法の開発が必須です。
本研究では、 細胞内の脂肪酸組成を変えることがAMLの新規治療になりうるかを検討しました。脂肪酸には多様な種類があり、その組成が細胞内で異なることで、細胞の働きがさまざまに調節されています。細胞内の脂肪酸は、炭素数16~20の分子が主体です。炭素数を16から18に伸長する酵素ELOVL6が細胞内の脂肪酸組成に大きく影響を与えることから、本研究ではElovl6遺伝子を不活化したE6KOマウスを用いて、脂肪酸組成の変化によって、造血幹細胞やAML発症がどのような影響を受けるかを調べました。その結果、E6KOマウスは健康で血液異常を認めませんが、骨髄細胞での脂肪酸組成が変化していました。この骨髄細胞を正常マウスに移植しても、骨髄での造血は観察されませんでした。一方、AML誘導遺伝子を導入した野生型マウスの骨髄細胞を正常マウスに移植するとAMLを発症します。しかし、同じ遺伝子をE6KOマウス骨髄細胞に導入して増殖させた場合、細胞内の脂肪酸組成が変化し、これを正常マウスに移植してもAMLは発症しませんでした。このような脂肪酸組成の変化により細胞運動を司るシグナル伝達が低減することが、AML発症抑制の一因であることも明らかになりました。
以上より、細胞内の脂肪酸組成を変化させることが、副作用の少ないAMLの治療につながる可能性を示しました。
本研究では、 細胞内の脂肪酸組成を変えることがAMLの新規治療になりうるかを検討しました。脂肪酸には多様な種類があり、その組成が細胞内で異なることで、細胞の働きがさまざまに調節されています。細胞内の脂肪酸は、炭素数16~20の分子が主体です。炭素数を16から18に伸長する酵素ELOVL6が細胞内の脂肪酸組成に大きく影響を与えることから、本研究ではElovl6遺伝子を不活化したE6KOマウスを用いて、脂肪酸組成の変化によって、造血幹細胞やAML発症がどのような影響を受けるかを調べました。その結果、E6KOマウスは健康で血液異常を認めませんが、骨髄細胞での脂肪酸組成が変化していました。この骨髄細胞を正常マウスに移植しても、骨髄での造血は観察されませんでした。一方、AML誘導遺伝子を導入した野生型マウスの骨髄細胞を正常マウスに移植するとAMLを発症します。しかし、同じ遺伝子をE6KOマウス骨髄細胞に導入して増殖させた場合、細胞内の脂肪酸組成が変化し、これを正常マウスに移植してもAMLは発症しませんでした。このような脂肪酸組成の変化により細胞運動を司るシグナル伝達が低減することが、AML発症抑制の一因であることも明らかになりました。
以上より、細胞内の脂肪酸組成を変化させることが、副作用の少ないAMLの治療につながる可能性を示しました。
研究代表者
筑波大学医学医療系
千葉 滋 教授
加藤 貴康 講師
東京医科歯科大学 難治疾患研究所 病態生理化学分野
佐々木 雄彦 教授
千葉 滋 教授
加藤 貴康 講師
東京医科歯科大学 難治疾患研究所 病態生理化学分野
佐々木 雄彦 教授
研究の背景
急性骨髄性白血病(AML)の治癒率は、化学療法や造血幹細胞移植などの強力な治療により向上していますが、こうした治療法は概して副作用が大きく、恩恵を受けてきたのは主にそれに耐えられる50歳代以下の若・壮年者でした。しかしながら、AMLを発症しやすいのは60歳代以降であり、こうした高齢者の治癒率向上のためには、副作用の少ない新たな治療薬の開発が必須です。
これまで、がんと脂質代謝の関連という観点でさまざまな研究が行われてきましたが、脂質にはエネルギー源、生体膜構成成分、シグナル分子といった多様な顔があり、主にがんとの関連で注目されてきたのはエネルギー代謝の側面です。一方、脂質分子は4万種以上あるとされますが、近年、こうした脂質分子の多様性に基づく細胞機能の変化が知られるようになっており、がん研究でも興味が持たれ始めています。脂質を構成する主要な要素である脂肪酸は、これを構成する炭素鎖長、炭素二重結合の有無・数・部位、炭素鎖の角度などによってさまざまな種類があります。本研究グループでは、これまでに、こうした多様な脂肪酸が細胞内には存在しており、これらの組成バランスが変化すると、糖尿病、非アルコール性肝硬変、動脈硬化、肺線維症などの発症に影響が及ぶことを報告してきました。しかし、血液細胞、あるいはそのがんである白血病との関連については、これまで明らかになっていませんでした。
細胞中に存在する脂肪酸は、炭素数16、18、20の長鎖脂肪酸分子が主体で、炭素数に応じて異なる酵素が脂肪酸の炭素鎖伸長を担っています。とりわけ、炭素数を16から18に伸長する酵素ELOVL6は、脂肪酸組成に大きな影響を与えることが知られています。この酵素の設計図であるElovl6遺伝子を破壊し酵素が全くできないようにしたE6KOマウスでは、肝臓などで、炭素鎖長18の脂肪酸であるステアリン酸やオレイン酸の割合が減り、その代わりに、炭素鎖長16のパルミチン酸やパルミトオレイン酸の割合が増えることが知られています。そこで本研究では、E6KOマウスを用いて、脂肪酸の組成バランスの変化が造血幹細胞や白血病発症にどのような影響を及ぼすかを検討しました。
これまで、がんと脂質代謝の関連という観点でさまざまな研究が行われてきましたが、脂質にはエネルギー源、生体膜構成成分、シグナル分子といった多様な顔があり、主にがんとの関連で注目されてきたのはエネルギー代謝の側面です。一方、脂質分子は4万種以上あるとされますが、近年、こうした脂質分子の多様性に基づく細胞機能の変化が知られるようになっており、がん研究でも興味が持たれ始めています。脂質を構成する主要な要素である脂肪酸は、これを構成する炭素鎖長、炭素二重結合の有無・数・部位、炭素鎖の角度などによってさまざまな種類があります。本研究グループでは、これまでに、こうした多様な脂肪酸が細胞内には存在しており、これらの組成バランスが変化すると、糖尿病、非アルコール性肝硬変、動脈硬化、肺線維症などの発症に影響が及ぶことを報告してきました。しかし、血液細胞、あるいはそのがんである白血病との関連については、これまで明らかになっていませんでした。
細胞中に存在する脂肪酸は、炭素数16、18、20の長鎖脂肪酸分子が主体で、炭素数に応じて異なる酵素が脂肪酸の炭素鎖伸長を担っています。とりわけ、炭素数を16から18に伸長する酵素ELOVL6は、脂肪酸組成に大きな影響を与えることが知られています。この酵素の設計図であるElovl6遺伝子を破壊し酵素が全くできないようにしたE6KOマウスでは、肝臓などで、炭素鎖長18の脂肪酸であるステアリン酸やオレイン酸の割合が減り、その代わりに、炭素鎖長16のパルミチン酸やパルミトオレイン酸の割合が増えることが知られています。そこで本研究では、E6KOマウスを用いて、脂肪酸の組成バランスの変化が造血幹細胞や白血病発症にどのような影響を及ぼすかを検討しました。
研究内容と成果
まず、E6KOマウスは健康で血液に異常を認めないものの、骨髄細胞の脂肪酸組成が、正常対象となる野生型マウスのそれとは異なっていました。このE6KOマウスの骨髄細胞をレシピエントマウスに移植しても、野生型マウスの骨髄細胞を移植した場合とは異なり、骨髄での造血が見られないことを見いだしました(図1)。一方、正常対象である野生型マウスの骨髄細胞にAML発症遺伝子(MLL-AF9注1)、以下MA9)を導入した細胞(野生型MA9細胞)をレシピエントマウスに移植するとAMLを発症し死亡します。E6KOマウスの骨髄細胞に同じMA9遺伝子を導入した細胞(E6KO-MA9細胞)は、野生型MA9細胞と脂肪酸組成が異なっていましたが、培養皿の中では増殖しました。しかしE6KO-MA9細胞をレシピエントマウスに移植しても、AMLを発症せず健康を維持しました(図2)。すなわち、ELOVL6制御によって脂肪酸組成バランスを変化させることで、AML治療につながる可能性を、世界で初めて示しました。なお、E6KOマウス骨髄細胞の移植では正常造血が観察されませんでしたが、E6KOマウスそのものの造血は正常であり、Elovl6は正常造血に必須ではないことも分かりました。従って、これを阻害する治療法では、造血が強く抑制されるという、白血病治療で最も問題になる副作用を生じる可能性は小さいと予想されます。
また、AML患者の網羅的遺伝子発現データと生存死亡データがそろっている2つの独立したコホート(集団)の公開データベースを活用し、いずれのコホートでも、ELOVL6発現の高い群の方が低い群に比べて生命予後が不良であることを見いだしました。このことは、マウスの実験結果と呼応していると考えられます。
さらに、E6KOによりAML発症が抑制されるメカニズムについても調べました。まず、マウス血液細胞におけるElovl6遺伝子の発現は、分化した細胞よりも骨髄の未分化な細胞において高いことが分かりました。またE6KOマウスの血液細胞では、予想通り、炭素数16と18の脂肪酸の組成バランスが変化していました。そして野生型マウスとE6KOマウスについて、骨髄造血幹細胞およびMA9細胞の網羅的遺伝子発現を比較し、Elovl6遺伝子の不活化によって、細胞の運動に関わる遺伝子発現や、CXCR4シグナルに関わる遺伝子発現が変化していることが分かりました。CXCR4はケモカイン(サイトカインの一種)CXCL12の受容体で、造血幹細胞はケモカインの濃度勾配に応じて遊走(移動)します。E6KO細胞では野生型細胞に比べてCXCL12への反応性遊走能が低下していることが実験的に確かめられたことから、CXCR4シグナルに影響が生じていると考えられました。
そこで、E6KOによってCXCL12-CXCR4注2)の下流でどのようなシグナルが影響を受けているかを検討しました。受容体であるCXCR4の下流では、「PI3K経路」や「RAS-MAPK経路」などのシグナル経路が働いて、遊走の他に増殖や細胞の生死の制御などを行っています。野生型MA9細胞にCXCL12を加えると、PI3K経路の活性化を示すシグナル分子AKTのリン酸化やRACの活性化、およびRAS-MAPK経路の活性化を示すシグナル分子ERK1/ERK2のリン酸化が観察されます。この中でMA9細胞の遊走に関係しているシグナル経路がどれかを調べるため、PI3K(脂質の一種であるホスファチジルイノシトール注3)4,5-二リン酸(PIP2)をリン酸化しホスファチジルイノシトール3,4,5-三リン酸(PIP3)に変える酵素)を阻害する化合物(PI3K阻害剤)の影響を調べました。野生型MA9細胞はPI3K阻害剤によって、PI3K阻害を行わないE6KO-MA9細胞と同程度に、CXCL12への反応性遊走能が低下しました。一方、E6KO-MA9細胞の遊走能は、この阻害剤の影響を受けませんでした。また、RAS-MAPK阻害剤ではCXCL12に対する野生型MA9細胞の遊走能もE6KO-MA9細胞の遊走能も変化しませんでした。これらの実験結果から、E6KOによりPI3Kシグナル障害が惹起されることが推察されます。細胞にCXCL12を加えて刺激した後に、PI3K下流シグナル分子であるAKTのリン酸化と、タンパク質Rac1の活性化を比較し、シグナル伝達の様子を調べたところ、CXCL12刺激後に野生型MA9細胞で見られるAKTのリン酸化やRac1の活性化は、いずれもE6KO-MA9細胞では著しく低下していました。一方、CXCL12刺激後に野生型MA9細胞で見られるERK1/ERK2のリン酸化は、E6KO-MA9細胞でも同等に観察されました。このことから、Elovl6酵素が働かないことによって、CXCR4下流の2つの主要なシグナル経路のうち、PI3K経路が特異的に不活化されると考えられました。また、AKT阻害剤やRAC阻害剤を用いた実験で、細胞の遊走能に影響を与えているのは、PI3K-RAC経路の障害であることを突き止めました(図3)。
さらに、PI3K経路が特異的に不活化されるメカニズムについて、詳しく調べました。PI3KはPIP2をPIP3に変換する酵素ですが、PIP2やPIP3は脂肪酸が2つ含まれた構造を持っており、これらの脂肪酸の組成バランスはさまざまです。ELOVL6によるPIP2やPIP3構成脂肪酸の組成バランス変化がPI3K- PIP3シグナルに関与しているとすれば、これまで知られていなかった全く新しいシグナル伝達のメカニズムが示唆されます。そこで、PIP2とPIP3それぞれを構成する脂肪酸プロファイルを解析しました。その結果、両者とも、E6KO細胞では炭素数18の脂肪酸2分子と思われる合計炭素数36の脂肪酸の組み合わせが減少し、炭素数18の脂肪酸と炭素数16の脂肪酸から成ると思われる合計炭素数34の脂肪酸の組み合わせが増加していました。こうした現象は、E6KO-MA9細胞にElovl6を再発現させることで元に戻ることも確認しており、ELOVL6とPI3Kシグナルとの関連を強く示唆する結果と考えられます(図3)。
以上の成果は、筑波大学で白血病の研究を行う血液内科グループ、糖尿病などさまざまな疾患における脂質の研究を行う内分泌糖尿病代謝内科グループ、および東京医科歯科大学で特殊な脂質における細胞内シグナルの研究を行うグループの協働により得られたものです。
また、AML患者の網羅的遺伝子発現データと生存死亡データがそろっている2つの独立したコホート(集団)の公開データベースを活用し、いずれのコホートでも、ELOVL6発現の高い群の方が低い群に比べて生命予後が不良であることを見いだしました。このことは、マウスの実験結果と呼応していると考えられます。
さらに、E6KOによりAML発症が抑制されるメカニズムについても調べました。まず、マウス血液細胞におけるElovl6遺伝子の発現は、分化した細胞よりも骨髄の未分化な細胞において高いことが分かりました。またE6KOマウスの血液細胞では、予想通り、炭素数16と18の脂肪酸の組成バランスが変化していました。そして野生型マウスとE6KOマウスについて、骨髄造血幹細胞およびMA9細胞の網羅的遺伝子発現を比較し、Elovl6遺伝子の不活化によって、細胞の運動に関わる遺伝子発現や、CXCR4シグナルに関わる遺伝子発現が変化していることが分かりました。CXCR4はケモカイン(サイトカインの一種)CXCL12の受容体で、造血幹細胞はケモカインの濃度勾配に応じて遊走(移動)します。E6KO細胞では野生型細胞に比べてCXCL12への反応性遊走能が低下していることが実験的に確かめられたことから、CXCR4シグナルに影響が生じていると考えられました。
そこで、E6KOによってCXCL12-CXCR4注2)の下流でどのようなシグナルが影響を受けているかを検討しました。受容体であるCXCR4の下流では、「PI3K経路」や「RAS-MAPK経路」などのシグナル経路が働いて、遊走の他に増殖や細胞の生死の制御などを行っています。野生型MA9細胞にCXCL12を加えると、PI3K経路の活性化を示すシグナル分子AKTのリン酸化やRACの活性化、およびRAS-MAPK経路の活性化を示すシグナル分子ERK1/ERK2のリン酸化が観察されます。この中でMA9細胞の遊走に関係しているシグナル経路がどれかを調べるため、PI3K(脂質の一種であるホスファチジルイノシトール注3)4,5-二リン酸(PIP2)をリン酸化しホスファチジルイノシトール3,4,5-三リン酸(PIP3)に変える酵素)を阻害する化合物(PI3K阻害剤)の影響を調べました。野生型MA9細胞はPI3K阻害剤によって、PI3K阻害を行わないE6KO-MA9細胞と同程度に、CXCL12への反応性遊走能が低下しました。一方、E6KO-MA9細胞の遊走能は、この阻害剤の影響を受けませんでした。また、RAS-MAPK阻害剤ではCXCL12に対する野生型MA9細胞の遊走能もE6KO-MA9細胞の遊走能も変化しませんでした。これらの実験結果から、E6KOによりPI3Kシグナル障害が惹起されることが推察されます。細胞にCXCL12を加えて刺激した後に、PI3K下流シグナル分子であるAKTのリン酸化と、タンパク質Rac1の活性化を比較し、シグナル伝達の様子を調べたところ、CXCL12刺激後に野生型MA9細胞で見られるAKTのリン酸化やRac1の活性化は、いずれもE6KO-MA9細胞では著しく低下していました。一方、CXCL12刺激後に野生型MA9細胞で見られるERK1/ERK2のリン酸化は、E6KO-MA9細胞でも同等に観察されました。このことから、Elovl6酵素が働かないことによって、CXCR4下流の2つの主要なシグナル経路のうち、PI3K経路が特異的に不活化されると考えられました。また、AKT阻害剤やRAC阻害剤を用いた実験で、細胞の遊走能に影響を与えているのは、PI3K-RAC経路の障害であることを突き止めました(図3)。
さらに、PI3K経路が特異的に不活化されるメカニズムについて、詳しく調べました。PI3KはPIP2をPIP3に変換する酵素ですが、PIP2やPIP3は脂肪酸が2つ含まれた構造を持っており、これらの脂肪酸の組成バランスはさまざまです。ELOVL6によるPIP2やPIP3構成脂肪酸の組成バランス変化がPI3K- PIP3シグナルに関与しているとすれば、これまで知られていなかった全く新しいシグナル伝達のメカニズムが示唆されます。そこで、PIP2とPIP3それぞれを構成する脂肪酸プロファイルを解析しました。その結果、両者とも、E6KO細胞では炭素数18の脂肪酸2分子と思われる合計炭素数36の脂肪酸の組み合わせが減少し、炭素数18の脂肪酸と炭素数16の脂肪酸から成ると思われる合計炭素数34の脂肪酸の組み合わせが増加していました。こうした現象は、E6KO-MA9細胞にElovl6を再発現させることで元に戻ることも確認しており、ELOVL6とPI3Kシグナルとの関連を強く示唆する結果と考えられます(図3)。
以上の成果は、筑波大学で白血病の研究を行う血液内科グループ、糖尿病などさまざまな疾患における脂質の研究を行う内分泌糖尿病代謝内科グループ、および東京医科歯科大学で特殊な脂質における細胞内シグナルの研究を行うグループの協働により得られたものです。
今後の展開
今後、ELOVL6阻害がAML治療に有効であることを示す薬理学的なデータの取得、および、実験的な確認を進めます。また、血液細胞以外のさまざまな細胞でも、ミトコンドリアや小胞体などの機能がELOVL6の影響を受けることが知られていることから、E6KO-MA9細胞を移植してもAML発症に至らない原因として、細胞遊走能の障害以外のメカニズムも探索します。さらにELOVL6とPI3Kとの関連について、PIP2やPIP3を構成する脂肪酸プロファイルの変化が、PI3Kシグナルにどのようにして影響を与えているかを検証していきます。
参考図
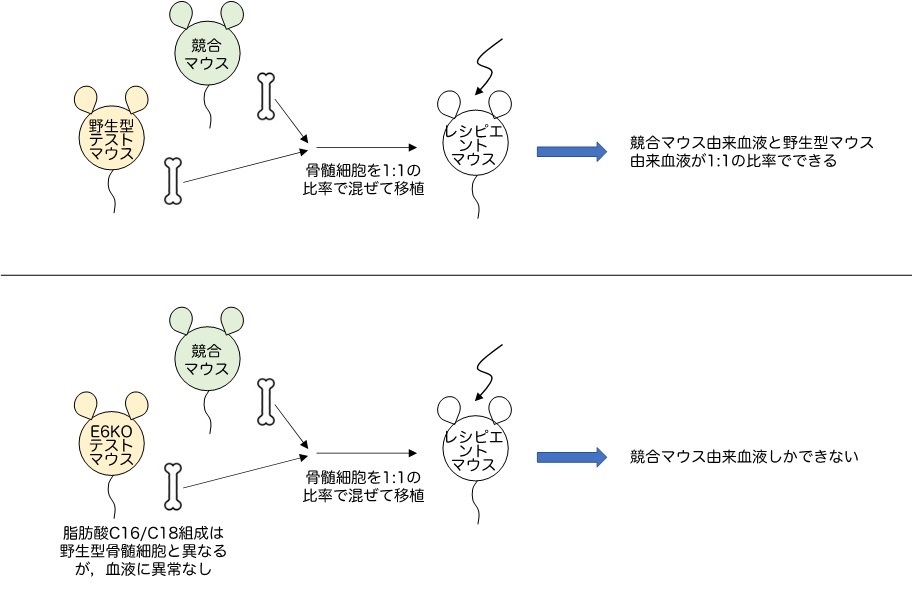
図1 正常造血細胞に与えるElovl6遺伝子不活化の影響を調べた実験の概略
実験では、野生型マウスおよびE6KOマウスいずれの骨髄細胞も、競合マウス骨髄細胞(造血能を比較するために用いられる同条件・同数の正常マウス骨髄細胞)とともに移植している。
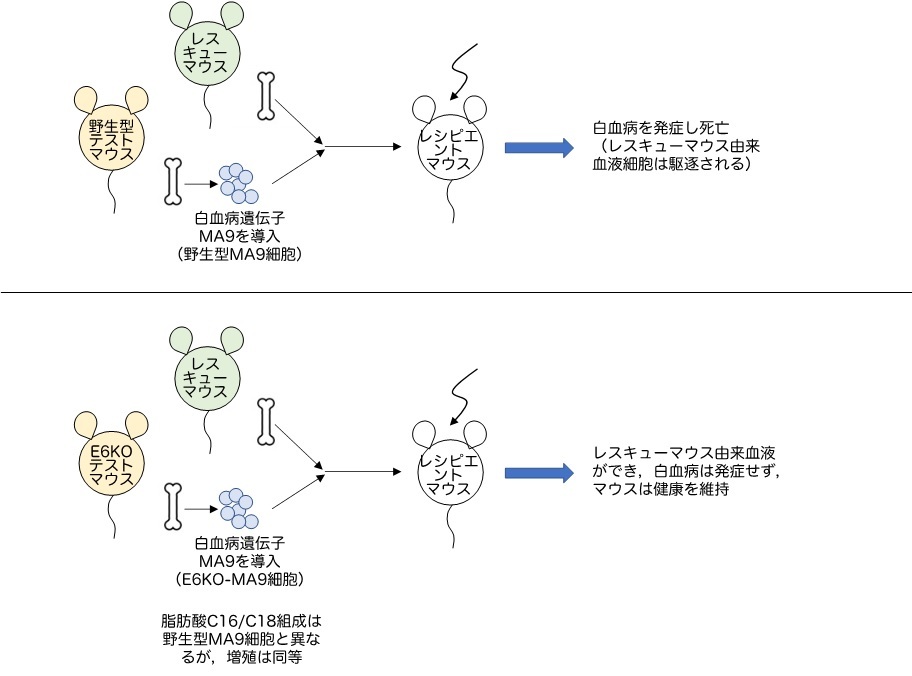
図2 白血病細胞に与えるElovl6遺伝子不活化の影響を調べた実験の概略
実験では、野生型MA9細胞およびE6KO-MA9細胞のいずれも、レスキューマウスの骨髄細胞(レシピエントマウスが白血病発症前に死ぬことを避けるための正常骨髄細胞)とともに移植している。
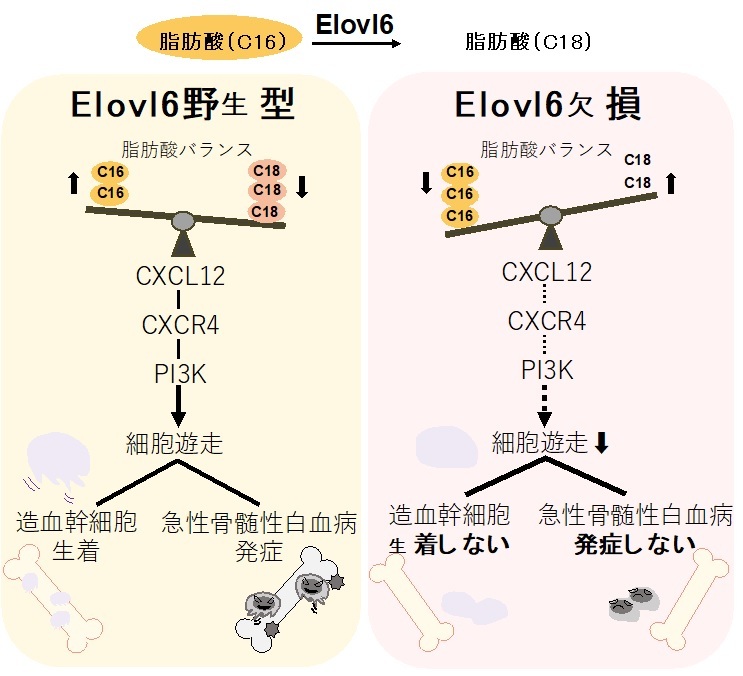
図3 本研究の結果のまとめ
Elovl6遺伝子を働かなくしたマウス(E6KO)を用いて脂肪酸組成の変化が造血幹細胞や白血病がどのような影響を受けるか調べたところ、脂肪酸組成バランスが、造血幹細胞の生着注4)および急性骨髄性白血病の発症に関与していることを発見した。そのメカニズムとして、ELOVL6が機能しないことで脂肪酸組成バランスが変化し、細胞運動を司るCXCL12-CXCR4-PI3Kシグナル伝達が低下すると考えられた。
Elovl6遺伝子を働かなくしたマウス(E6KO)を用いて脂肪酸組成の変化が造血幹細胞や白血病がどのような影響を受けるか調べたところ、脂肪酸組成バランスが、造血幹細胞の生着注4)および急性骨髄性白血病の発症に関与していることを発見した。そのメカニズムとして、ELOVL6が機能しないことで脂肪酸組成バランスが変化し、細胞運動を司るCXCL12-CXCR4-PI3Kシグナル伝達が低下すると考えられた。
用語解説
注1) MLL-AF9
11番染色体上にあるMLL(Mixed lineage leukemia)遺伝子と9番染色体のAF9遺伝子が融合した遺伝子で、白血病を発症させることが知られている。AMLや小児急性リンパ性白血病などで認める。
注2) CXCL12-CXCR4
このシグナル伝達経路は造血幹細胞の生体内移動やがんの増殖・転移に重要な役割をはたしている。CXCL12はケモカインで、細胞膜にある受容体CXCR4の主要なケモカインリガンド。
注3) ホスファチジルイノシトール
生体内に広く存在するリン脂質の一つで、細胞膜・ゴルジ体膜・エンドソームなどの細胞膜の構成成分。分子構造内に脂肪酸を2つ有する。リン酸化された代謝産物は、シグナル伝達、細胞内物質輸送、細胞骨格の制御などさまざまな細胞機能に関与する。
注4) 生着
移植した造血幹細胞が血液の流れに乗って骨髄にたどり着き、増殖し、血液細胞(白血球、赤血球、血小板)の産生を開始すること。
11番染色体上にあるMLL(Mixed lineage leukemia)遺伝子と9番染色体のAF9遺伝子が融合した遺伝子で、白血病を発症させることが知られている。AMLや小児急性リンパ性白血病などで認める。
注2) CXCL12-CXCR4
このシグナル伝達経路は造血幹細胞の生体内移動やがんの増殖・転移に重要な役割をはたしている。CXCL12はケモカインで、細胞膜にある受容体CXCR4の主要なケモカインリガンド。
注3) ホスファチジルイノシトール
生体内に広く存在するリン脂質の一つで、細胞膜・ゴルジ体膜・エンドソームなどの細胞膜の構成成分。分子構造内に脂肪酸を2つ有する。リン酸化された代謝産物は、シグナル伝達、細胞内物質輸送、細胞骨格の制御などさまざまな細胞機能に関与する。
注4) 生着
移植した造血幹細胞が血液の流れに乗って骨髄にたどり着き、増殖し、血液細胞(白血球、赤血球、血小板)の産生を開始すること。
研究資金
本研究は、文部科学省 科学研究費助補助金 基盤研究(C)(研究代表者:加藤貴康、研究期間:2020−2022年度)、国立研究開発法人日本医療研究開発機構(AMED)の次世代がん医療創生研究事業(研究代表:千葉滋、研究期間:2016−2021年度)および橋渡し研究プログラムシーズA(研究代表者:加藤貴康、研究期間:2021−2022年度)、公益財団法人先進医学研究振興財団、公益財団法人武田科学振興財団、他の研究プロジェクトの一環として実施されました。
掲載論文
-
【題 名】The fatty acid elongase Elovl6 is crucial for hematopoietic stem cell engraftment and leukemia propagation
(脂肪酸伸長酵素Elovl6は造血幹細胞の生着と白血病発症に必須である) -
【著者名】Yusuke Kiyoki*, Takayasu Kato*, Sakura Kito, Takashi Matsuzaka, Shin Morioka, Junko Sasaki, Kenichi Makishima, Tatsuhiro Sakamoto, Hidekazu Nishikii, Naoshi Obara, Mamiko Sakata-Yanagimoto, Takehiko Sasaki, Hitoshi Shimano, Shigeru Chiba
-
【掲載誌】Leukemia
-
【掲載日】2023年3月8日
-
【 DOI 】
問合わせ先
<研究に関すること>
加藤 貴康(かとう たかやす)
筑波大学医学医療系 講師
E-mail: tkato[@]md.tsukuba.ac.jp
URL: https://ketsunai.com
<報道に関すること>
筑波大学広報室
E-mail:kohositu[@]un.tsukuba.ac.jp
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

