「大腸癌におけるRTP4サイレンシングによる腫瘍細胞内因性の免疫チェックポイント阻害薬 治療抵抗性獲得メカニズムの解明」【田中真二 教授】
「大腸癌におけるRTP4サイレンシングによる腫瘍細胞内因性の免疫チェックポイント阻害薬治療抵抗性獲得メカニズムの解明」
―免疫チェックポイント阻害薬の効果予測マーカー、治療ターゲットとして有望な遺伝子RTP4の同定―
ポイント
- 近年、免疫チェックポイント阻害薬(ICB)※1の進歩により、ミスマッチ修復遺伝子異常・マイクロサテライト不安定性大腸癌(dMMR/MSI-H 大腸癌)※2の患者予後が改善されましたがICB治療抵抗性が出現することも知られています。
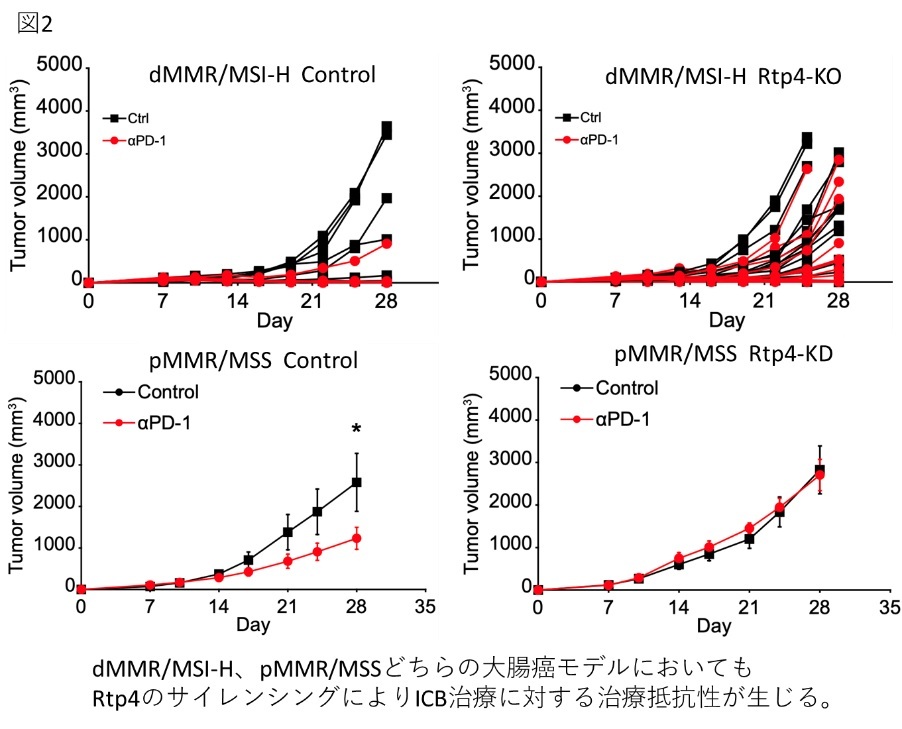
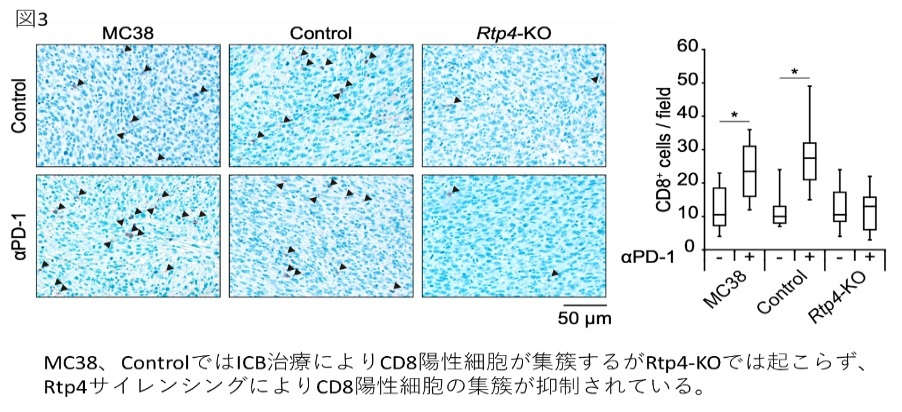
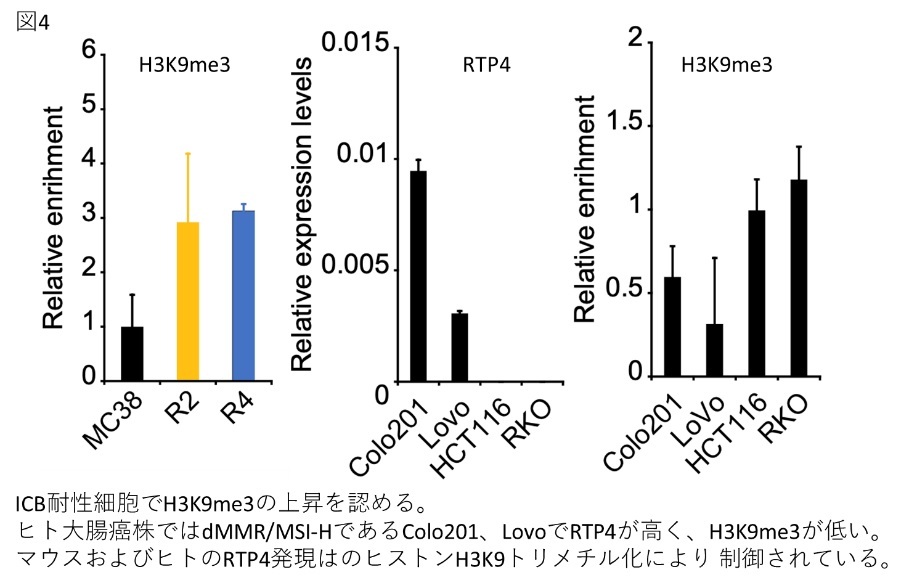
- 本研究では、早期ICB治療抵抗性獲得機序としてヒストンH3K9トリメチル化によるRTP4のサイレンシングを同定し、腫瘍内Tリンパ球の集簇が抑制されることを見出しました。
- ICB治療感受性が高いdMMR/MSI-H大腸癌の多くでRTP4が高発現であることを明らかにしました。
- RTP4の発現が大腸癌におけるICB治療反応性の予測マーカーとなりうることが示唆されました。エピジェネティクス治療薬とICBの併用は、dMMR/MSI-H 大腸癌に対する有効な治療方法として期待できます。
研究の背景
dMMR/MSI-H大腸癌は予後不良で標準化学療法抵抗性を示しますが、フレームシフト変異※3により腫瘍遺伝子変異量※4が高く、ネオ抗原※5が豊富で免疫原性が高いため、ICB治療が有効な治療法とされています。しかしながら、ICB治療に対する治療抵抗性を獲得することも多く、腫瘍遺伝子変異量の低さ、腫瘍特異抗原の欠如、β2-ミクログロブリンとMHC-I分子の消失、JAK変異、PTEN欠損、Wnt/β-カテニンシグナルの活性化などがICB治療耐性の分子機構として報告されていますが、早期の抵抗性メカニズムは不明です。研究グループはC57BL/6マウス由来のdMMR/MSI-H大腸癌細胞株MC38を用いて、早期のICB治療抵抗性獲得機序を探索しました。
研究成果の概要
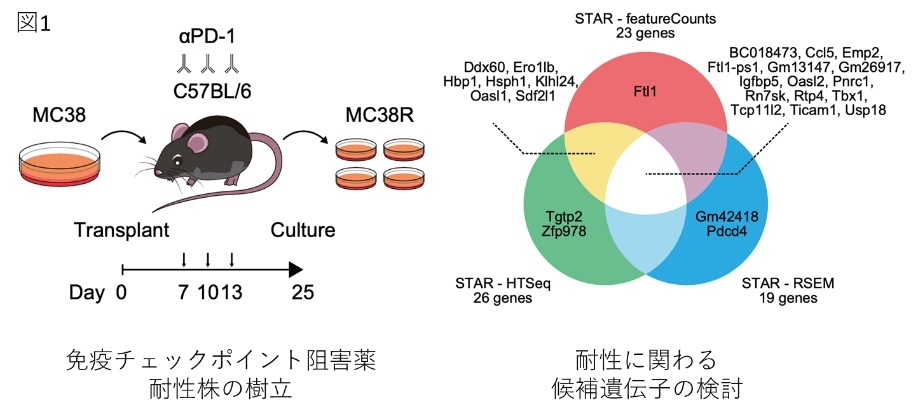
さらに、エピジェネティクス異常は、癌遺伝子や癌抑制遺伝子の発現だけでなく、腫瘍の免疫原性やICB治療反応性にも寄与していると考えられています。ICB治療とエピジェネティクス治療薬との併用療法についても報告されておりエピジェネティクス治療薬は、RTP4などの重要な遺伝子の発現を回復させることで、ICBに対する反応を高め、耐性克服に寄与する可能性があります。
ヒトdMMR/MSI-H大腸癌を再現したマウス大腸癌細胞株MC38を用いて、早期のICB耐性獲得機序としてヒストンH3K9トリメチル化によるRTP4のサイレンシングを同定しました。また、ヒト大腸癌の遺伝子発現データ解析では、多くのdMMR/MSI-H大腸癌でRTP4が高発現していることが明らかとなり、RTP4発現はdMMR/MSI-H大腸癌におけるICB治療反応性の予測マーカーとなる可能性があります。
研究成果の意義
用語解説
※1免疫チェックポイント阻害薬
T細胞を再活性化することにより腫瘍増殖抑制効果を示す薬で近年その効果が注目されている。
※2ミスマッチ修復遺伝子異常・マイクロサテライト不安定性大腸癌
ミスマッチ修復遺伝子異常・マイクロサテライト不安定性とは、細胞分裂の際に起こるDNAの配列ミスを修復する機能が低下している状態のことを指す。修復能力が低下していることによりゲノム上に変異が蓄積しやすく癌化しやすい。
※3フレームシフト変異
フレームシフト変異はDNAの挿入、欠失のことである。mRNAから3塩基ずつまとめてアミノ酸へと翻訳されるので、挿入や欠失塩基の数が3の倍数でない場合に翻訳がずれ、合成されるタンパク質が全く異なったものになる。
※4腫瘍遺伝子変異量
腫瘍遺伝子変異量(TMB)は、がん細胞のゲノムに生じた遺伝子変異の量のことである。変異タンパク質を持つ細胞は、免疫細胞からの攻撃を受けやすくなり、腫瘍遺伝子変異量が多いがん細胞ほど、免疫細胞により攻撃される可能性が高まる。
※5ネオ抗原
がん細胞独自の遺伝子変異に伴って新たに生まれた変異抗原のことで、ネオアンチゲンは正常な細胞には発現しておらず、がん細胞だけにみられる。
※6バイオインフォマティクス解析
バイオインフォマティクスとは生命科学と情報科学の融合分野であり、DNAやRNA、タンパク質などの生命情報に対して情報科学や統計学などのアルゴリズムを用い解析を行うこと。
※7エピジェネティクス制御
エピジェネティクス制御はDNAの塩基配列の変化を伴わない遺伝子発現制御の仕組みでありDNAメチル化、ヒストン修飾およびクロマチン再構築の3つが柱となっている。
※8プロモーター領域
遺伝子をコードするDNA領域の上流に存在する転写制御を行う領域であり、転写の活性化もしくは抑制などの機能を持つ様々な転写調節因子が結合することで転写の制御が行われる。
論文情報
掲載誌:Journal of Gastroenterology
論文タイトル: RTP4 silencing provokes tumor-intrinsic resistance to immune checkpoint blockade in colorectal cancer
DOI:https://doi.org/10.1007/s00535-023-01969-w
研究者プロフィール
田中真二 (タナカ シンジ) Tanaka Shinji
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 教授
・研究領域
分子腫瘍医学、消化器外科学
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 助教
・研究領域
分子腫瘍医学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子腫瘍医学分野 島田周(シマダ シュウ)
田中真二(タナカ シンジ)
E-mail:shu.shimada[@]tmd.ac.jp
tanaka.monc[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

