「慢性腎臓病において血管石灰化を引き起こす悪玉メッセージ物質を発見」【萬代新太郎 助教】

萬代 新太郎(まんだい しんたろう) 大学院医歯学総合研究科 腎臓内科学分野 助教(左)
小出 高彰(こいで たかあき) 大学院医歯学総合研究科 腎臓内科学分野 大学院生(右)
―循環細胞外小胞を標的とした慢性腎臓病、心血管病の新たな治療薬の開発に期待―
ポイント
- 慢性腎臓病(chronic kidney disease、CKD)によって品質の変化した血液中の循環細胞外小胞(small extracellular vesicles、EV)が、血管石灰化を引き起こすことを発見しました。
- 循環EVはマイクロRNA、タンパク質など様々な物質を細胞間、臓器間で伝播しますが、それらの役割は未解明点が多いです。本研究は、CKDにおける循環EVを解析することで血管石灰化に対して優れた予測診断能(バイオマーカー)・治療効果(治療薬シーズ)を発揮するマイクロRNA群を同定しました。
- これらのマイクロRNAが標的とするタンパク質VEGFAを特定し、VEGFA-VEGFR2シグナルを阻害する既存薬の中から、動脈硬化の新たな治療薬シーズを見出しました。
研究の背景
CKDは、透析を必要としない段階から全身の臓器に悪影響を及ぼすことが分かってきています。実際に私たちの研究グループはこれまで、CKDに潜在する複雑な病態と多併存症、診療成績を向上させる手段について研究してきました1,2)。このためCKDによる腎外臓器合併症(臓器連関)という現象を科学的に明らかにし、治療法を開発すべく研究を行ってきました。
心血管病(心筋梗塞、狭心症や脳梗塞など)も、代表的なCKDの遠隔臓器合併症です。心血管病の根幹を成すのが動脈硬化、中でも石灰化という現象です。私たちの体では生理的に、カルシウム、リンが中心となり骨や歯などの硬組織を形成する現象「石灰化」が起こっています。一方で、CKDや老化、高血圧症や糖尿病など様々な原因で、動脈壁や心臓の弁のような軟部組織に、異所性石灰化(非生理的、病的な石灰化現象)が起こってしまいます(図1上)。しかしながら、この分子メカニズムは十分分かっていませんでした。世界的に研究開発が進められてきた降圧薬、抗凝固薬、脂質異常症治療薬や、CKDに伴う骨・ミネラル代謝異常(CKD-MBD)に対する治療薬(経口リン吸着薬やカルシウム受容体作動薬)、透析療法いずれによっても石灰化の治療効果は不十分であり、新たな切り口の病態理解と治療開発が待ち望まれていました。
研究成果の概要
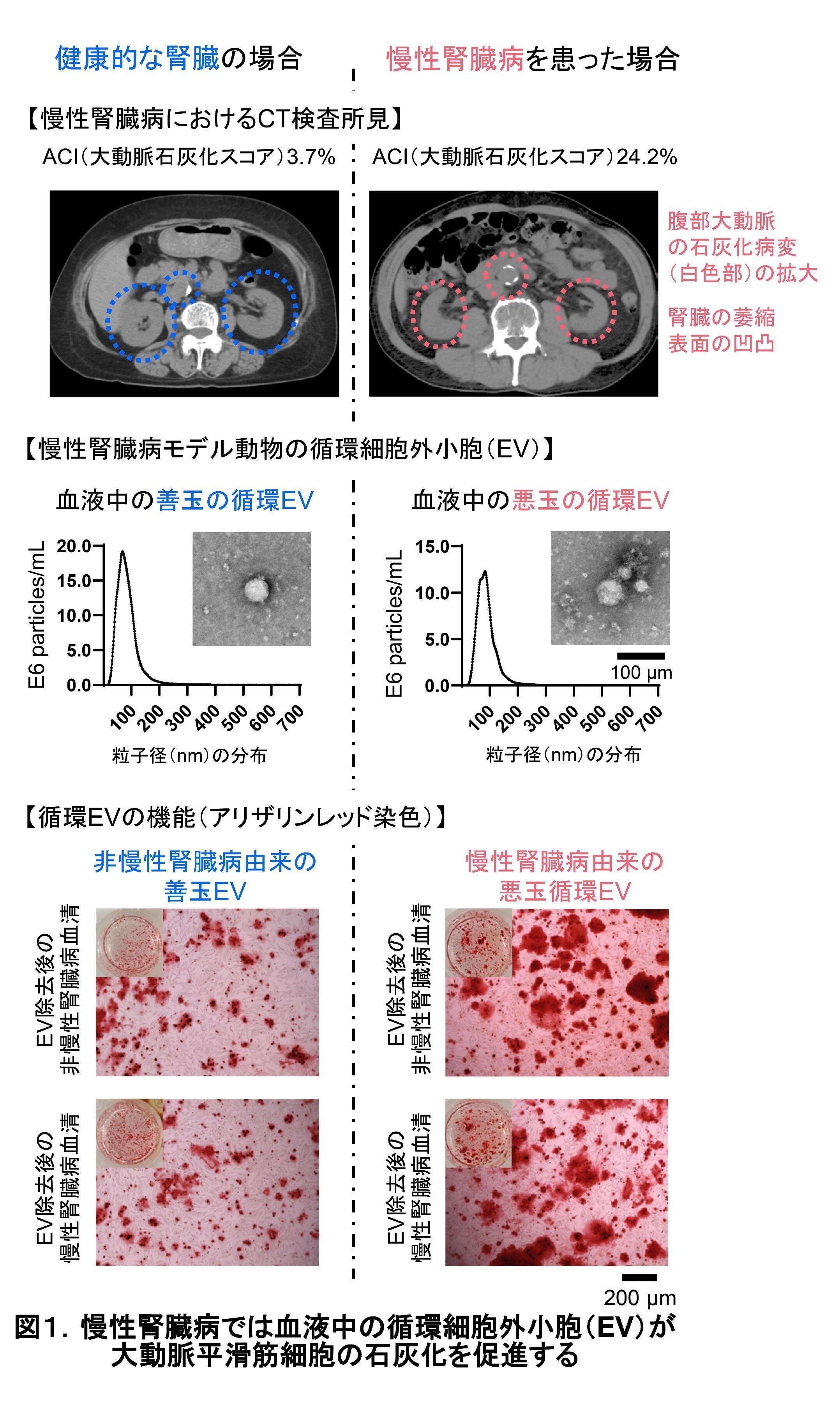
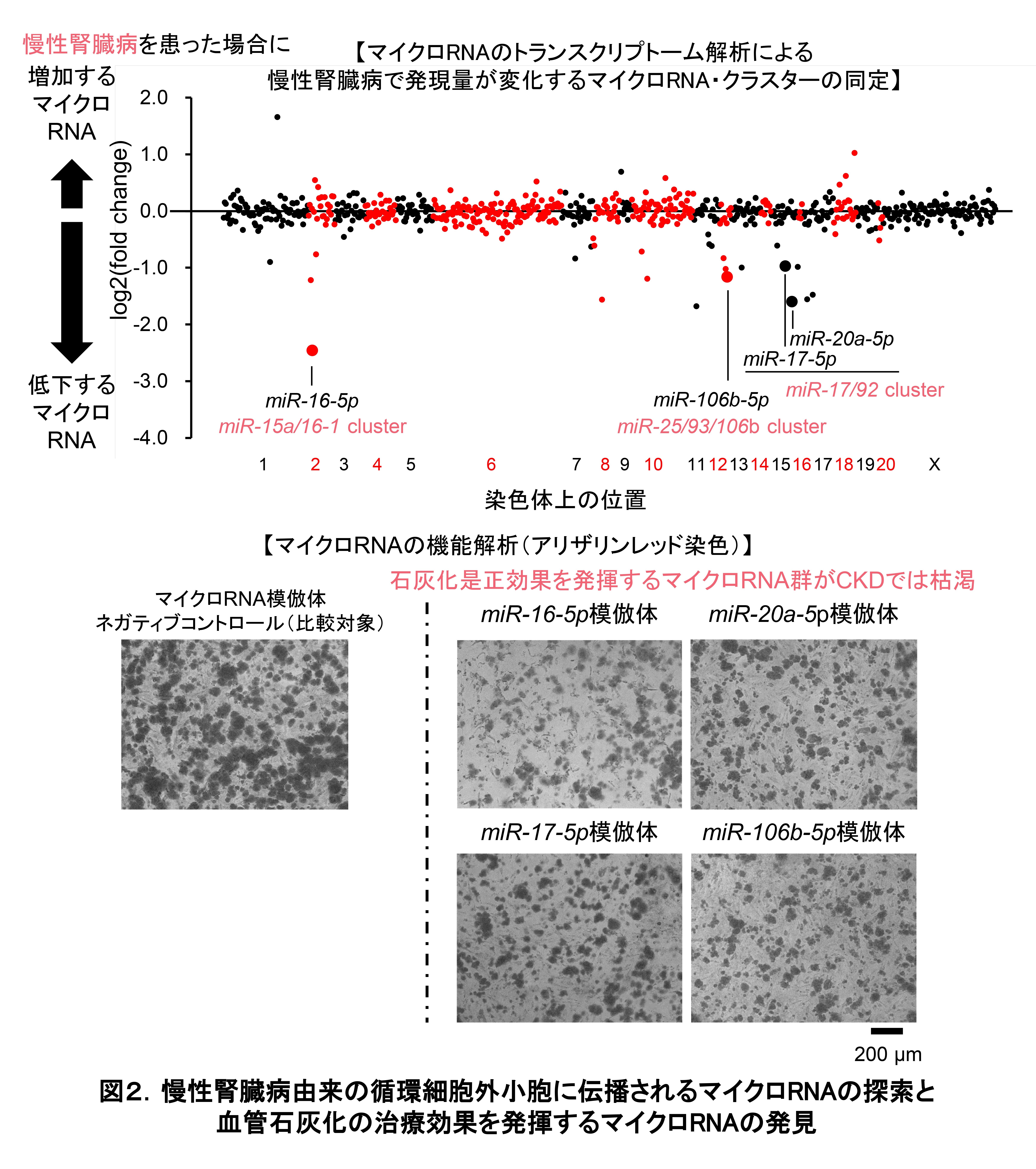
CKDモデルラットの循環EVを用いてマイクロRNAのトランスクリプトーム解析(遺伝子発現量の網羅的な定量化)を行いました。マイクロRNAの染色体上の位置、クラスター情報を加味した解析を駆使することで、血管平滑筋の形質転換・石灰化に関与する複数のマイクロRNAを発見しました(図2)。具体的に、CKD由来のEVでは、血管石灰化の是正効果のあるmiR-16-5p、miR-17~92クラスター由来のmiR-17-5p/miR-20a-5p、miR-106b-5pの4種類の発現量が低下することがわかりました。さらに、実際のCKD患者コホート研究においても、腎機能がおとろえるにつれて、これらのマイクロRNAが循環EVに枯渇することが明らかになりました。
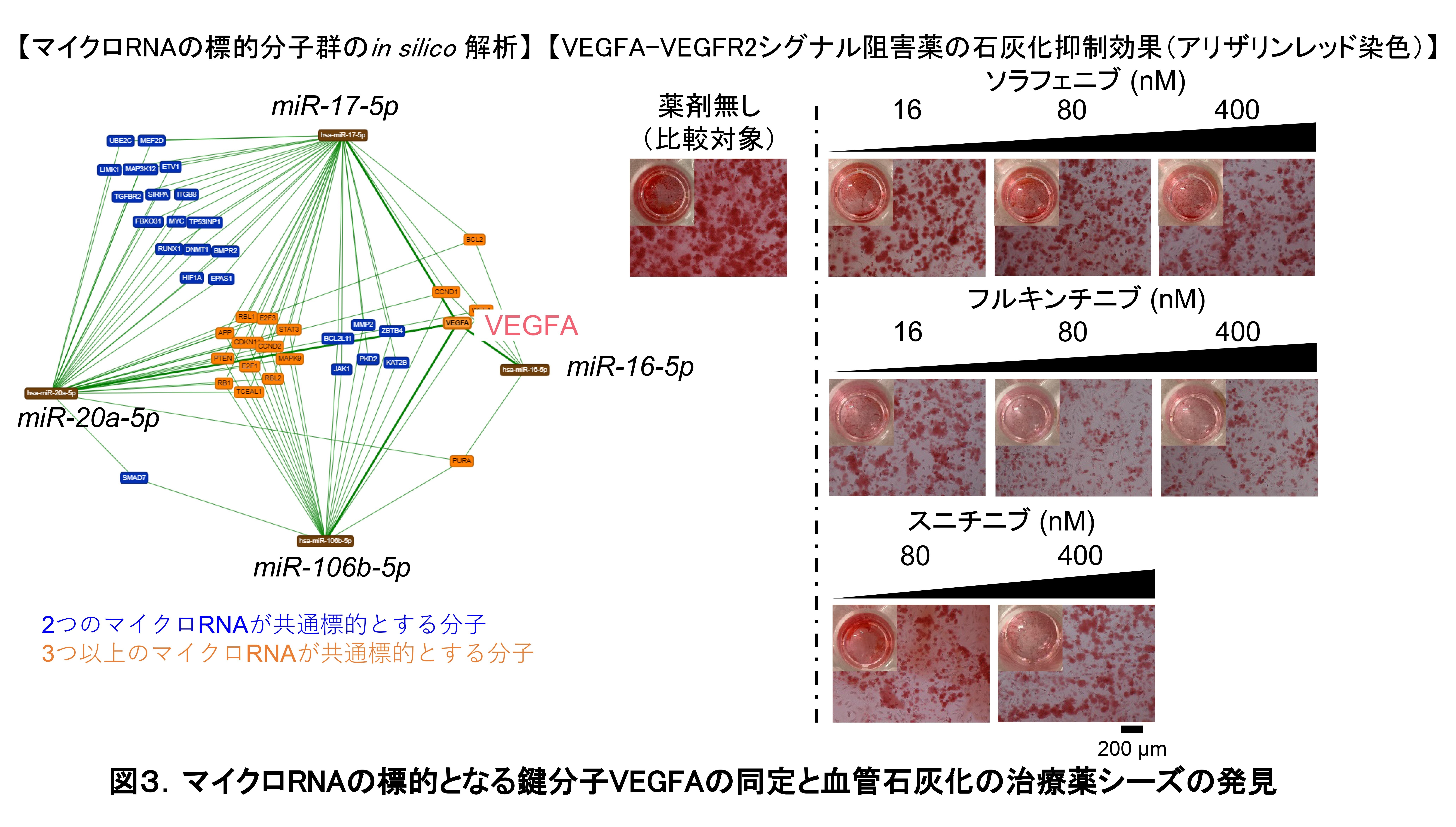
さらに、国内外で抗がん剤として認可、使用されるVEGFR1/2阻害剤ソラフェニブ、フルキンチニブ及びスニチニブをA10細胞に投与すると、A10細胞の石灰化が抑制されました(図3右)。最も効果の高かったフルキンチニブをCKD・血管石灰化モデルマウスに4週間経口投与すると、大動脈の骨形成遺伝子群の発現が抑制されることが分かりました。これらの薬剤が新たな動脈硬化の治療薬シーズとなることが期待されます。
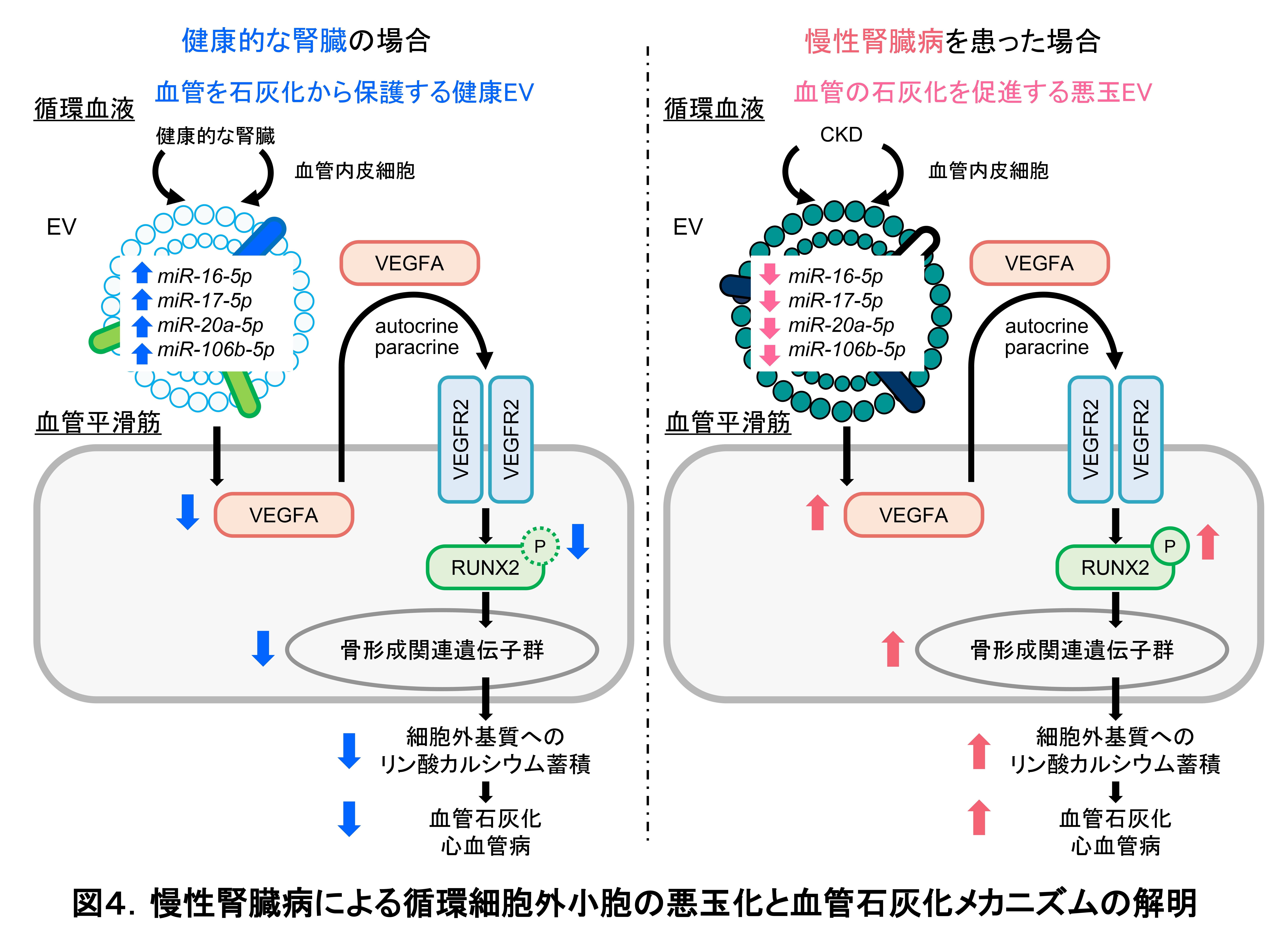
研究成果の意義
血管石灰化は心筋梗塞や脳梗塞などの心血管疾患を引き起こす原因となっており、生命寿命と健康寿命に直結する重要な問題です。しかしながら、近年までに開発されてきた降圧薬、抗凝固薬、脂質異常症治療薬や、血管石灰化の原因とされるカルシウムやリンを調整するCKD-MBD治療薬(経口リン吸着薬やカルシウム受容体作動薬)は完全に治療することはできません。今回の研究がつきとめた、悪玉EV、鍵となるマイクロRNA、マイクロRNAの標的であるVEGFAシグナルの3通りの新しいタイプの治療薬シーズが、今後のさらなる研究で実装可能となり、血管石灰化と心血管病を克服できることが期待されます。
本研究は循環EVの内包物としてマイクロRNAに着目しましたが、これ以外にも多様な分子群を解析する必要があり、この課題に現在取り組んでいます。今後の循環EVの内包物と役割を全容解明し、より生体に副作用の少ない、これまでにない治療戦略を構築していくことを目標にしています。
用語解説
※2 EV・・・・・・・・EV(small extracellular vesicles)は、エクソソームとも呼ばれる、生体のほぼすべての種類の細胞が分泌する40-150 nmの小型の膜小胞である。EVはタンパク質、脂質、RNAなど多彩な機能性分子を内包しながら高濃度で血液中を循環する。EVに伝播されたマイクロRNAが標的細胞内で実際に機能することが分かって以来4)、世界的に多くの研究が実施され、有望なドラッグデリバリーツールとしても注目されている。
※3 マイクロRNA・・・・・・・・22塩基長前後の短いnon-coding RNA(ncRNA)の1種で、ヒトや様々な生物種間で塩基の配列が高度に保存されています。標的となるメッセンジャーRNA(mRNA)の3’非翻訳領域(3’-UTR)に結合して、mRNAの翻訳抑制または分解を調整し、標的遺伝子の発現を制御します。がんを始めとした様々な疾患領域で、創薬モダリティーとして注目されている。
参考文献
2) Nakano Y, Mandai S, Genma T, Akagi Y, Fujiki T, Ando F, Susa K, Mori T, Iimori S, Naito S, Sohara E, Uchida S, Fushimi K, Rai T. Nationwide mortality associated with perioperative acute dialysis requirement in major surgeries. Int J Surg. 2022; 104: 106816.
3) Kalluri R, LeBleu VS. The biology, function, and biomedical applications of exosomes. Science. 2020; 367(6478): eaau6977.
4) Valadi H, Ekström K, Bossios A, Sjöstrand M, Lee JJ, Lötvall JO. Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells. Nat Cell Biol. 2007; 9(6): 654-9.
論文情報
掲載誌:Circulation Research
論文タイトル:Circulating Extracellular Vesicle-Propagated microRNA Signature as a Vascular Calcification Factor in Chronic Kidney Disease
DOI:https://doi.org/10.1161/CIRCRESAHA.122.321939
研究者プロフィール

萬代新太郎 (マンダイ シンタロウ) SHINTARO MANDAI
東京医科歯科大学 大学院医歯学総合研究科 腎臓内科学分野
東京医科歯科大学 病院血液浄化療法部 助教
・研究領域
腎臓 水・電解質輸送 サルコペニア 血管障害

東京医科歯科大学 大学院医歯学総合研究科
腎臓内科学分野 教授
・研究領域
腎臓 水・電解質輸送

東京医科歯科大学 大学院医歯学総合研究科
腎臓内科学分野 大学院生
・研究領域
腎臓 水・電解質輸送 血管障害
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
腎臓内科学分野 萬代新太郎(マンダイ シンタロウ)
内田信一(ウチダ シンイチ)
E-mail: smandai.kid[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

