「抗アミロイドβオリゴマー抗体を内包した血液脳関門通過型ナノマシンによる脳内毒性アミロイド種の除去効果」【横田隆徳 教授、三條伸夫 特任教授】
公開日:2023.1.31
「抗アミロイドβオリゴマー抗体を内包した血液脳関門通過型ナノマシンによる
脳内毒性アミロイド種の除去効果」
― アルツハイマー病治療の更なる進歩 ―
脳内毒性アミロイド種の除去効果」
― アルツハイマー病治療の更なる進歩 ―
ポイント
- 研究グループが独自に開発したアミロイド・ベータ・オリゴマーに対する断片化抗体と、独自に開発した血液脳関門を効率的に通過する「ナノマシン」を組み合わせ、抗体内包ナノマシンを作製し、アルツハイマー病のモデルマウスへ投与したところ、断片化抗体はマウスの血液脳関門を約80倍多く通過し、神経毒性のある複数のアミロイド種を除去し、脳の病理学的変化や認知機能の低下を抑制することができました。
- アルツハイマー病の先制医療として、病初期に脳内に十分な抗体を供給すること、ひとつの抗体で神経毒性のある複数のアミロイド種を除去できること、抗体を断片化することでアミロイド関連画像異常による脳出血の予防の可能性があることなど、これまでの抗体療法よりも安全で、効果的な治療法の開発への発展が期待されます。
- わが国の高齢化に伴い、認知症、特にアルツハイマー型認知症は増加しており、米国のFDAで承認されたアデュカヌマブ、レカネマブに続く、より有効で安全な疾患修飾薬および高効率な抗体医薬の脳への薬剤供給システムの需要が高まっており、本研究の成果は、それらの課題に合致した成果であり、将来の認知症予防治療の方向性を示唆する可能性があります。
この研究は日本医療研究開発機構 AMED の脳科学研究戦略推進プログラム事業における研究課題「血液脳関門通過型抗アミロイドβオリゴマー抗体の創生によるアルツハイマー病の分子イメージング診断、治療法の開発及び発症メカニズムの解明」(研究代表者:横田隆徳)、文部科学省科学研究費補助金事業「アルツハイマー病治療とコンパニオン診断における定量的根拠の解明」(研究代表者:三條伸夫)の支援のもとでおこなわれたもので、その研究成果は、国際科学誌Journal of Nanobiotechnology(ジャーナル オブ ナノバイオテクノロジー)に、2023年1月31日にオンライン版で発表されました。
研究の背景
アルツハイマー病(AD)は、認知症を引き起こす最も一般的な神経変性疾患であり、アミロイド・ベータ・タンパク質(Aβ)※1の凝集・沈着や神経細胞死、異常タウタンパク質の蓄積を特徴とします。Aβの中でも、Aβオリゴマー※2(Aβの比較的少数の単量体から構成される重合体)や、ピログルタミル化※3Aβ (構成するアミノ酸配列の特殊な修飾により強い毒性を示す) などの毒性Aβ種は、認知機能低下を引き起こし、AD病態に関与することが明らかになっており、近年注目されています。
現在使用されているAD症状改善薬は一時的な認知機能低下を抑制するのみであることから、疾患修飾薬としてAβに対する抗体を投与する治療法が期待されてきましたが、臨床試験のほとんどは成功に至っておりません。いくつかの理由が推測されていますが、そのひとつに、通常の抗体は分子量が大きいため、末梢静脈から投与した際に、血管から脳へ移動する際のバリアとして働く血液脳関門※4を通過できず、脳に到達できる抗体の量が極めて少ないことがあげられます。
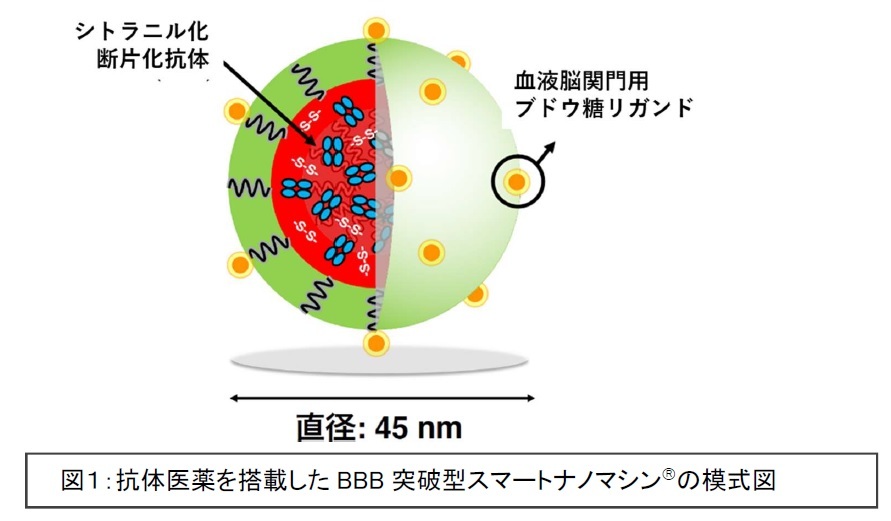
研究グループは空腹時から食事摂取に伴う血液脳関門のブドウ糖輸送体分子の血液側から脳側への生理学的な移動(トランスサイトーシス)を利用して、ブドウ糖分子で高分子ミセル表面を修飾することで、血液脳関門を通過して脳内に薬物を送達できるメカニズムを考案し(Nat Commun 2017;8:1001-1003)、さらに断片化抗体※5分子をシトラコニル化※6することにより内包を可能にした 血液脳関門突破型スマートナノマシン(図1)を開発してきました(ACS Nano 2020;14:6729-6742)。
最近、本研究グループはこの技術を応用してAβオリゴマーに特異的な新規開発抗体(オリゴマー抗体)の断片化抗体を搭載したナノマシンを開発し、AD病態出現初期に投与した場合の治療有効性を生化学的、病理学的、行動解析で評価しました。
現在使用されているAD症状改善薬は一時的な認知機能低下を抑制するのみであることから、疾患修飾薬としてAβに対する抗体を投与する治療法が期待されてきましたが、臨床試験のほとんどは成功に至っておりません。いくつかの理由が推測されていますが、そのひとつに、通常の抗体は分子量が大きいため、末梢静脈から投与した際に、血管から脳へ移動する際のバリアとして働く血液脳関門※4を通過できず、脳に到達できる抗体の量が極めて少ないことがあげられます。
研究グループは空腹時から食事摂取に伴う血液脳関門のブドウ糖輸送体分子の血液側から脳側への生理学的な移動(トランスサイトーシス)を利用して、ブドウ糖分子で高分子ミセル表面を修飾することで、血液脳関門を通過して脳内に薬物を送達できるメカニズムを考案し(Nat Commun 2017;8:1001-1003)、さらに断片化抗体※5分子をシトラコニル化※6することにより内包を可能にした 血液脳関門突破型スマートナノマシン(図1)を開発してきました(ACS Nano 2020;14:6729-6742)。
最近、本研究グループはこの技術を応用してAβオリゴマーに特異的な新規開発抗体(オリゴマー抗体)の断片化抗体を搭載したナノマシンを開発し、AD病態出現初期に投与した場合の治療有効性を生化学的、病理学的、行動解析で評価しました。
研究成果の概要
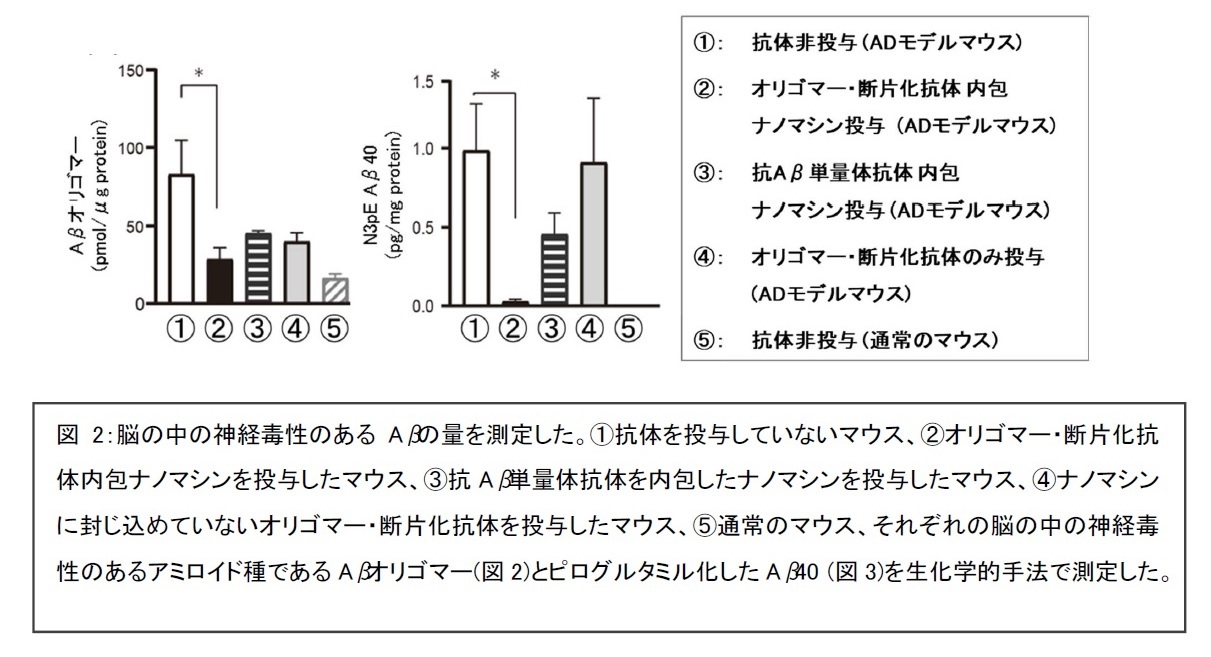
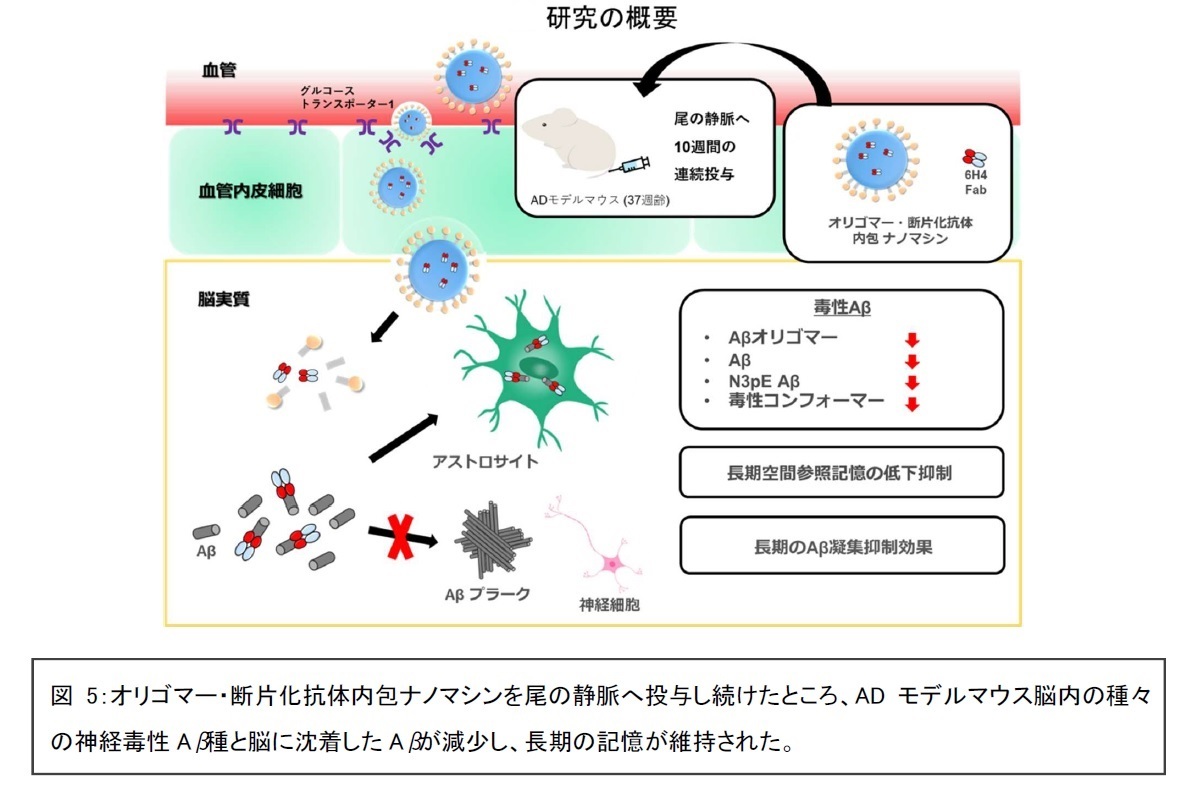
研究グループが独自に開発した「ナノマシン」の内部に「Aβオリゴマーの構造を特異的に認識する新規開発抗体(オリゴマー抗体)」を断片化した抗体を封じ込めた薬剤(オリゴマー・断片化抗体内包ナノマシン)を、Aβが脳に沈着し始める時期にADモデルマウスの尾の静脈から、10週間連続して投与を行いました。ナノマシンに封じ込めていないオリゴマー・断片化抗体を尾の静脈から投与した場合に比べ、約80倍量の抗体が脳の中に入ることが確認され、薬剤投与中にマウスには特に脳炎のような異常は見られませんでした。投与終了後に認知機能を評価するため、マウスを泳がせて目的地に達する試験を行い、その後、脳を取り出して、薬剤で染めてAβの沈着の様子を調べたり、脳をすりつぶして脳の中の成分を調べました。
脳の中の成分を調べる検査では、神経毒性のあるAβオリゴマー、神経毒性の高いAβの一種であるAβ42、ピログルタミル化Aβ(N3pE Aβ)、毒性Aβコンフォーマー※7など種々の強い神経毒性を有するAβ種の量が顕著に減少していることが確認されました(図2, 3)。
脳の中の成分を調べる検査では、神経毒性のあるAβオリゴマー、神経毒性の高いAβの一種であるAβ42、ピログルタミル化Aβ(N3pE Aβ)、毒性Aβコンフォーマー※7など種々の強い神経毒性を有するAβ種の量が顕著に減少していることが確認されました(図2, 3)。
また、脳の組織を薬品で染める解析方法において、脳内に沈着したAβ(Aβプラーク)の大きさや数が増えず、Aβが凝集体を形成する際に重要な核構造(コア)の形成も阻止することが確認されました(図3)。

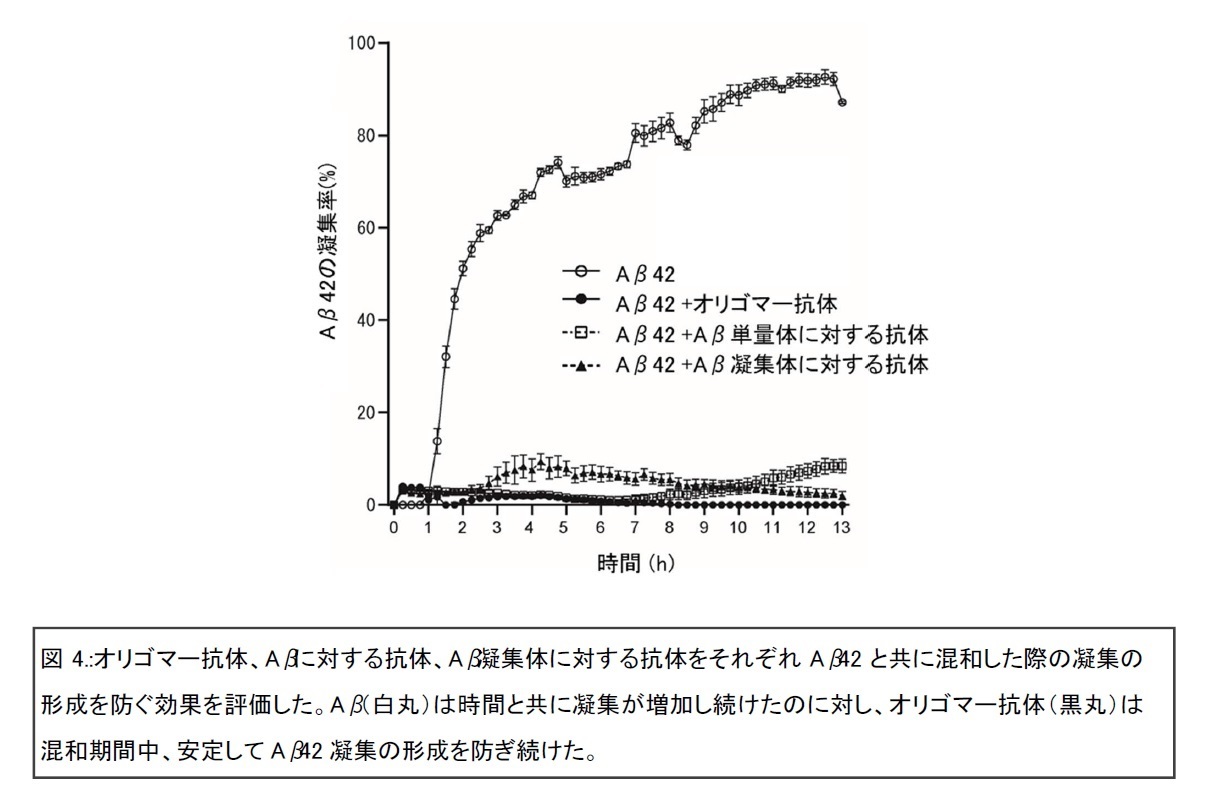
さらに、マウスを泳がせて目的地に達する行動を解析したところ、目的地の記憶が長期に維持される効果が観察されました。また、オリゴマー抗体の有効性を詳細に解析したところ、神経毒性の強いAβ42を長期間安定して凝集させない効果があることもわかりました(図4)。
通常の抗体では、Fc部位と※8呼ばれる部位は、抗体が標的に結合して複合体を形成したのちに、補足する細胞(貪食細胞)へ取り込まれたり、炎症反応を引き起こす役割をしますが、本研究グループでは、このFc部位を有していない断片化抗体を用いています。この場合、通常の抗体とは異なった経路で複合体が処理をされ、本研究では神経系を構成する星状膠細胞(アストロサイト)により貪食されることを確認いたしました。
したがって、「オリゴマー・断片化抗体内包ナノマシン」をマウスの尾の静脈から投与すると、十分量の断片化抗体が脳内に入り、沈着したアミロイドのみならず、沈着していない種々の神経毒性アミロイド種を減らすことができることが示されました(図5)。さらに、断片化抗体を利用する利点として、Fc部位を介して惹き起こされる炎症反応に関連していると考えられているアミロイド関連画像異常(Amyloid-related imaging abnormalities; ARIA)を回避できる可能性があることも考えられます。
したがって、「オリゴマー・断片化抗体内包ナノマシン」をマウスの尾の静脈から投与すると、十分量の断片化抗体が脳内に入り、沈着したアミロイドのみならず、沈着していない種々の神経毒性アミロイド種を減らすことができることが示されました(図5)。さらに、断片化抗体を利用する利点として、Fc部位を介して惹き起こされる炎症反応に関連していると考えられているアミロイド関連画像異常(Amyloid-related imaging abnormalities; ARIA)を回避できる可能性があることも考えられます。
研究成果の意義
アルツハイマー病の初期に脳内に十分な抗体を供給するシステムを開発し、あらたに開発した抗体は単独で種々の神経毒性アミロイド種を除去することができ、投与する抗体を断片化することでアミロイド関連画像異常の予防の可能性があることなど、これまでの抗体療法よりも安全で、効率的な治療法の開発への発展が期待されます。
わが国の高齢化に伴い、認知症、特にアルツハイマー型認知症は増加しており、米国食品医薬品局 (Food and Drug Administration, FDA)で承認されたAβプラーク認識抗体のアデュカヌマブ、Aβプロトフィブリル(高分子のAβオリゴマー)認識抗体のレカネマブに続く、有効で安全な疾患修飾薬、および高効率な脳への薬剤供給システムの需要が高まっています。研究グループの独自に開発した抗Aβオリゴマーの構造を特異的に認識する断片化抗体を用いた本研究の成果は、現在の抗体医薬の有効性を高め、副作用を回避できることが期待され、将来の認知症予防治療の方向性を示唆する可能性があります。
わが国の高齢化に伴い、認知症、特にアルツハイマー型認知症は増加しており、米国食品医薬品局 (Food and Drug Administration, FDA)で承認されたAβプラーク認識抗体のアデュカヌマブ、Aβプロトフィブリル(高分子のAβオリゴマー)認識抗体のレカネマブに続く、有効で安全な疾患修飾薬、および高効率な脳への薬剤供給システムの需要が高まっています。研究グループの独自に開発した抗Aβオリゴマーの構造を特異的に認識する断片化抗体を用いた本研究の成果は、現在の抗体医薬の有効性を高め、副作用を回避できることが期待され、将来の認知症予防治療の方向性を示唆する可能性があります。
用語解説
-
※1アミロイドβ:
アミロイドβ(Aβ)は一回膜貫通型アミロイド前駆タンパク質から、アミド基末端をβ-セクレターゼ、カルボキシル基末端をγ-セクレターゼに切断されて生じる40-42個のアミノ酸からなるペプチドである。毒性を示すAβの脳内沈着がアルツハイマー病の最初期病変で、Aβの凝集体が細胞外に蓄積することがきっかけで、脳の萎縮や神経細胞死に関連するとする「アミロイド カスケード仮説」が支持されている。強い神経毒性をもつオリゴマー、ピログルタミル化されたアミロイド、毒性コンフォーマーを有するアミロイドなどの神経毒性のあるアミロイドによる影響が注目されている。
※2オリゴマー:
比較的少数の分子が重合したもので、アミロイドの場合はAβオリゴマーと呼ばれる。
※3ピログルタミル化:
タンパク質のアミノ基末端がグルタミン残基のペプチドで、グルタミン側鎖の脱アミドとアミノ基への縮合が生じ、環状のピログルタミル残基が生成された状態で、アミロイドβの場合、第 1,第 2 アミノ酸残基の切断と第 3 残基のグルタミン酸が環状構造にピログルタミル化を受けた 3pE 型のアミロイドβ(N3pE Aβ)は強い毒性を示す。
※4血液脳関門(Blood brain barrier; BBB):
脳と脳を栄養する血管との間には、血管の内皮細胞を主体とした物質輸送の制御を担う血液脳関門(BBB)と呼ばれる選択機能が存在し、脳の中に入る外因物質を選択し、脳に毒性のある成分から脳を保護している。BBBは必須栄養素を選択的に透過させる一方で、水溶性の高い物質やタンパク質などの大きな分子は透過し難いことが知られており、脳内に薬剤を送達させるにはBBBを効率的に透過する必要がある。
※5断片化抗体:
免疫グロブリンタンパク質構造の特定部分を酵素等で消化または切断して得られる、抗原結合性を有する部位のみを切り出して抗体として利用すること。Fab(Fragment antigen binding)と呼ばれる。
※6シトラコニル化:
シトラコニル酸を用いてタンパク質(断片化抗体)の電荷を変えてスマートナノマシンに包含させ、細胞内のエンドソームの酸性環境下でタンパク質を遊離させることが可能となる。
※7毒性コンフォーマー:
アミノ酸配列の22番目のグルタミン酸と23番のアスパラギン酸付近においてターン構造を有し、強い毒性があるとされる特殊な構造のアミロイドβ42のこと。
※8Fc部位:
免疫グロブリンタンパク質構造を酵素等で消化または切断して得られる、抗原へ結合しない部位の断片。免疫細胞の表面上にある Fc受容体への結合などによって、免疫シグナルの伝達に重要な役割を担う。
論文情報
掲載誌:Journal of Nanobiotechnology
論文タイトル: Peripheral administration of nanomicelle-encapsulated anti-Aβ oligomer fragment antibody reduces various toxic Aβ species in the brain
DOI:https://doi.org/10.1186/s12951-023-01772-y
研究者プロフィール

横田隆徳 (ヨコタ タカノリ) Takanori Yokota
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科)教授

三條伸夫 (サンジョウ ノブオ) Nobuo Sanjo
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任教授
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任教授

天野晶子 (アマノ アキコ) Akiko Amano
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任研究員
東京医科歯科大学 大学院医歯学総合研究科
脳神経病態学分野(脳神経内科) 特任研究員
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
脳神経病態学分野 横田隆徳(ヨコタ タカノリ)
三條伸夫(サンジョウノブオ)
E-mail:yokonuro[@]tmd.ac.jp, n-sanjp.nuro[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

