「 オートファジー成熟過程を可視化する新規手法の開発 」【桜井一 プロジェクト助教、清水重臣 教授】
公開日:2023.1.12
「 オートファジー成熟過程を可視化する新規手法の開発 」
― 2種類のオートファジー経路を同時に可視化する手法の研究 ―
― 2種類のオートファジー経路を同時に可視化する手法の研究 ―
ポイント
- オートファジー活性化に伴うナノスケールの膜動態変化を簡便に検出する手法を新規開発しました。
- 長らく謎であった2種類のオートファジーの使い分けを明らかにしました。
- オートファジー関連疾患の新規治療薬開発への応用が期待できます。
研究の背景
大隅先生らの研究グループが発見し、2016年にノーベル賞を受賞されたオートファジーと呼ばれる生理現象は、飢餓や様々なストレスに応じて細胞が自身の成分の一部を分解する機構です。飢餓の際には余剰な細胞成分を分解して栄養源にし、細胞内の構成器官に問題が生じた際には当該器官だけを分解することで問題の解決に寄与しております。近年ではオートファジーと様々な疾患との関連が続々と報告されてきており、オートファジー実行に関わる基盤機構の解明は非常に重要であることが窺えます。
細胞がオートファジーによって自己成分を分解する際には、分解したいものだけを隔離膜と呼ばれる膜で包んで隔離する機構があります。細胞の中にはオートファジーで分解してはいけない重要な器官もあるため、この隔離膜による隔離機構の解明は非常に重要な課題となっておりました。隔離膜は餃子の皮のような形状をしており、分解標的を包み込むように形態変化することが電子顕微鏡観察より明らかにされております。これまでは隔離膜に着目して隙間なく閉じているか評価することで実際に隔離が完了したのかを判断しておりましたが、最小で10nm以下の非常に小さな分子を隔離する場合もあり、超高性能な顕微鏡を駆使しても10nm以下の穴の有無を評価するのは困難な状況でした。そこで我々の研究グループでは、隔離膜ではなく包まれる内包物に着目しました。極小の蛍光分子を隔離膜内に入れ、蛍光分子が漏れ出ていないことで隔離膜に穴が開いておらず、しっかりと閉じた構造になっていることを証明する新たな実験系の構築を目指しました。
細胞がオートファジーによって自己成分を分解する際には、分解したいものだけを隔離膜と呼ばれる膜で包んで隔離する機構があります。細胞の中にはオートファジーで分解してはいけない重要な器官もあるため、この隔離膜による隔離機構の解明は非常に重要な課題となっておりました。隔離膜は餃子の皮のような形状をしており、分解標的を包み込むように形態変化することが電子顕微鏡観察より明らかにされております。これまでは隔離膜に着目して隙間なく閉じているか評価することで実際に隔離が完了したのかを判断しておりましたが、最小で10nm以下の非常に小さな分子を隔離する場合もあり、超高性能な顕微鏡を駆使しても10nm以下の穴の有無を評価するのは困難な状況でした。そこで我々の研究グループでは、隔離膜ではなく包まれる内包物に着目しました。極小の蛍光分子を隔離膜内に入れ、蛍光分子が漏れ出ていないことで隔離膜に穴が開いておらず、しっかりと閉じた構造になっていることを証明する新たな実験系の構築を目指しました。
研究成果の概要
本研究では、隔離させる極小分子としてGFP※1やRFP※2のような蛍光タンパク質に着目いたしました。これらの蛍光タンパク質は長年数多くの研究にて使用されており、様々な研究対象分子に付与されることで対象分子の細胞内動態の可視化に貢献してきました。その実績より、これらの蛍光タンパク質自身だけの状態では細胞内で特殊な応答などはせずに細胞中に一様に存在できることが知られております。我々の研究グループでは、この蛍光タンパク質単体での性質を鑑み、隔離膜の中にも存在するのではないかと考えました(図左)。隔離膜に包み込まれた蛍光タンパク質と、それ以外の蛍光タンパク質を区別するためにフォトブリーチ※3の手法を用い、細胞内を自由拡散できる、隔離膜に包まれていない蛍光タンパク質だけを消光するとねらい通りにオートファジーによって隔離された蛍光タンパク質を可視化することに成功しました(図右)。蛍光タンパク質の大きさは10nm以下であるため、これらの蛍光が漏れ出さずに隔離されているという結果から隔離膜がきちんと閉じていることを証明し、この手法をFLAD(FLIP-based autophagy detection)と命名いたしました。
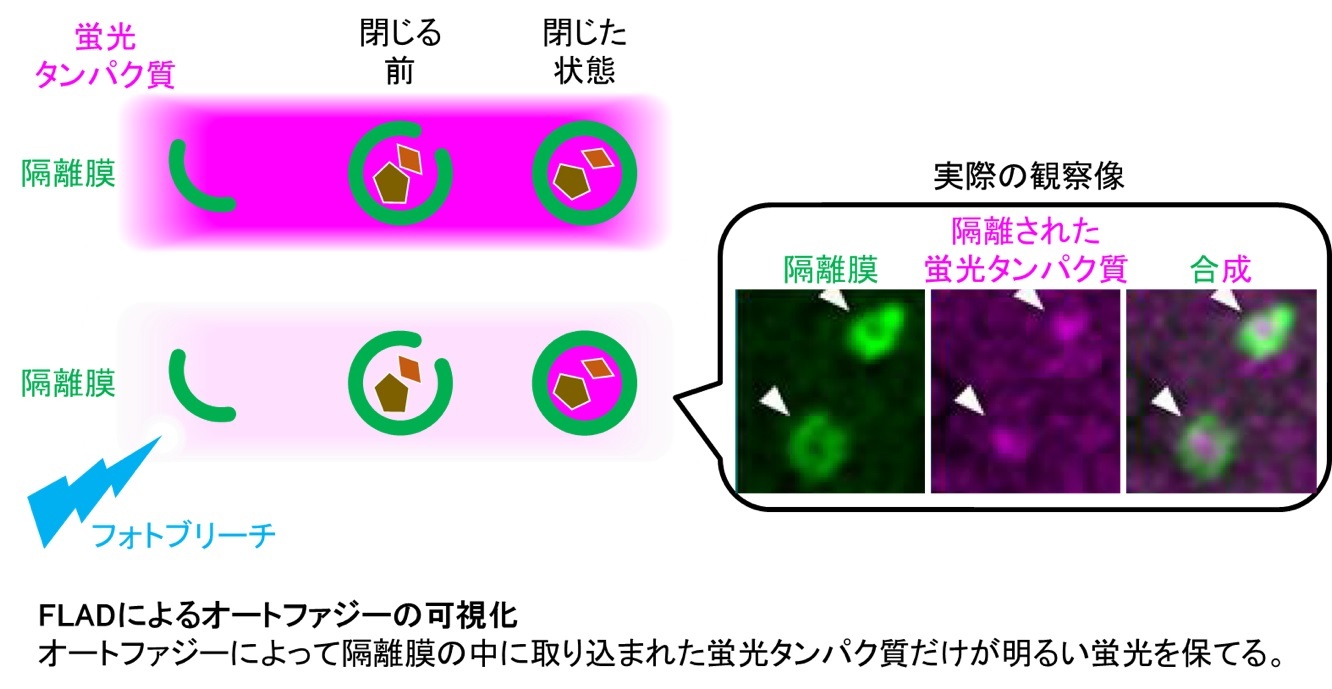
オートファジーは様々なストレスに応答して惹起されますが、ストレスの種類によって異なるメカニズムで実行されていることも明らかにされつつあります。中でも、抗がん剤などのDNA損傷ストレスによって誘導される新規オートファジーは従来型のオートファジー制御分子とは全く異なる分子群によって制御されることが知られており、既知のオートファジーマーカー分子も活用できないために研究が困難な状況でした。そこで、我々の研究グループでは、既知のオートファジー分子機構に依存しないオートファジー可視化手法であるFLADで、新規オートファジーを可視化できるのではないかと考えました。実際に新規オートファジーを誘導した際にも蛍光タンパク質が隔離される様子を検出することに成功し、本研究で開発したFLADでは今まで検出できていなかった様々なオートファジーを検出することが可能であることが証明できました。
最後に、FLADと従来型のオートファジー可視化手法を併用することで、2種類のオートファジーを同時に可視化することを試みました。FLADで両方のオートファジーを可視化しつつ、従来型のマーカー分子と比較することで2種類のオートファジーの活性化状況を評価すると、オートファジー誘導ストレスの種類によって異なる割合で誘導されていることが明らかになりました。
最後に、FLADと従来型のオートファジー可視化手法を併用することで、2種類のオートファジーを同時に可視化することを試みました。FLADで両方のオートファジーを可視化しつつ、従来型のマーカー分子と比較することで2種類のオートファジーの活性化状況を評価すると、オートファジー誘導ストレスの種類によって異なる割合で誘導されていることが明らかになりました。
研究成果の意義
これまで隔離膜が閉じているかどうかを判別するために高性能な顕微鏡と熟達した技術が必要でしたが、本研究の成果によって簡便に一般的な顕微鏡設備で隔離膜の膜動態をナノスケールで解析することが可能になりました。これまで解析が遅れていた隔離膜動態の研究が加速することが期待できます。
また、本研究成果によってこれまで困難であった新規オートファジーの可視化が簡便になりました。我々の先行研究から新規オートファジーは神経変性疾患との関連が深いことが明らかになっており、同疾患の機序の解明および新薬の開発への貢献が期待できます。さらに、同一細胞内における2種類のオートファジーの識別が可能になったことで、細胞が異なるオートファジー機構を使い分けていることを明らかにしました。一方のオートファジー経路の失調による疾患をもう一方のオートファジーを活性化することで機能補完するような治療法の開発に期待を持っております。
また、本研究成果によってこれまで困難であった新規オートファジーの可視化が簡便になりました。我々の先行研究から新規オートファジーは神経変性疾患との関連が深いことが明らかになっており、同疾患の機序の解明および新薬の開発への貢献が期待できます。さらに、同一細胞内における2種類のオートファジーの識別が可能になったことで、細胞が異なるオートファジー機構を使い分けていることを明らかにしました。一方のオートファジー経路の失調による疾患をもう一方のオートファジーを活性化することで機能補完するような治療法の開発に期待を持っております。
用語解説
※1GFP
オワンクラゲ由来の青色蛍光によって励起する緑色蛍光タンパク質。3~5 nm四方の大きさのタンパク質で、単独で細胞内に発現させると細胞質に局在する。
※2RFP
褐虫藻由来の緑色光によって励起する赤色蛍光タンパク質。GFPと同様のサイズと性質を持ち、蛍光顕微鏡観察に非常によく使用される。
※3フォトブリーチ
GFPやRFPのような蛍光タンパク質を強力に励起することで消光する技術。
オワンクラゲ由来の青色蛍光によって励起する緑色蛍光タンパク質。3~5 nm四方の大きさのタンパク質で、単独で細胞内に発現させると細胞質に局在する。
※2RFP
褐虫藻由来の緑色光によって励起する赤色蛍光タンパク質。GFPと同様のサイズと性質を持ち、蛍光顕微鏡観察に非常によく使用される。
※3フォトブリーチ
GFPやRFPのような蛍光タンパク質を強力に励起することで消光する技術。
論文情報
掲載誌:Scientific Reports
論文タイトル: FLIP-based autophagy-detecting technique reveals closed autophagic compartments
DOI:https://doi.org/10.1038/s41598-022-26430-5
研究者プロフィール

桜井 一 (サクライ ハジメ) Sakurai Hajime
東京医科歯科大学 難治疾患研究所
病態細胞生物分野 プロジェクト助教
・研究領域
オートファジー、細胞生物学

清水重臣 (シミズ シゲオミ) Shimizu Shigeomi
東京医科歯科大学 難治疾患研究所
病態細胞生物分野 教授
・研究領域
オルガネラバイオロジー、細胞生物学
東京医科歯科大学 難治疾患研究所
病態細胞生物分野 教授
・研究領域
オルガネラバイオロジー、細胞生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 難治疾患研究所
病態細胞生物学分野 教授 清水 重臣 (シミズ シゲオミ)
E-mail:shimizu.pcb[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

