「RNA結合タンパク質LIN28Aによる転写後調節を介した血管新生制御機構を解明」【淺原弘嗣 教授】
― 低酸素誘導因子HIF1αのRNA階層を介した新規制御メカニズムの発見 ―
ポイント
- 医学・生物学において注目されるLIN28Aを、低酸素誘導因子HIF1αの発現を上昇させるRNA結合タンパク質として発見しました。
- LIN28AがmRNA上の「UGAU」という標的配列に直接結合してmRNAを安定化させることでHIF1αのタンパク質の発現が上昇する新規制御メカニズムを示しました。
- LIN28Aは癌の血管新生を亢進させることを明らかにしました。
- RNA結合タンパク質による転写後調節を標的としたがんの病態解明と新規治療戦略への応用が期待されます。
東京医科歯科大学 大学院医歯学総合研究科 システム発生・再生医学分野の淺原弘嗣教授、栗本遼太講師、内田雄太郎MDPhDコース学生ら、および、東京医科歯科大学 大学院医歯学総合研究科 心肺統御麻酔学分野の内田篤治郎教授、山本寛人講師の研究グループは、福岡大学産科婦人科学の宮田康平准教授、東京農工大学工学研究院の稲田全規准教授ら、武蔵野大学人間科学部人間科学科の五島直樹教授との共同研究で、RNA結合タンパク質LIN28A※1がHIF1A mRNA上のUGAU配列への直接結合を介したmRNAの安定化により低酸素誘導因子HIF1α※2の発現を上昇させることで、癌の血管新生が亢進することを明らかにしました。この研究は、米国国立衛生研究所、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST、AMED-LEAP)、並びに文部科学省科学研究費補助金の支援のもとおこなわれたもので、その研究成果は、国際科学誌Journal of Biological Chemistryに、2022年12月9日にオンライン版で発表されました。
研究の背景
研究成果の概要
LIN28Aは癌の抑制に重要なmicroRNA let-7の分解を誘導することによって癌関連因子の発現を亢進させることが報告されています。しかし、本研究においては、let-7の分解をすることができないLIN28Aの変異体(ZFm)を用いた解析、およびlet-7の強制発現実験により、LIN28AによるHIF1αの発現上昇がlet-7の分解に依存しないこと、let-7がHIF1αの発現を制御しないことを明らかにしました。(図2)
そこで、LIN28AによるHIF1αの発現制御メカニズムを同定するために、RNA-SeqによるTranscriptome解析、核酸アナログであるチオウリジン (s4U)を用いたmRNAの分解速度をTranscriptome wideに定量する手法であるSLAM-Seq、およびRNA結合タンパク質が結合する領域をTranscriptome wideに同定する手法であるEnhanced crosslinking immunoprecipitation (eCLIP)法を用いることで、RNA結合タンパク質としての機能を統合的に解析しました。その結果として、LIN28AがHIF1A mRNAの3’UTR上のUGAUというcis-elementを認識してmRNAを安定化させることによってHIF1αの発現を亢進させることを明らかにしました。(図3)
最後に、LIN28AがHIF1αの発現を亢進させることによる生理的意義を探索するため、血管密度試験をヌードマウスに皮下移植した腫瘍に対して行ったところ、LIN28Aの発現によって血管新生が亢進している様子を明らかにしました。(図4)
これらの結果により、LIN28AがmicroRNA let-7の分解に非依存的に、UGAUモチーフを持ったcis-elementへの直接の結合を介してHIF1αを転写後制御することにより、癌の血管新生亢進に寄与することを明らかにしました。
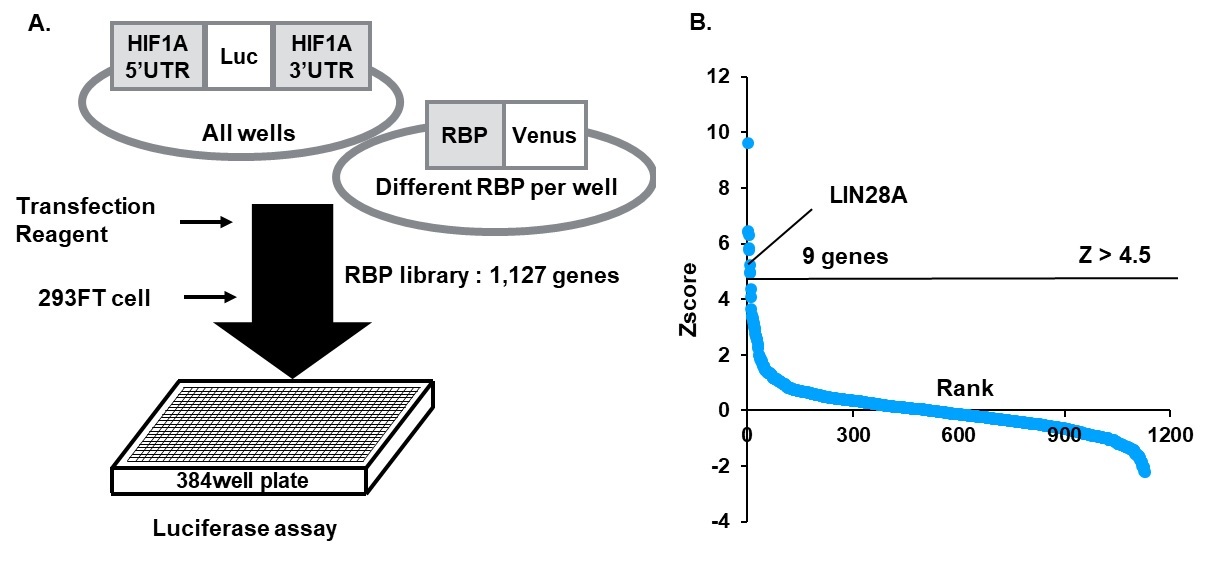
図1 HIF1αの転写後制御因子を探索するRNA結合タンパク質のスクリーニング
RNA結合タンパク質スクリーニングによりHIF1αの発現を上昇させる候補遺伝子としてLIN28Aを同定
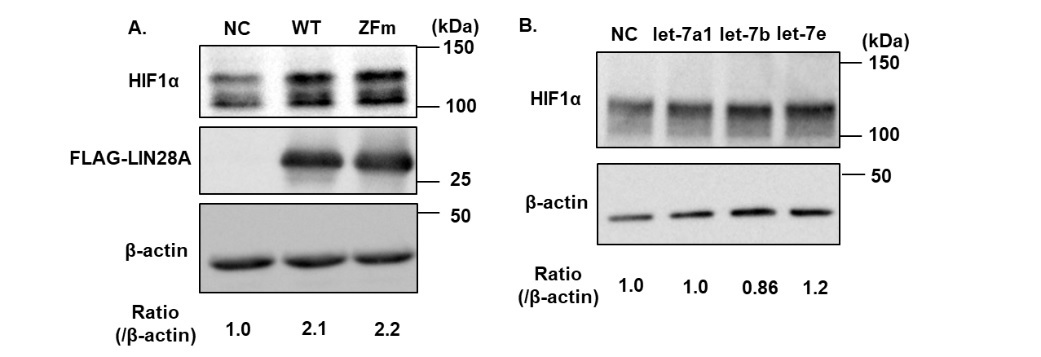
図2 LIN28Aの変異体およびlet-7を発現させたときのHIF1αタンパク質発現の定量
A. Negative Control (NC)、およびLIN28Aの野生型(WT)、let-7を分解できない変異体(ZFm)を発現したときのHIF1αタンパク質の発現変化をウエスタンブロッティングにより定量した。B. Negative Control (NC)、およびmicroRNA let-7を発現したときのHIF1αタンパク質の発現変化をウエスタンブロッティングにより定量した。
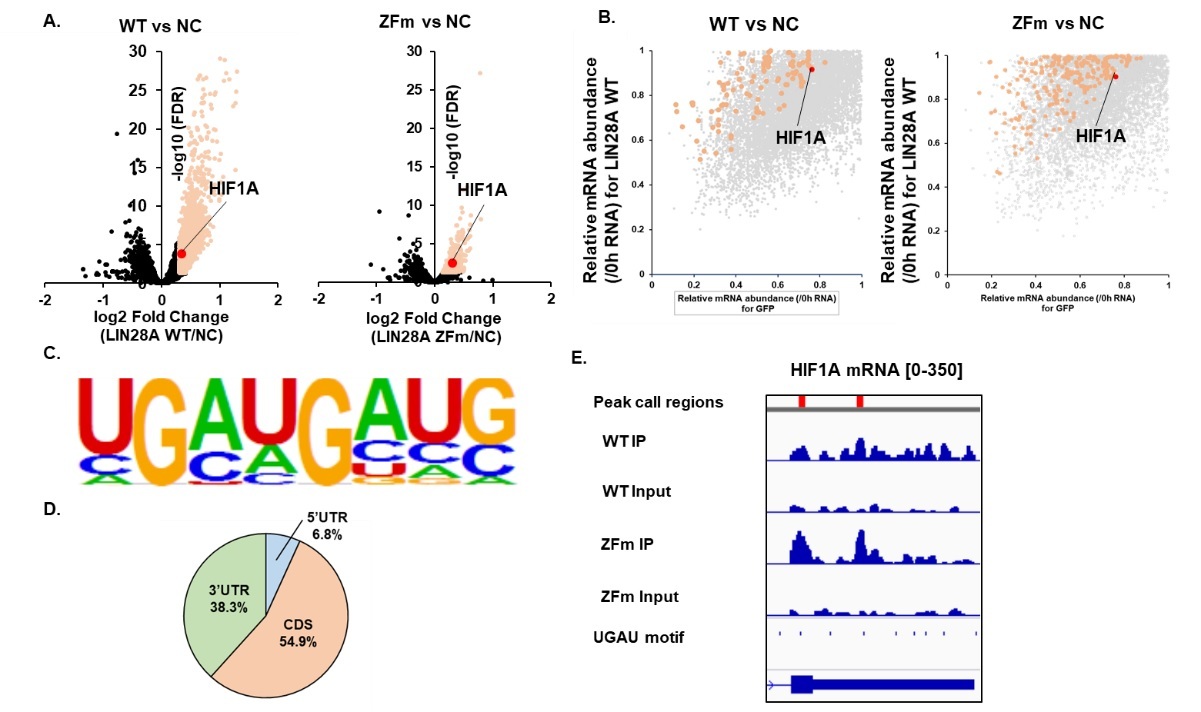
図3 RNA結合タンパク質としてのLIN28Aの統合的解析
A. Negative Control (NC)、野生型のLIN28A (WT)、および変異体のLIN28A (ZFm)を発現したときのTranscriptome解析 B. Negative Control (NC)、野生型のLIN28A (WT)、および変異体のLIN28A (ZFm)を発現したときのSLAM-SeqによるmRNAの安定性変化の解析 C. eCLIPより同定されたLIN28Aが結合する部位のモチーフ配列 D. eCLIPより同定されたLIN28Aが結合するmRNAの部位の分布図 E LIN28A (野生型、変異体)がHIF1Aに結合している部位とUGAUモチーフ配列部位の図示 (eCLIP)
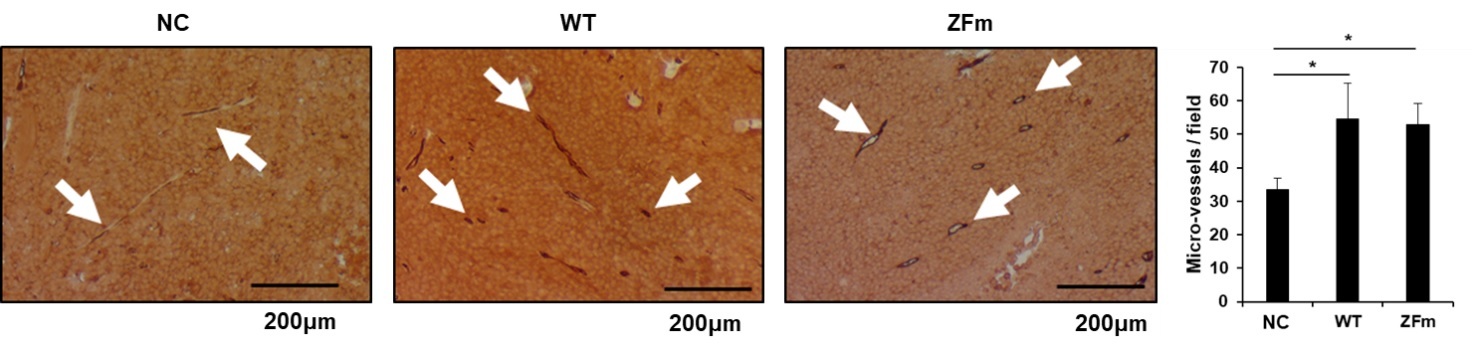
図4 皮下移植腫瘍に対する血管新生の評価
Negative Control (NC)、野生型のLIN28A (WT)、および変異体のLIN28A (ZFm)を発現させた細胞のマウスへの皮下移植モデルに対する血管新生の様子
研究成果の意義
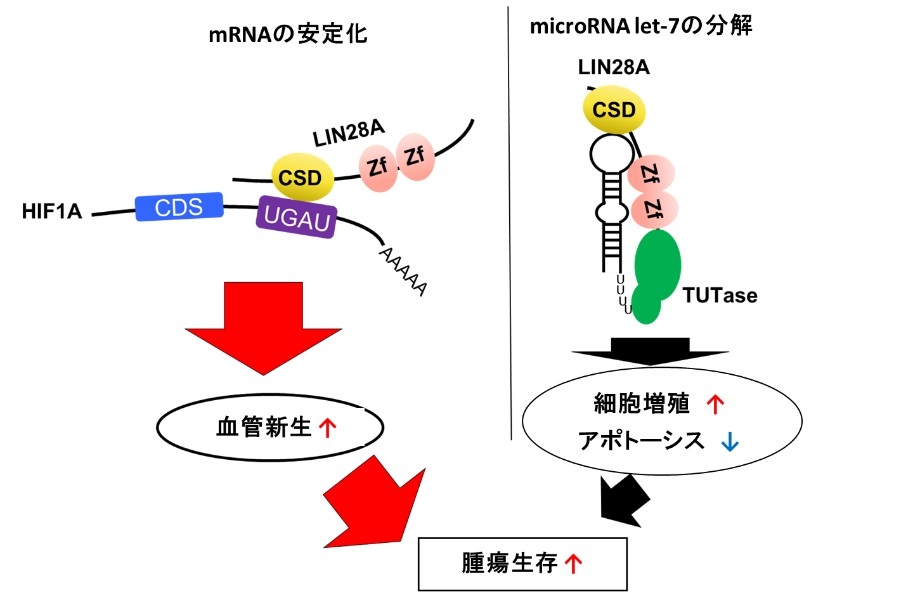
図5 本研究において解明されたメカニズム
用語解説
RNA結合タンパク質はmRNAに直接結合することでmRNAの安定化や翻訳制御、RNAの輸送、スプライシング制御に寄与することが知られている。LIN28AはRNA結合タンパク質の中でも最もよく知られているもののひとつで、腫瘍抑制microRNAとして知られる let-7の分解を誘導することで、幹細胞性の維持や腫瘍形成等に寄与することが知られている。
※2低酸素誘導因子HIF1α
低酸素環境下において発現が安定化することが知られる重要な転写因子である。血管新生やエリスロポエチンの産生など、低酸素条件に応答して個体の生存に必要な遺伝子群の発現を上昇させることが知られている。
※3cis-element
因子が直接結合することで標的遺伝子発現を調節することができる部位の総称。ここではRNA結合タンパク質が直接結合することで標的mRNAへの機能調節を行う部位のことを指す。
論文情報
掲載誌:Journal of Biological Chemistry
論文タイトル: RNA-binding protein LIN28A upregulates transcription factor HIF1α by post-transcriptional regulation via direct binding to UGAU motifs
DOI:https://doi.org/10.1016/j.jbc.2022.102791
研究者プロフィール

山本 寛人 (ヤマモト ヒロト) Hiroto Yamamoto
東京医科歯科大学 大学院医歯学総合研究科
心肺統御麻酔学 講師
・研究領域
分子生物学(遺伝子発現)、臨床麻酔学、周術期管理学

東京医科歯科大学 大学院医歯学総合研究科
システム発生再生医学分野 MDPhDコース学生(学部六年)
・研究領域
分子生物学(遺伝子発現学)、RNA生物学、がん生物学

東京医科歯科大学 大学院医歯学総合研究科
システム発生再生医学分野 講師
・研究領域
分子生物学(遺伝子発現学)、RNA生物学、がん生物学、実験病理学

東京医科歯科大学 大学院医歯学総合研究科
システム発生・再生医学分野 教授
・研究領域
分子生物学(遺伝子発現)、発生・再生医学、整形外科学、リウマチ学
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
システム発生・再生医学分野 淺原 弘嗣 (アサハラ ヒロシ)
E-mail:asahara.syst[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

