「膵癌におけるエピゲノム修飾酵素SETD1Aの悪性化メカニズム解明」【田中真二 教授】
公開日:2022.11.10
「膵癌におけるエピゲノム修飾酵素SETD1Aの悪性化メカニズム解明」
― 新規治療ターゲットとして有望なSETD1A-RUVBL1経路の同定 ―
― 新規治療ターゲットとして有望なSETD1A-RUVBL1経路の同定 ―
ポイント
- 膵癌の発生、進展にはエピゲノム異常が関わっていることが知られていますが、その分子メカニズムには不明な点が多く残っています。
- 本研究では、膵癌の半数以上でヒストンメチル化酵素SETD1Aが過剰発現し、癌促進因子RUVBL1遺伝子を発現亢進して、膵癌の悪性化に機能することを明らかにしました。
- SETD1AとRUVBL1の両方の発現が強い膵癌では患者の予後が悪いことがわかりました。
- 本研究により、SETD1A-RUVBL1を標的としたバイオマーカーおよび新規治療法開発への応用が期待されます。
東京医科歯科大学 大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、秋山好光講師、島田周助教、石井武大学院生の研究グループは、同肝胆膵外科学分野の田邉稔教授との共同研究で、膵癌においてヒストン修飾因子SETD1Aの高発現による下流標的遺伝子RUVBL1の活性化、および両方のタンパク質発現が高いことは予後因子になることをつきとめました。この研究は文部科学省科学研究費補助金、国立研究開発法人日本医療研究開発機構(AMED)「次世代がん医療創生研究事業(P-CREATE) ならびに高松宮妃癌研究基金助成金などの支援のもとでおこなわれたもので、その研究成果は、国際科学誌Cancer Scienceに、2022年11月8日にオンライン版で発表されました。
研究の背景
膵癌は世界で罹患数、死亡数いずれも年々増加傾向にあり、未だに予後不良の癌です。現在、膵癌の早期発見・予後予測を可能にするバイオマーカーや新規治療法の開発が強く望まれています。
膵癌の発生、進展にはゲノム・エピゲノム異常が関わっていることが知られていますが、その分子メカニズムにはいまだに不明な点が多く残っています。エピゲノム機構※1の1つであるヒストン修飾※2は、遺伝子発現制御に関わり、ヒストン修飾異常は癌のみならず生活習慣病など様々な疾患の発症に関与しています。これまでにヒストンタンパク質のリジン(K)残基の化学修飾の研究が進んでおり、そのメチル化やアセチル化修飾は、遺伝子発現の活性化または不活性化に働くことが知られています。特にヒストンH3の4番目、9番目、27番目のリジン残基のメチル化異常は多くの癌で報告されてきました。膵癌において、H3K9とH3K27のメチル化に関してはSETDB1, SUV39H1やEZH2などのエピゲノム修飾酵素※3の異常が報告されてきましたが、H3K4については、はっきりわかっていません。H3K4のメチル化修飾は、酵母からヒトまで広く保存されているCOMPASS(Complex of Proteins Associated with Set1)※4と呼ばれる複合体ファミリーによって触媒され、複数のH3K4メチル化酵素が報告されています。SETドメイン含有タンパク質1A (SETD1A) は、COMPASS複合体構成因子であり、悪性腫瘍でSETD1Aの亢進が報告されてきました。しかしながら、膵癌におけるSETD1A異常およびその分子メカニズムはほとんどわかっていません。
膵癌の発生、進展にはゲノム・エピゲノム異常が関わっていることが知られていますが、その分子メカニズムにはいまだに不明な点が多く残っています。エピゲノム機構※1の1つであるヒストン修飾※2は、遺伝子発現制御に関わり、ヒストン修飾異常は癌のみならず生活習慣病など様々な疾患の発症に関与しています。これまでにヒストンタンパク質のリジン(K)残基の化学修飾の研究が進んでおり、そのメチル化やアセチル化修飾は、遺伝子発現の活性化または不活性化に働くことが知られています。特にヒストンH3の4番目、9番目、27番目のリジン残基のメチル化異常は多くの癌で報告されてきました。膵癌において、H3K9とH3K27のメチル化に関してはSETDB1, SUV39H1やEZH2などのエピゲノム修飾酵素※3の異常が報告されてきましたが、H3K4については、はっきりわかっていません。H3K4のメチル化修飾は、酵母からヒトまで広く保存されているCOMPASS(Complex of Proteins Associated with Set1)※4と呼ばれる複合体ファミリーによって触媒され、複数のH3K4メチル化酵素が報告されています。SETドメイン含有タンパク質1A (SETD1A) は、COMPASS複合体構成因子であり、悪性腫瘍でSETD1Aの亢進が報告されてきました。しかしながら、膵癌におけるSETD1A異常およびその分子メカニズムはほとんどわかっていません。
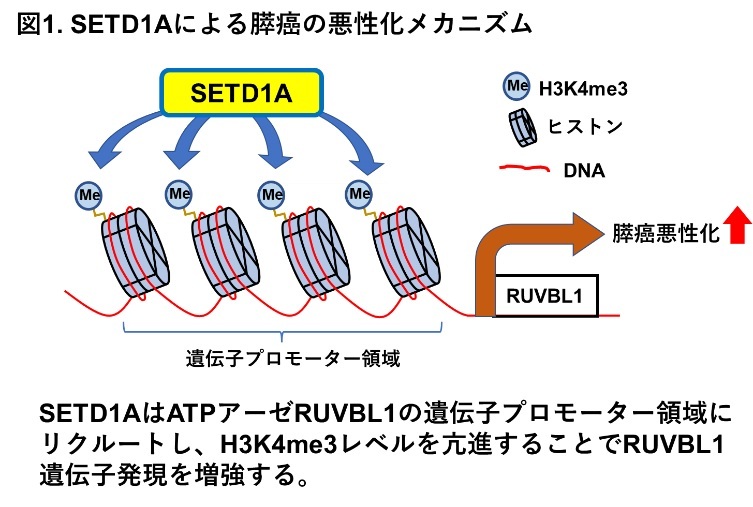
本研究では、膵癌におけるSETD1A発現異常を解析した結果、膵癌の半数以上でSETD1Aが過剰発現していることを明らかなりました。さらに、SETD1Aがエピゲノム機構を介して活性化する新規下流標的遺伝子としてRUVBL1を同定し(図1)、SETD1Aによる膵癌悪性化の分子メカニズムについて解析を進めました。
研究成果の概要
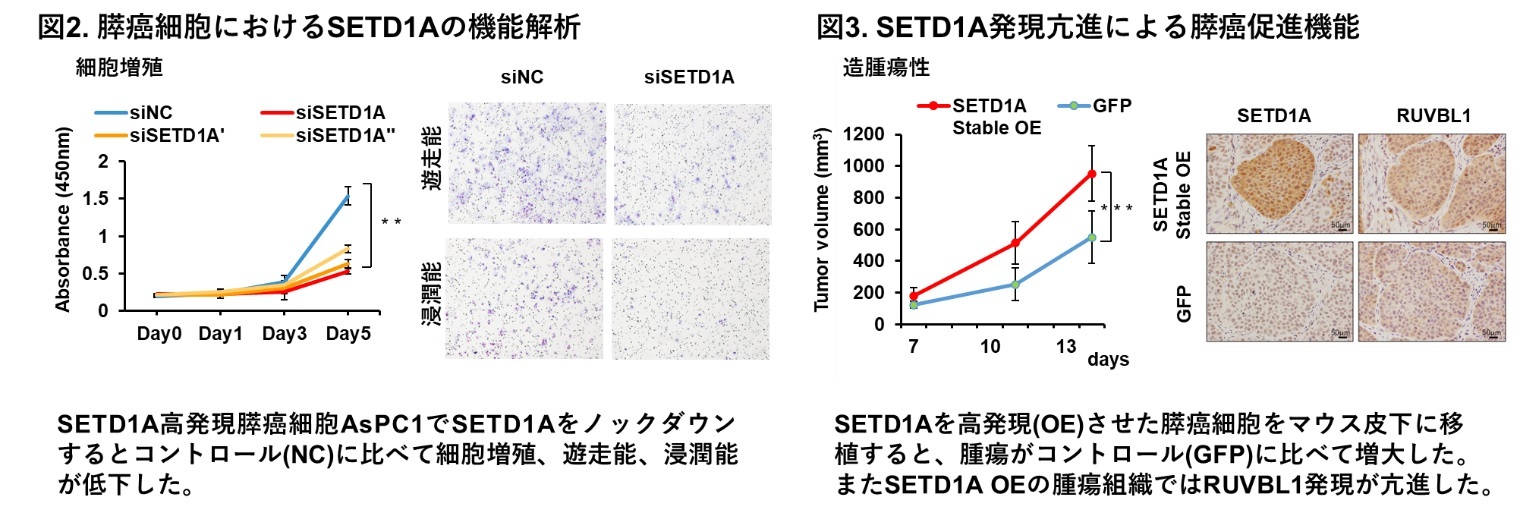
本研究グループは、ヒト膵癌の臨床組織検体105例を用いてSETD1A発現を調べ、51.4%の膵癌で高発現していることを明らかにしました。次に、SETD1Aの機能を解明するため、SETD1A発現が強いヒト膵癌細胞を用いて、その発現抑制実験を行いました。その結果、SETD1A発現を抑制すると、膵癌の細胞増殖能、遊走能・浸潤能が有意に低下することがわかりました(図2)。
SETD1AはヒストンH3K4をメチル化して下流遺伝子発現を活性化することが知られていますが、膵癌でのSETD1A標的遺伝子は未だに不明です。本研究グループは複数の膵癌細胞で共通する新規SETD1A標的遺伝子としてRUVBL1を同定しました。SETD1AはRUVBL1の遺伝子プロモーター領域にリクルートし、ヒストンH3K4me3レベルを亢進することでRUVBL1発現を増強することがわかりました(図1)。RUVBL1※5はDNA依存性ATPアーゼ機能を持ち、遺伝子発現活性化/不活性化、クロマチン再構築、DNA修復、テロメア維持に機能する遺伝子であり、さまざまなタイプの悪性腫瘍で高発現が報告されています。本研究でRUVBL1発現を膵癌細胞で抑えると、細胞増殖能、遊走能・浸潤能が低下し、これらはSETD1A発現を抑えた時と同様の変化を示しました。
一方、SETD1A発現が弱い膵癌細胞にSETD1Aを高発現させてマウス皮下に移植すると、RUVBL1発現亢進を伴う腫瘍の大きさが増大しました(図3)。以上より、SETD1AはRUVBL1を介して癌の悪性度亢進に働く可能性が強く示唆されました。
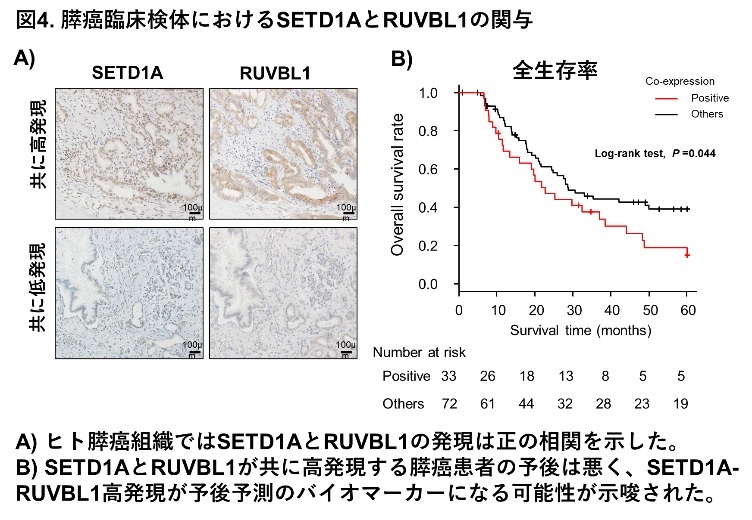
ヒト膵癌臨床検体においてもSETD1AとRUVBL1発現は正の相関を示しました。SETD1A単独高発現の場合の膵癌患者の生存率は悪い傾向を示しますが、両方の発現が強いと生存率は有意に悪いことが明らかになりました(図4)。
ヒト膵癌臨床検体においてもSETD1AとRUVBL1発現は正の相関を示しました。SETD1A単独高発現の場合の膵癌患者の生存率は悪い傾向を示しますが、両方の発現が強いと生存率は有意に悪いことが明らかになりました(図4)。
研究成果の意義
本研究では、膵癌の半数以上にSETD1Aの高発現を認めました。SETD1AはH3K4メチル化経路を介してRUVBL1の発現を亢進することで膵癌の悪性度を高めていることを世界で初めて明らかにしました(図1)。さらに、臨床的にもSETD1A-RUVBL1高発現は膵癌の予後予測において独立したバイオマーカーとなることが示唆されました。現在、SET1ファミリー因子やRUBVL1を標的とする阻害剤が国内外で開発中です。本研究の成果より、SETD1AとRUVBL1阻害剤の併用療法は、膵癌患者の新規治療法となる可能性を持つと期待できます。
用語解説
※1エピゲノム機構
エピゲノム(エピジェネティクス)機構はDNA塩基配列の変化を伴わない遺伝子発現制御の仕組みであり、DNAメチル化、ヒストン修飾およびクロマチン再構築の3つが柱となっている。
※2ヒストン修飾
ヒストンはクロマチンの基本単位であるヌクレオソームを構成する塩基性タンパク質である。ヒストンのN末端とC末端側にはヒストンテールが存在し、その部分のリジン残基(K)にメチル化やアセチル化修飾が起こると遺伝子発現が活性化または不活性化する。H3K4(ヒストンH3の4番目のリジン)に3個のメチル基がつくことをH3K4me3と呼び、この修飾は遺伝子発現の活性化に働く。
※3エピゲノム修飾酵素
DNAメチル化やヒストン修飾に関するエピゲノム機構の関連酵素群を示す。ヒストン修飾の場合、ヒストンにメチル化やアセチル化を取り付けるWriter、修飾したヒストンを認識するReader、取り去るEraser酵素がそれぞれ存在する。SETD1AはヒストンH3K4にメチル化を書き込むWriter酵素である。
※4 COMPASS
COMPASS (Complex of Proteins Associated with Set1)は、H3K4メチル化に機能する複合体であり、酵母からヒトまで保存されている。哺乳類COMPASS複合体はSETD1AまたはSETD1Bを中心としてASH2, WDR82, WDR5, RBBP5などの特異的タンパク質から構成される。
※5 RUVBL1
RUVBL1はAAA+(ATPases associated with diverse cellular activities)ファミリーのタンパク質の1つであり、DNA依存性ATPアーゼおよびDNAヘリカーゼの機能を持つ。ATPアーゼは生体内でATP(アデノシン三リン酸)をADP(アデノシンニリン酸)と無機リン酸に加水分解する酵素群である。RUVBL1の機能は遺伝子発現活性化/不活性化、クロマチン再構築、DNA修復、テロメア維持など多様であり、さまざまなタイプの悪性腫瘍で高発現が認められる。別名Pontin 52と呼ばれる。
エピゲノム(エピジェネティクス)機構はDNA塩基配列の変化を伴わない遺伝子発現制御の仕組みであり、DNAメチル化、ヒストン修飾およびクロマチン再構築の3つが柱となっている。
※2ヒストン修飾
ヒストンはクロマチンの基本単位であるヌクレオソームを構成する塩基性タンパク質である。ヒストンのN末端とC末端側にはヒストンテールが存在し、その部分のリジン残基(K)にメチル化やアセチル化修飾が起こると遺伝子発現が活性化または不活性化する。H3K4(ヒストンH3の4番目のリジン)に3個のメチル基がつくことをH3K4me3と呼び、この修飾は遺伝子発現の活性化に働く。
※3エピゲノム修飾酵素
DNAメチル化やヒストン修飾に関するエピゲノム機構の関連酵素群を示す。ヒストン修飾の場合、ヒストンにメチル化やアセチル化を取り付けるWriter、修飾したヒストンを認識するReader、取り去るEraser酵素がそれぞれ存在する。SETD1AはヒストンH3K4にメチル化を書き込むWriter酵素である。
※4 COMPASS
COMPASS (Complex of Proteins Associated with Set1)は、H3K4メチル化に機能する複合体であり、酵母からヒトまで保存されている。哺乳類COMPASS複合体はSETD1AまたはSETD1Bを中心としてASH2, WDR82, WDR5, RBBP5などの特異的タンパク質から構成される。
※5 RUVBL1
RUVBL1はAAA+(ATPases associated with diverse cellular activities)ファミリーのタンパク質の1つであり、DNA依存性ATPアーゼおよびDNAヘリカーゼの機能を持つ。ATPアーゼは生体内でATP(アデノシン三リン酸)をADP(アデノシンニリン酸)と無機リン酸に加水分解する酵素群である。RUVBL1の機能は遺伝子発現活性化/不活性化、クロマチン再構築、DNA修復、テロメア維持など多様であり、さまざまなタイプの悪性腫瘍で高発現が認められる。別名Pontin 52と呼ばれる。
論文情報
掲載誌:Cancer Science
論文タイトル: Identification of a novel target of SETD1A histone methyltransferase and the clinical significance in pancreatic cancer
DOI:https://doi.org/10.1111/cas.15615
研究者プロフィール
田中真二 (タナカ シンジ) Tanaka Shinji
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 教授
・研究領域
分子腫瘍医学、消化器外科学
秋山好光 (アキヤマ ヨシミツ) Akiyama Yoshimitsu
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 講師
・研究領域
分子腫瘍医学、癌エピジェネティクス
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 教授
・研究領域
分子腫瘍医学、消化器外科学
秋山好光 (アキヤマ ヨシミツ) Akiyama Yoshimitsu
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 講師
・研究領域
分子腫瘍医学、癌エピジェネティクス
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子腫瘍医学学分野 秋山好光(アキヤマ ヨシミツ)
田中真二(タナカ シンジ)
E-mail:yakiyama.monc[@]tmd.ac.jp
E-mail:tanaka.monc[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

