「増殖をしていない口腔がん細胞が運動能を獲得して転移するメカニズムを発見」【渡部徹郎 教授】

渡部 徹郎 (ワタベ テツロウ) 大学院医歯学総合研究科 病態生化学分野 教授
井上 カタジナアンナ (イノウエ カタジナアンナ)大学院医歯学総合研究科 病態生化学分野 助教
高橋 和樹 (タカハシ カズキ)大学院医歯学総合研究科 病態生化学分野 連携研究員
― がん転移を抑制する新規治療法の開発に期待 ―
ポイント
- がん微小環境に豊富に存在するトランスフォーミング増殖因子(TGF-β)※1により増殖が低下した口腔がん細胞が運動能を獲得して転移をすることをつきとめました。
- TGF-βは頭頸部がん患者の予後不良因子であるケラチン結合因子(KRTAP2-3)※2の発現を上昇させることで口腔がん細胞の上皮間葉移行(EMT)※3を誘導するという新たなメカニズムを見出しました。
- 様々ながんの病態解明と新規治療法開発への応用が期待できます。
研究の背景
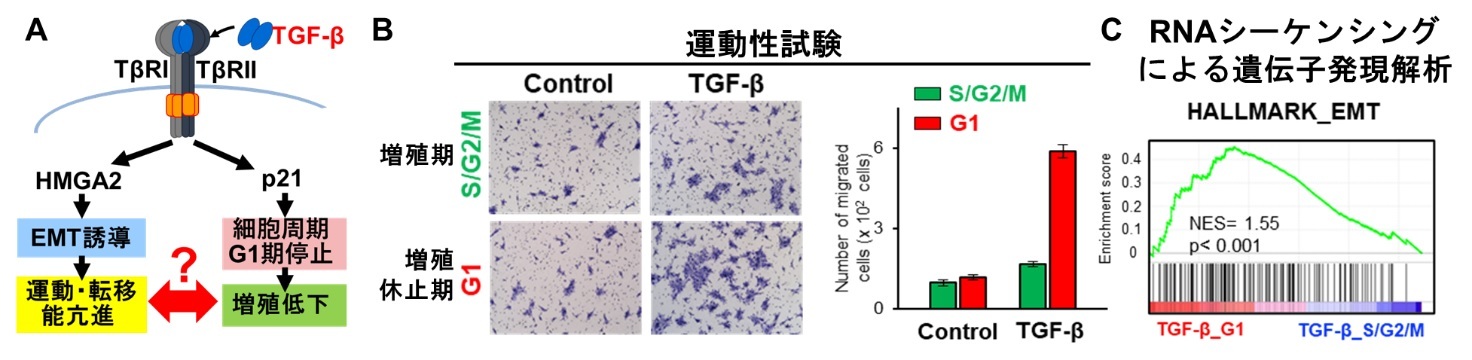
図1 TGF-βにより細胞周期がG1期で停止したがん細胞の運動能がEMTの誘導により亢進する:
(A) TGF-βはI型(TβRI)ならびにII型(TβRII)受容体に結合して、細胞内にそのシグナルを伝達する。TGF-βはHMGA2やSlugなどの転写因子の発現を上昇させてEMTを誘導することでがん細胞の運動・転移能を亢進しつつ、細胞周期をG1期に停止させることで増殖を低下させるが、これらの2つの作用の関連性についてはわかっていなかった。(B) 細胞周期をモニターできるFucciシステムを用いてG1期の細胞とS/G2/M期の細胞を分取したところ、TGF-βによって増殖が休止した細胞の運動能が最も高かった。(C) RNAシーケンシングによるGSEA解析により、TGF-βによってG1期に停止した細胞においてはS/G2/M期と比較してEMTが誘導されていることが示された。
研究成果の概要
さらに、シングルセルRNAシーケンシングによる解析により、TGF-βにより誘導されるEMTには従来報告されていたHMGA2転写因子発現を介するものに加えて、細胞周期がG1期に停止した細胞を形成する新たな経路が存在することを見出しました(図2A)。
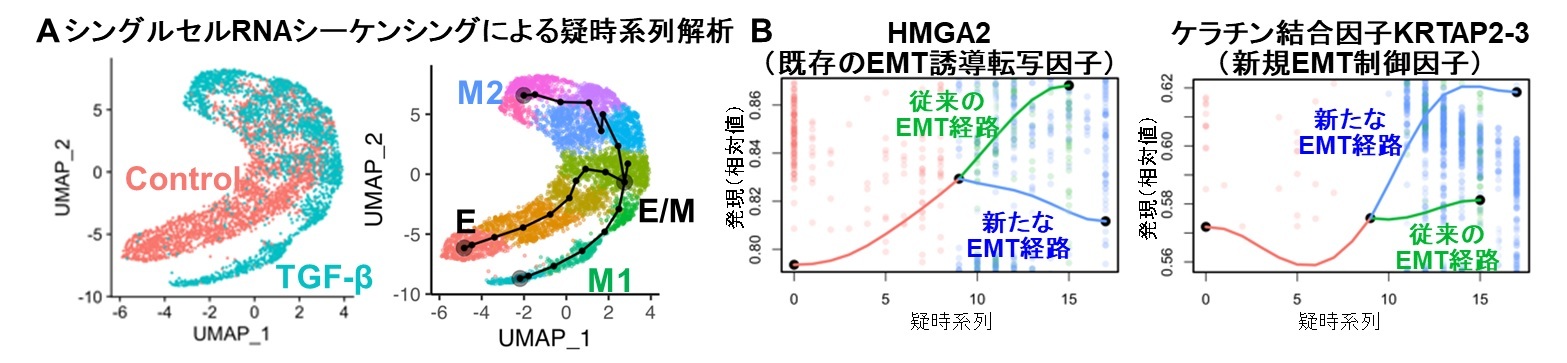
図2 TGF-β誘導性のEMTにより2種類の間葉系がん細胞が形成される:
(A) シングルセルRNAシーケンシングにより、TGF-β刺激した口腔がん細胞(水色)の遺伝子発現様式は無処理の細胞(ピンク)と異なることが示された。これらの細胞は12のクラスターに分類され、疑時系列解析により、上皮細胞(E)から部分的EMT(E/M)を経て、2種類の間葉系細胞(M1とM2)への移行することが示された。M2の間葉系細胞においてはG1期の細胞がより多く存在していたことから、今回見出したTGF-βによりG1期で停止した運動能が高い細胞集団であることが示唆された。(B) 第1のEMT経路においては、これまでEMT誘導転写因子として知られていたHMGA2の発現が上昇していたが、第2のEMT経路においてはTGF-βによりG1期で停止した細胞で発現が誘導されるKRTAP2-3の発現が上昇していた。
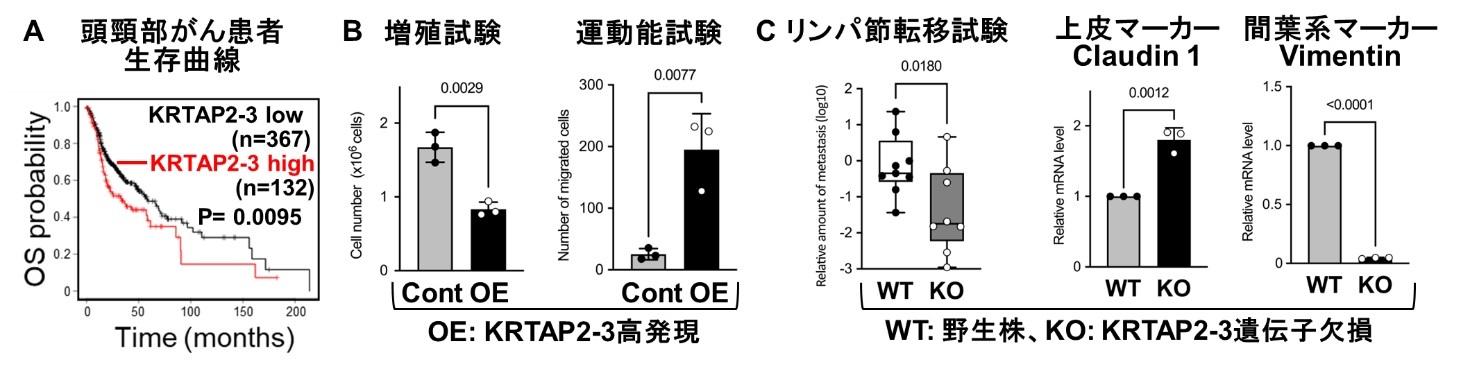
図3 頭頸部がん患者の予後不良因子KRTAP2-3はがん細胞の増殖を低下させつつ、EMTを誘導することで運動・転移能を亢進する:
(A) KRTAP2-3は頭頸部がん患者の予後不良因子であることが示された。(B) KRTAP2-3の発現を上昇させた口腔がん細胞の増殖は低下し、運動能が亢進することからTGF-βによる2つの作用を制御する因子であることが示唆された。(B) KRTAP2-3遺伝子を欠損させた口腔がん細胞のリンパ節転移能は低下し、間葉上皮移行(MET)が誘導されることから、KRTAP2-3は口腔がん細胞の運動・転移能を維持することが示唆された。
研究成果の意義
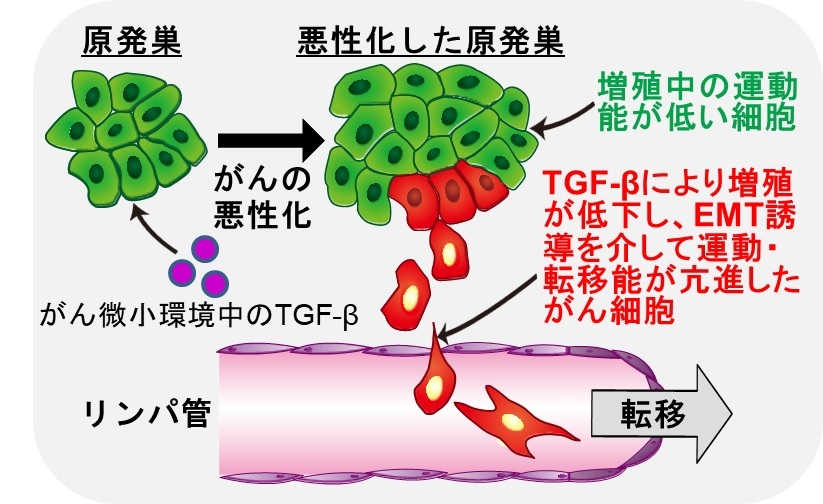
腫瘍組織に豊富に存在するTGF-βは細胞周期をG1期に停止することで増殖が低下し、EMTを誘導することで運動・転移能が亢進したがん細胞の形成を誘導する。こうした細胞においてはKRTAP2-3の発現が上昇しており、TGF-βによる2つの作用を制御していることからKRTAP2-3の発現を低下させることで治療効果が期待される。
用語解説
※2ケラチン結合因子2-3(keratin associated protein 2-3: KRTAP2-3):100種類以上のメンバーから構成されるKRTAPファミリーのメンバー。毛髪に発現してケラチンタンパク質に結合することで、ケラチン線維の形成に寄与する。がんの発生や進展に関する報告はない。
※3上皮間葉移行(epithelial-mesenchymal transition : EMT):上皮細胞が間葉系細胞へと分化する過程で、細胞は細胞間接着分子であるクローディン-1 (Claudin-1) などの発現を消失し、ビメンチン (Vimentin) などの発現や高い運動・浸潤能などの間葉系細胞の形質を獲得する。EMTは発生過程で見られる生理的な現象だが、組織の線維化や、がん転移などの病態の進展にも関与する。
論文情報
掲載誌:Cell Reports
-
論文タイトル:TGF-β generates a population of cancer cells residing in G1 phase with high motility and metastatic potential via KRTAP2-3
研究者プロフィール

東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 連携研究員
東京大学生産技術研究所
機械・生体系部門 特別研究員
・研究領域
がん生物学、生化学

東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
がん生物学、生化学

東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 教授
・研究領域
がん生物学、血管生物学、生化学
問い合わせ先
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 渡部 徹郎 (ワタベ テツロウ)
E-mail: t-watabe.bch[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

