「口腔がん細胞は細胞外に分泌する小胞を介して正常血管のバリア機能を低下させる」【小林美穂 助教、井上カタジナアンナ 助教、渡部徹郎 教授】
公開日:2022.9.4
「口腔がん細胞は細胞外に分泌する小胞を介して正常血管のバリア機能を低下させる」
― がんの遠隔転移を予防する新規治療法の開発に期待 ―
― がんの遠隔転移を予防する新規治療法の開発に期待 ―
ポイント
- がんの増悪化を誘導するトランスフォーミング増殖因子(TGF-β)(※1)が、がん細胞から分泌される細胞外小胞(EVs)(※2)を介して、間接的に転移を促進することをつきとめました。
- TGF-βにより運動・浸潤能が上昇した口腔がん細胞はより多くのEVsを分泌し、そのEVsが正常血管内皮細胞に取り込まれることで内皮間葉移行(EndoMT)(※3)による血管のバリア機能の低下が誘導されることが明らかになりました。
- がんの転移前に予測・予防する方法の開発への応用が期待できます。
研究の背景
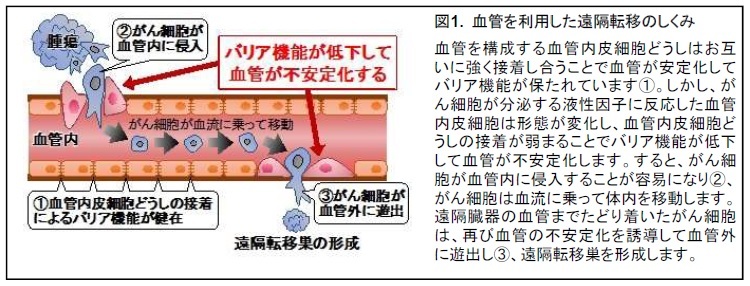
がんの進行に伴って誘導される遠隔転移は根治を困難にさせて死亡率を高める要因の1つです。そのため、がんの転移機構を解明することは重要です。がんを取り巻く周囲の環境は「がん微小環境」と呼ばれ、がんの進展や転移に密接に関連しています。がん微小環境に多く存在するトランスフォーミング増殖因子(TGF-β)は、がん細胞に直接作用することで上皮間葉移行(EMT)(※3)を引き起こし、遊走・浸潤による転移能の獲得を通して、がんの増悪化を誘導します。がん細胞が遠隔臓器に転移する場合、多くは血管を移動経路としています。血管は血液を運ぶ管であるため、液体が管の外に漏れ出ないように、血管を構成する血管内皮細胞どうしがお互いに強く接着し合うことでバリア機能を保っています(図1-①)。しかし、がん細胞はその血管内皮細胞どうしの接着を緩めて不安定化し、血管内に侵入します(図1-②)。がん細胞は血流に乗って遠隔臓器まで辿り着くと、転移先の正常な血管をも不安定化し、今度は血管外に遊出します(図1-③)。このようにして、がん細胞は血管内皮細胞のバリア機能を不安定化することで、遠隔転移することが知られています(図1)。最近では、がん細胞が遠隔臓器に到達する以前に「前転移ニッチ」として、がん細胞があらかじめ転移先の血管を不安定化させていることが分かりつつありましたが、その詳細なメカニズムについては不明な点が多く残されていました。また、TGF-βなどのがん転移を誘導する役割を果たす液性因子は、主に腫瘍をとりまくがん微小環境内に多く存在するため、がん微小環境を越えた遠隔臓器まではその効果が届かないと考えられていました。
研究成果の概要
本研究グループは、がん細胞が血管内皮細胞を操るツールとして、がん細胞を含む多くの細胞が分泌する細胞外小胞(EVs)と呼ばれる直径100 nm程度の粒子に注目しました。がん細胞から分泌されたEVsは、血液、尿、唾液などの体液中に含まれることがよく知られています。EVsにはRNAなどの核酸や様々なタンパク質が内包されており、近くの細胞や遠くの細胞とEVsをやり取りすることで、細胞どうしはコミュニケーションを取っています。研究グループは、TGF-βで刺激してEMTが誘導された口腔がん細胞では、無刺激の口腔がん細胞に比べて3倍ほどEVsの分泌量が増加することを発見しました。
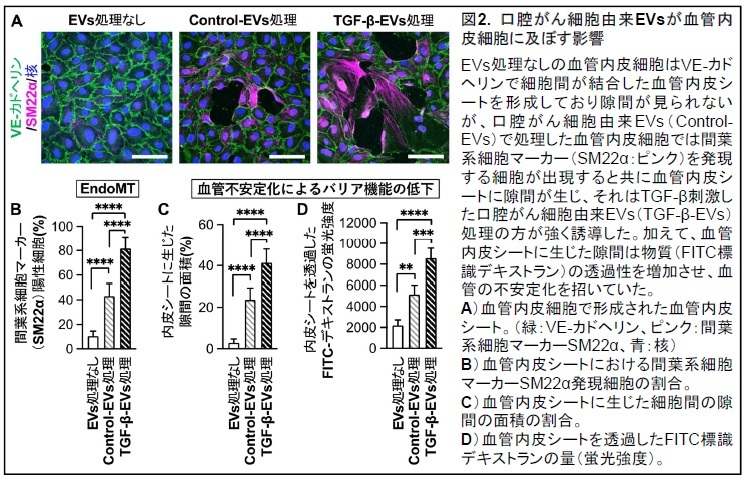
次に、がん細胞から分泌されるEVsが血管内皮細胞に及ぼす影響を探るために、無刺激の口腔がん細胞由来EVs(Control-EVs)とTGF-β刺激した口腔がん細胞由来EVs(TGF-β-EVs)を用意し、血管内皮細胞で形成した血管内皮シートにそれぞれのEVsを同じ量だけ作用させたところ、どちらのEVs処理においても血管内皮細胞では本来発現していない間葉系細胞マーカーであるSM22αの発現が誘導されており(図2A, B)、内皮間葉移行(EndoMT)が引き起こされることが明らかとなりました。さらに、EVsは血管内皮細胞どうしの接着を弱め、血管内皮シートに隙間を形成させていました(図2A, C)。このような隙間は、血管のバリア機能を低下させて不安定化を導きます。そのため、実際に血管内皮シートの物質透過性を測定した結果、EVsは血管内皮シートの物質透過性を亢進させており、バリア機能の低下を招くことが明らかとなりました(図2D)。興味深いことに、このようなEndoMTや血管不安定化によるバリア機能の低下は、TGF-β-EVsの方が強く誘導することが新たに見出されました(図2A-D)。
次に、がん細胞から分泌されるEVsが血管内皮細胞に及ぼす影響を探るために、無刺激の口腔がん細胞由来EVs(Control-EVs)とTGF-β刺激した口腔がん細胞由来EVs(TGF-β-EVs)を用意し、血管内皮細胞で形成した血管内皮シートにそれぞれのEVsを同じ量だけ作用させたところ、どちらのEVs処理においても血管内皮細胞では本来発現していない間葉系細胞マーカーであるSM22αの発現が誘導されており(図2A, B)、内皮間葉移行(EndoMT)が引き起こされることが明らかとなりました。さらに、EVsは血管内皮細胞どうしの接着を弱め、血管内皮シートに隙間を形成させていました(図2A, C)。このような隙間は、血管のバリア機能を低下させて不安定化を導きます。そのため、実際に血管内皮シートの物質透過性を測定した結果、EVsは血管内皮シートの物質透過性を亢進させており、バリア機能の低下を招くことが明らかとなりました(図2D)。興味深いことに、このようなEndoMTや血管不安定化によるバリア機能の低下は、TGF-β-EVsの方が強く誘導することが新たに見出されました(図2A-D)。
研究成果の意義
近年、がん細胞が分泌するEVsの役割に注目が集まっており、がん治療の新たな標的になるとして期待されています。がん細胞由来のEVsが、同じくがん細胞に作用することで増悪化が周囲に伝播することは知られていましたが、がん細胞由来のEVsが血管内皮細胞に作用することで血管の特性に影響を及ぼすかについては、まだ分からないことが多く残されていました。
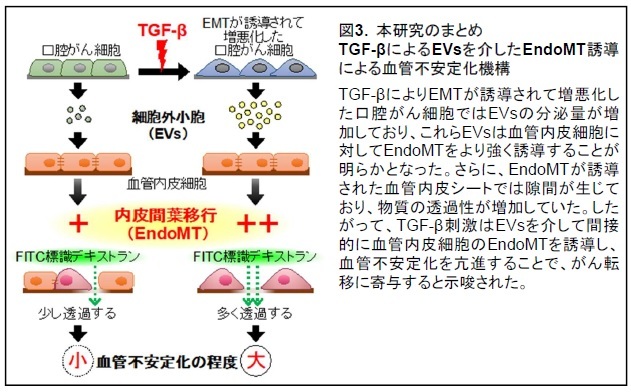
本研究により、TGF-βはがん細胞から分泌されるEVsの量だけでなく、EVsの作用自体も増強させており、TGF-βにより増悪化した口腔がん細胞由来のEVsは、正常血管において血管不安定化につながるEndoMTを誘導することが示されました(図3)。このような血管の不安定化は、がん細胞が遠隔転移する際に必要となる、がん細胞の血管内への侵入と血管外への遊出を容易にさせます(図1)。そのため、TGF-βはがん細胞から分泌されるEVsを変化させることで、間接的に遠隔転移を促進させる可能性が示唆されました。また、本研究の成果から、TGF-βがEVsを介してがん微小環境を越えた遠隔臓器の細胞にも情報を伝えて血管に変化を生じさせることができるという、TGF-βのがん悪性化因子としての新たな役割も発見されました。
現在、研究グループは、TGF-βがどのようにしてがん細胞からのEVsの分泌を促進させるのか、そしてTGF-βにより増悪化した口腔がん由来のEVsは、その中に包まれている「何」を血管内皮細胞に受け渡すことでEndoMTや血管の不安定化を誘導しているのか、これら分子メカニズムを解明するための詳細な研究を進めています。これらの研究から、将来、体液中に含まれるEVsを検査することや、がん細胞からのEVsの分泌やEVsによって誘導されるEndoMTを抑制することで、遠隔転移を予防・抑制する方法の開発へ応用されることが期待されます。
本研究により、TGF-βはがん細胞から分泌されるEVsの量だけでなく、EVsの作用自体も増強させており、TGF-βにより増悪化した口腔がん細胞由来のEVsは、正常血管において血管不安定化につながるEndoMTを誘導することが示されました(図3)。このような血管の不安定化は、がん細胞が遠隔転移する際に必要となる、がん細胞の血管内への侵入と血管外への遊出を容易にさせます(図1)。そのため、TGF-βはがん細胞から分泌されるEVsを変化させることで、間接的に遠隔転移を促進させる可能性が示唆されました。また、本研究の成果から、TGF-βがEVsを介してがん微小環境を越えた遠隔臓器の細胞にも情報を伝えて血管に変化を生じさせることができるという、TGF-βのがん悪性化因子としての新たな役割も発見されました。
現在、研究グループは、TGF-βがどのようにしてがん細胞からのEVsの分泌を促進させるのか、そしてTGF-βにより増悪化した口腔がん由来のEVsは、その中に包まれている「何」を血管内皮細胞に受け渡すことでEndoMTや血管の不安定化を誘導しているのか、これら分子メカニズムを解明するための詳細な研究を進めています。これらの研究から、将来、体液中に含まれるEVsを検査することや、がん細胞からのEVsの分泌やEVsによって誘導されるEndoMTを抑制することで、遠隔転移を予防・抑制する方法の開発へ応用されることが期待されます。
用語解説
※1)トランスフォーミング増殖因子β (transforming growth factor-β:TGF-β):線維芽細胞の形質転換を促進する因子として同定されたが、現在では多くの種類の細胞に対して増殖抑制作用を有することが明らかになっている。さらに、細胞の分化・運動などにも関与し、個体発生やがんの浸潤・転移など様々な病態生理学的現象において重要な役割を果たすことが分かっている。
※2)細胞外小胞(EVs):様々な種類の細胞から細胞外に分泌される膜で包まれたカプセル状の粒子で、直径100 nm前後のものはエクソソームとも呼ばれる。EVsに内包されているRNAやDNA等の核酸類やタンパク質等の物質を他の細胞に受け渡すことで情報を伝えることができるため、細胞どうしのコミュニケーションツールとしての役割を果たしている。また、EVsは膜で包まれていることから、内包する物質を保護しながら遠方へも情報を伝えることができる。
※3)内皮間葉移行(endothelial-mesenchymal transition:EndoMT)・上皮間葉移行(epithelial-mesenchymal transition:EMT):それぞれ、内皮細胞や上皮細胞の特性を保つための遺伝子の発現が低下して周囲細胞との細胞接着機能を失うと同時に、間葉系細胞に特徴的な遺伝子の発現が上昇することで遊走・浸潤能を獲得することにより、内皮細胞・上皮細胞が間葉系様細胞に分化転換すること。個体の発生においては弁形成(EndoMT)や中胚葉形成・神経管形成(EMT)などの重要な役割を果たしているが、疾患の発症にも強く関連している。
※2)細胞外小胞(EVs):様々な種類の細胞から細胞外に分泌される膜で包まれたカプセル状の粒子で、直径100 nm前後のものはエクソソームとも呼ばれる。EVsに内包されているRNAやDNA等の核酸類やタンパク質等の物質を他の細胞に受け渡すことで情報を伝えることができるため、細胞どうしのコミュニケーションツールとしての役割を果たしている。また、EVsは膜で包まれていることから、内包する物質を保護しながら遠方へも情報を伝えることができる。
※3)内皮間葉移行(endothelial-mesenchymal transition:EndoMT)・上皮間葉移行(epithelial-mesenchymal transition:EMT):それぞれ、内皮細胞や上皮細胞の特性を保つための遺伝子の発現が低下して周囲細胞との細胞接着機能を失うと同時に、間葉系細胞に特徴的な遺伝子の発現が上昇することで遊走・浸潤能を獲得することにより、内皮細胞・上皮細胞が間葉系様細胞に分化転換すること。個体の発生においては弁形成(EndoMT)や中胚葉形成・神経管形成(EMT)などの重要な役割を果たしているが、疾患の発症にも強く関連している。
論文情報
掲載誌:Inflammation and Regeneration
論文タイトル:Transforming growth factor-β-induced secretion of extracellular vesicles from oral cancer cells evokes endothelial barrier instability via endothelial-mesenchymal transition
DOI:https://doi.org/10.1186/s41232-022-00225-7
研究者プロフィール

小林 美穂 (コバヤシ ミホ) Kobayashi, Miho
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
血管生物学、細胞生物学、生化学
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
血管生物学、細胞生物学、生化学

井上 カタジナアンナ (イノウエ カタジナアンナ) Inoue, Katarzyna Anna
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
がん生物学、細胞外マトリクス、生化学
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 助教
・研究領域
がん生物学、細胞外マトリクス、生化学

渡部 徹郎 (ワタベ テツロウ) Watabe, Tetsuro
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 教授
・研究領域
がん生物学、血管生物学、生化学
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 教授
・研究領域
がん生物学、血管生物学、生化学
問い合わせ先
東京医科歯科大学大学院医歯学総合研究科
病態生化学分野 渡部 徹郎 (ワタベ テツロウ)
E-mail: t-watabe.bch[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

