「cGAS-STINGシグナルは免疫細胞の膵臓癌線維芽細胞バリケード突破を促進する」【田中真二 教授、新部(樺嶋)彩乃 助教】
― 癌-間質相互作用におけるcGAS-STINGシグナルの関与 ―
ポイント
- 約50%の膵臓癌症例で、腫瘍免疫にかかわるcGAS-STINGシグナルが不活化されており、このシグナルの有無が手術後の生存率に関与していることを明らかにしました。
- cGAS-STINGシグナル活性化症例では腫瘍免疫の中心となる細胞傷害性T細胞の浸潤が癌隣接間質細胞内に観察され、癌組織内部まで到達しているものが多いことを見出しました。
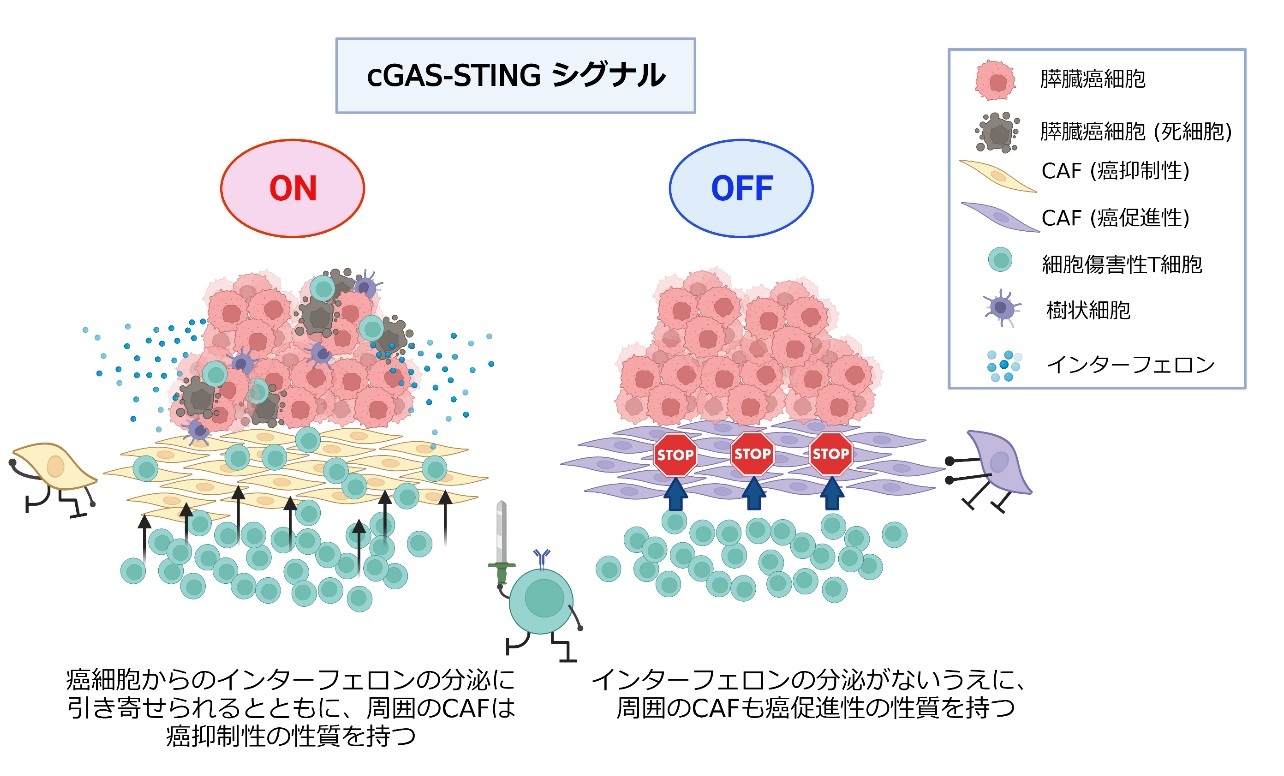
- cGAS-STINGシグナルによって癌抑制性の性質を持つ間質細胞が維持され、細胞傷害性T細胞の癌細胞への浸潤を促進していることが示唆されました。
- このシグナルの制御により免疫細胞の浸潤を促進することで、免疫治療の効果を高める可能性が期待できます。
研究の背景
cGAS-STINGシグナルはウイルス感染などの際、インターフェロン※2産生を促すことで周囲の免疫反応を活性化させる生体防御シグナルの一つです。近年このシグナルが腫瘍免疫にも関与していることを示す論文が報告されていますが、多くの腫瘍組織ではシグナル構成因子であるcGASまたはSTINGの発現が抑制されていることも多く、このシグナルの活性化が腫瘍免疫反応を取り戻すためのkeyともなっています。本研究では膵臓癌におけるcGAS-STINGシグナルが関与する免疫反応と間質細胞の相互作用について検討を行いました。
研究成果の概要
また、この時の免疫細胞の浸潤について解析をしたところ、cGASとSTINGの発現に一致して腫瘍免疫を担う細胞傷害性T細胞の癌組織への浸潤が高く、cGAS-STINGシグナル活性組織では癌に隣接する間質部から癌組織内部にかけて多数の細胞傷害性T細胞の浸潤が見られるということを発見しました。cGAS-STINGシグナル非活性組織において細胞傷害性T細胞は間質部の一部に固まって存在し、浸潤像は認められませんでした (図1)。

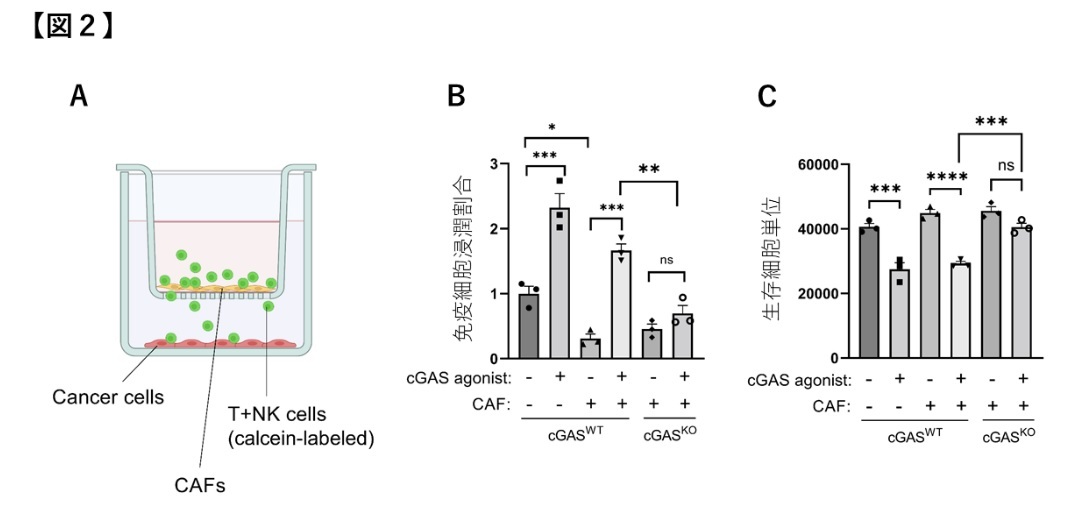
研究成果の意義
近年、多くの腫瘍で免疫チェックポイント阻害剤の適応が増えていますが、膵臓癌ではほとんど効果が認められていない原因の一つとして間質細胞による障壁が考えられています。cGAS-STINGシグナルの活性化によりこの障壁を打破できれば、免疫チェックポイント阻害剤の効果を手助けできることに繋がるかもしれません。
用語解説
※1細胞傷害性T細胞:細胞表面にCD8という分子を持つTリンパ球の一つで、ウイルス感染細胞や癌細胞など、宿主にとって異物となるものを認識して攻撃・殺傷する。抗腫瘍免疫応答の中心を担う。
※2インターフェロン:ウイルスなどの感染時に生体を守るためにリンパ球などから分泌されるタンパク質の一種。抗ウイルス作用や抗腫瘍作用、免疫調節作用などの生理活性を有する。
※3Transwellチャンバー:複数種類の細胞を共培養する際に培養皿内部に装着するインサート。多くの場合、底面は3-10µmほどの大きさのポア(穴)が空いている膜状のメンブレンとなっており、このポアを通して上段および下段の細胞成分や液性成分のやり取りが可能である。
論文情報
掲載誌:Scientific Reports
論文タイトル:cGAS-STING signaling encourages immune cell overcoming of fibroblast barricades in pancreatic cancer
DOI:https://doi.org/10.1038/s41598-022-14297-5
研究者プロフィール
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 教授
・研究領域
分子腫瘍医学、消化器外科学
東京医科歯科大学 大学院医歯学総合研究科
分子腫瘍医学分野 助教
・研究領域
腫瘍学 (消化器)
問い合わせ先
<研究に関すること>
東京医科歯科大学大学院医歯学総合研究科
分子腫瘍学分野 氏名 田中 真二(タナカ シンジ)
氏名 新部(樺嶋) 彩乃(ニイベ(カバシマ) アヤノ)
E-mail:ak-niibe.monc[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp
※E-mailは上記アドレス[@]の部分を@に変えてください。

