「合成メッセンジャーRNAからタンパク質への翻訳を制御する新システムの開発」【位髙啓史 教授】
公開日:2022.3.03
「合成メッセンジャーRNAからタンパク質への翻訳を制御する新システムの開発」
― 治療対象の細胞選択的な治療用タンパク質産生を可能にする新技術 ―
― 治療対象の細胞選択的な治療用タンパク質産生を可能にする新技術 ―
ポイント
- 外部から細胞内に導入した合成メッセンジャーRNA (mRNA) の翻訳を、導入先の細胞が特定のタンパク質(検知対象タンパク質)を発現しているかに応じて制御する人工翻訳制御因子を開発しました。
- 制御対象である合成mRNAの翻訳を活性化するか、それとも逆に抑制するかは、合成mRNAの設計により決めることができます。
- どのタンパク質を検知対象とするかも、人工翻訳制御因子の設計を変えることで柔軟に変更可能です。
- ウイルスに感染した細胞やがん細胞など、治療対象の細胞だけを狙って合成mRNAから治療用タンパク質を産生させられる、新世代のmRNA医薬開発に繋がると期待されます。
研究の背景
mRNAを体内に投与して、ワクチンや治療薬として働くタンパク質を体内で産生させるmRNA創薬が注目を集めています。世界で初めてのmRNAワクチンとなった新型コロナウィルスワクチンは、高い有効性・安全性が実証されました。一方、mRNAからはどのようなタンパク質を産生させることも可能で、また標的となる細胞も選ばないため、新型コロナウィルス以外の感染症に対するワクチン、がんの免疫療法に応用するがんワクチン、さらに様々な疾患治療へ応用する治療用mRNA医薬への応用が注目され、その開発競争が世界的に激化しています。
一方で、産生されるタンパク質の中には、治療対象の細胞以外で産生させると有害な作用をもたらす場合があることも事実です。本研究グループは、安全かつ有効なmRNA創薬を進めるため、治療対象となる細胞で選択的にmRNAからタンパク質への翻訳を行わせる制御システムの開発に取り組みました。治療対象の細胞とそれ以外の細胞を区別する指標の一つとして利用できるのが、細胞内で作られているタンパク質の種類の違いです。例えば、ウイルス感染細胞であれば健康な細胞には存在しないウイルスタンパク質が作られていますし、がん細胞も正常細胞とは異なるタンパク質を作っている場合が多くあります。そこで本研究では、細胞内の特定のタンパク質を検知し、それに応じて合成mRNAの翻訳を制御するシステムを開発しました。
一方で、産生されるタンパク質の中には、治療対象の細胞以外で産生させると有害な作用をもたらす場合があることも事実です。本研究グループは、安全かつ有効なmRNA創薬を進めるため、治療対象となる細胞で選択的にmRNAからタンパク質への翻訳を行わせる制御システムの開発に取り組みました。治療対象の細胞とそれ以外の細胞を区別する指標の一つとして利用できるのが、細胞内で作られているタンパク質の種類の違いです。例えば、ウイルス感染細胞であれば健康な細胞には存在しないウイルスタンパク質が作られていますし、がん細胞も正常細胞とは異なるタンパク質を作っている場合が多くあります。そこで本研究では、細胞内の特定のタンパク質を検知し、それに応じて合成mRNAの翻訳を制御するシステムを開発しました。
研究成果の概要
本研究では、先行研究で開発した「CaVT※1」と呼ばれる人工翻訳制御因子を二つの断片へと分割し、検知対象タンパク質が存在する場合にのみ、これらの断片が翻訳制御活性を持つ完全なCaVTへと再構成されるようにすることで、検知対象タンパク質に応じた翻訳制御を実現しました。検知対象タンパク質に応じてCaVTを再構成させるために、分割したCaVTの断片には、二種類の別のタンパク質を融合させています。一つは「ナノボディ※2」と呼ばれるタンパク質で、これは検知対象タンパク質に結合する機能を持ちます。もう一つは「インテイン※3」と呼ばれるタンパク質で、こちらは二つのCaVT断片が接近した時に限り、それらを融合させて翻訳制御活性を持つ完全なCaVTへと再構成する機能を持ちます。検知対象タンパク質が存在する細胞にCaVTの両断片を入れると、融合させてあるナノボディを介して両方の断片が検知対象タンパク質に結合します。すると、これにより両断片が接近するため、この接近が引き金となってインテインの機能により両断片が融合され、完全なCaVTが再構成されるという仕組みです(図1)。逆に検知対象タンパク質が存在しない細胞においては、CaVTの両断片が、インテインが機能するほど十分に接近する確率は低いため、完全なCaVTが再構成される確率も低くなります。
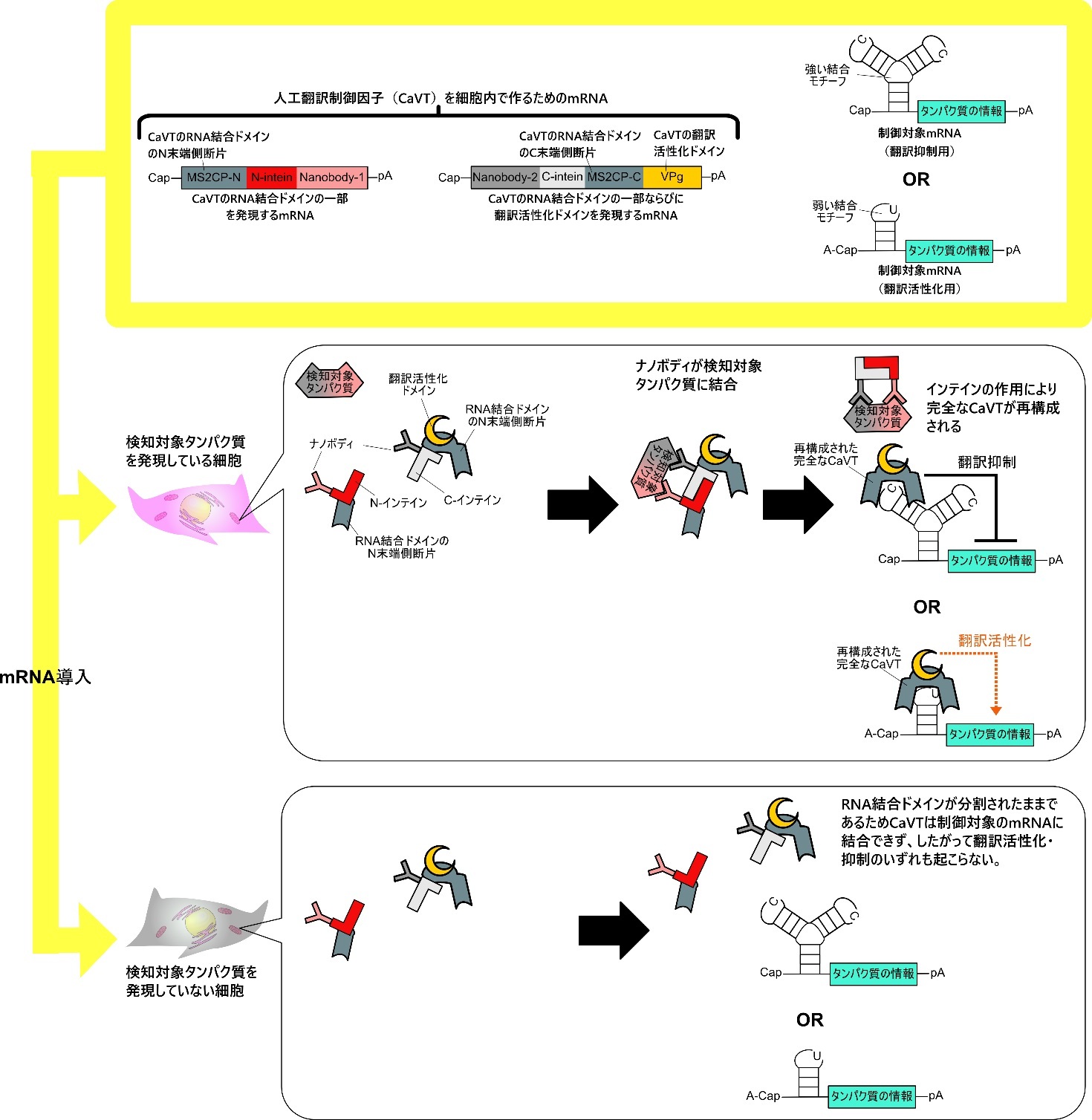
図1. 検知対象タンパク質に応じてmRNAの翻訳を制御する仕組み
CaVTは、CaVTと弱く結合するRNAモチーフを持つ合成mRNAに対してはその翻訳を活性化させ、逆にCaVTと強く結合するRNAモチーフを持つ合成mRNAに対してはその翻訳を抑制することが以前の研究により分かっています。そこで、eDHFRというタンパク質に結合するナノボディを融合させた分割状態のCaVTを、CaVTと強く結合するRNAモチーフを持つ制御対象の合成mRNAとともに細胞へ導入したところ、予想通り、eDHFRを発現している細胞では制御対象mRNAの翻訳が抑制されました。また、制御対象の合成mRNAをCaVTと弱く結合するRNAモチーフを持つものに変更したところ、今度は制御対象mRNAの翻訳が活性化されました(図2)。この結果は、本研究で開発した分割型CaVTを用いれば、検知対象タンパク質を持つ細胞選択的にmRNA医薬の翻訳を抑制することもできれば活性化することもでき、そのいずれにするかは制御対象となるmRNA医薬の設計により選べることを示しています。
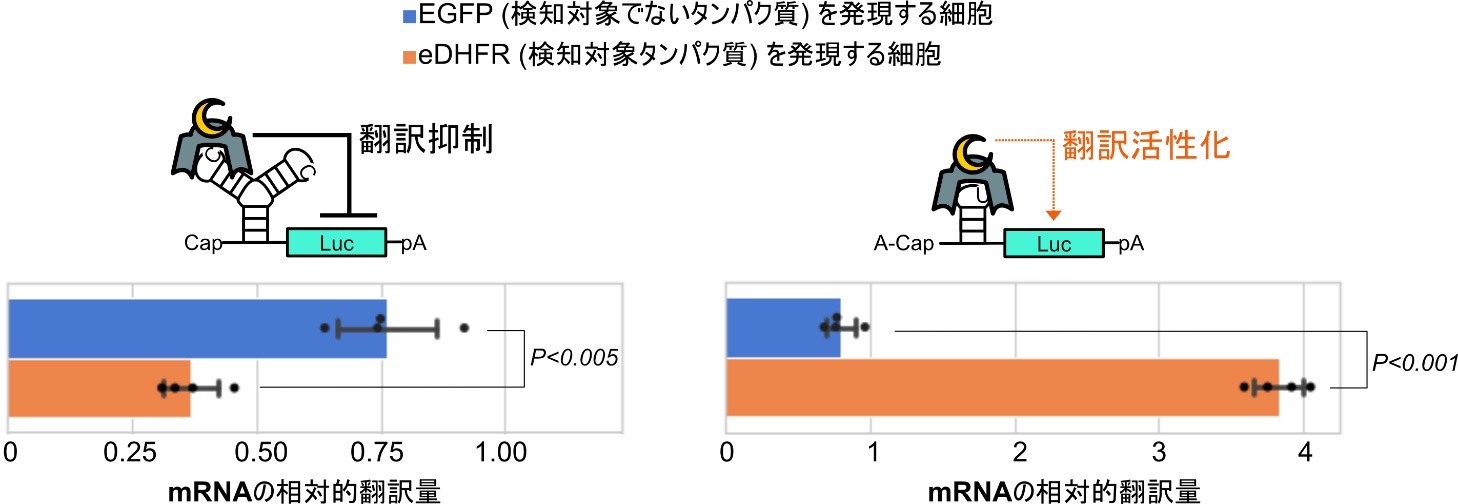
図2. 検知対象タンパク質を発現する細胞・しない細胞それぞれにおけるmRNA翻訳量
本研究で開発した、分割状態のCaVTを再構成させるシステムにおいて、どのタンパク質を検知対象とするかを決めているのはナノボディの部分です。そこで次に、ナノボディ部分を交換することで検知対象を変更できるかについて調べました。分割状態のCaVTに融合させているナノボディを、eDHFRに結合するナノボディからEGFPという別の種類のタンパク質に結合するナノボディへと交換したものを作製し、これを制御対象の合成mRNAとともに細胞に導入しました。すると今度は、EGFPを発現している細胞選択的に翻訳を制御できるようになりました。また、CaVTに強く結合するRNAモチーフを持つ合成mRNAの場合は翻訳が抑制され、弱く結合するRNAモチーフを持つ合成mRNAの場合は翻訳が活性化されるという点はeDFHRを検知対象とした場合と同じでした(図3)。この結果は、本研究で開発した翻訳制御システムは、どのタンパク質を検知対象にするかナノボディ部分を交換するだけで変更することができる汎用性の高いシステムであることを示しています。
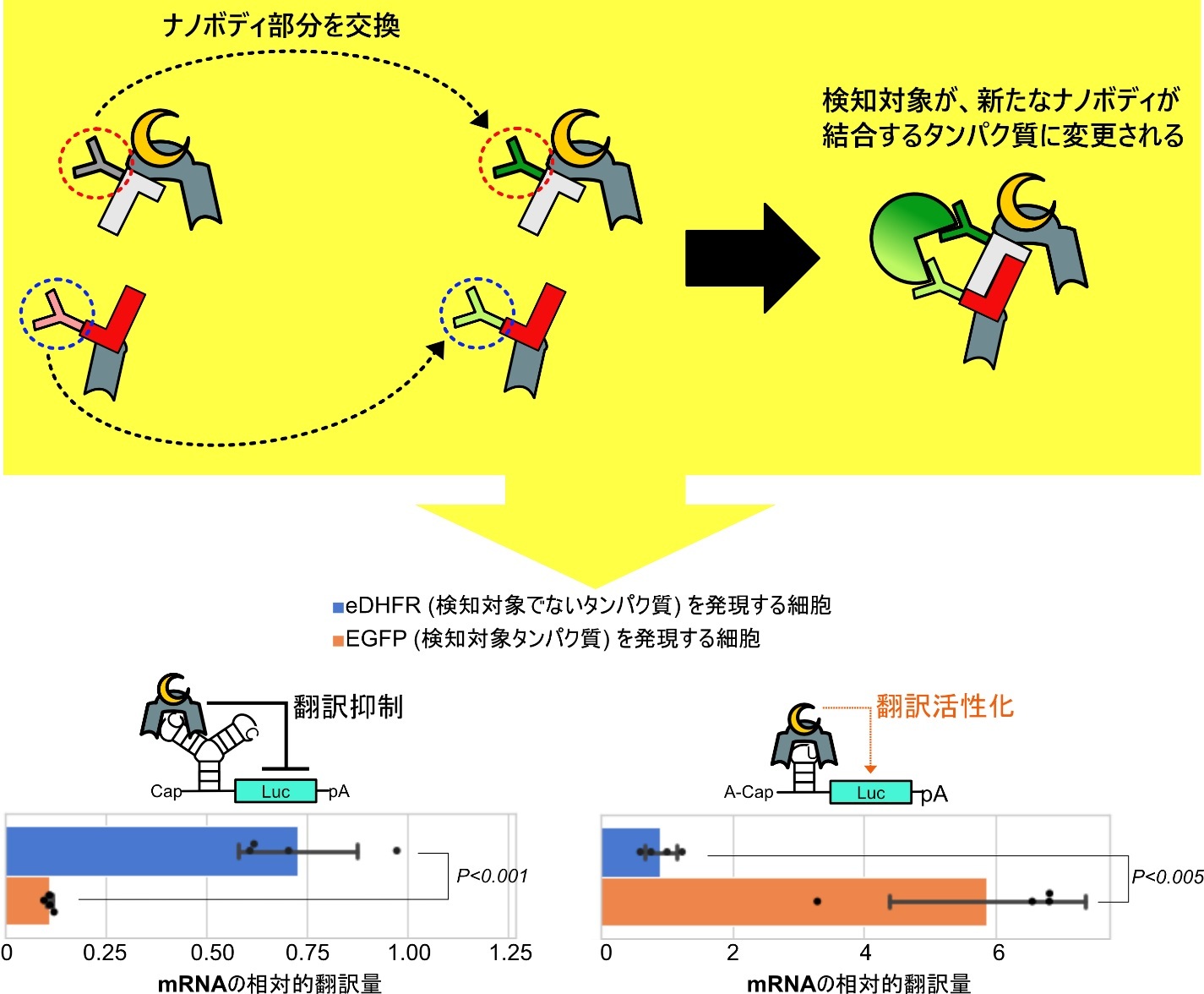
図3. ナノボディ部分の交換による検知対象タンパク質の変更
研究成果の意義
ウイルスに感染している細胞か感染していない細胞か、がん細胞か正常細胞か、神経細胞か筋細胞か肝細胞かそれともまた別の細胞か――そういった細胞の種類によって、医薬品がどのような作用を及ぼすのが望ましいかは異なります。したがって、細胞の種類を区別できない医薬品には、例えばがん細胞だけでなく血球を生み出す細胞まで殺してしまうといったような副作用の問題がつきまといます。細胞の種類の違いは細胞内に存在するタンパク質の種類の違いにも現れるため、どのような種類のタンパク質があるかを細胞内で検知し、それに応じて医薬品の作用を制御できれば、こうした問題の回避に繋がります。mRNA医薬においては、実際にクスリとしての作用を発揮するのは、mRNAそれ自体ではなく、翻訳により作り出されるタンパク質であるため、翻訳を活性化するか抑制するかを制御できれば、実際にクスリとして作用するかどうかも制御できることになります。これを実現した本研究は、今後のmRNA創薬における重要な基盤技術となることが期待されます。例えば細胞死を誘導するタンパク質をがん細胞でだけ産生させたり、あるいはゲノム編集によりウイルスDNAを切断する酵素をウイルス感染細胞でだけ産生させ、非感染細胞のゲノムDNAがDNA切断酵素のオフターゲット効果で傷つけられるのを防いだり、といった多くの応用が考えられ、高い有効性と低い副作用を両立する次世代mRNA創薬に繋がると期待されます。
用語解説
※1CaVT (Caliciviral VPg-based Translational activator)
翻訳活性化能を持つVPgと呼ばれるタンパク質を、RNA結合能を持つMS2コートタンパク質と融合させることで作られた人工翻訳制御因子。MS2コートタンパク質は特定のRNAモチーフを持つRNAに結合するため、この結合モチーフを持つmRNAの翻訳をVPgの作用により活性化できる。ただし、MS2コートタンパク質と非常に強く結合するRNAモチーフを持つmRNAの場合、mRNAの情報が読み取られるのを妨げるのかむしろ翻訳が抑制される。詳細は以下のリンク先にある、以前の研究のプレスリリースを参照。
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/200311-150000.html
https://www.cira.kyoto-u.ac.jp/j/research/finding/210128-003000.html
※2ナノボディ
抗体には標的となるタンパク質に結合する部位(抗原結合部位)があるが、ナノボディはラクダ科の動物(ラクダ、アルパカ、リャマなど)の抗体の抗原結合部位であり、元となった抗体と同じく特定のタンパク質に結合する機能を持つ。ラクダ科動物の抗体を元にしているのは、他の多くの哺乳類の抗体が重鎖と軽鎖の二つから構成されているのに対し、ラクダ科動物の抗体は重鎖のみで構成されているため、遺伝子導入で発現させる場合などにおいては扱いやすいからである。
※3インテイン
タンパク質の一種であり、mRNAから翻訳された時点では前駆体となるタンパク質の内部にその一部として存在するが、その後にタンパク質スプライシングと呼ばれる現象により前駆体から切り出される。この切り出しの際、インテインの両端それぞれに隣接している部分(この部分をエクステインと呼ぶ)同士が融合する。すなわち、「エクステイン-インテイン-エクステイン」という一つのタンパク質だったものが、「エクステイン-エクステイン」+「インテイン」の二つに分かれる。分割インテインと呼ばれるタイプのインテインの場合、N-インテインとC-インテインの二つに分かれており、「エクステイン-N-インテイン」+「C-インテイン-エクステイン」の二つのタンパク質が「エクステイン-N-インテイン/C-インテイン複合体-エクステイン」の状態を経て「エクステイン-エクステイン」+「N-インテイン/C-インテイン複合体」となる。本研究で用いたのは、この分割インテインである。
翻訳活性化能を持つVPgと呼ばれるタンパク質を、RNA結合能を持つMS2コートタンパク質と融合させることで作られた人工翻訳制御因子。MS2コートタンパク質は特定のRNAモチーフを持つRNAに結合するため、この結合モチーフを持つmRNAの翻訳をVPgの作用により活性化できる。ただし、MS2コートタンパク質と非常に強く結合するRNAモチーフを持つmRNAの場合、mRNAの情報が読み取られるのを妨げるのかむしろ翻訳が抑制される。詳細は以下のリンク先にある、以前の研究のプレスリリースを参照。
https://www.cira.kyoto-u.ac.jp/j/pressrelease/news/200311-150000.html
https://www.cira.kyoto-u.ac.jp/j/research/finding/210128-003000.html
※2ナノボディ
抗体には標的となるタンパク質に結合する部位(抗原結合部位)があるが、ナノボディはラクダ科の動物(ラクダ、アルパカ、リャマなど)の抗体の抗原結合部位であり、元となった抗体と同じく特定のタンパク質に結合する機能を持つ。ラクダ科動物の抗体を元にしているのは、他の多くの哺乳類の抗体が重鎖と軽鎖の二つから構成されているのに対し、ラクダ科動物の抗体は重鎖のみで構成されているため、遺伝子導入で発現させる場合などにおいては扱いやすいからである。
※3インテイン
タンパク質の一種であり、mRNAから翻訳された時点では前駆体となるタンパク質の内部にその一部として存在するが、その後にタンパク質スプライシングと呼ばれる現象により前駆体から切り出される。この切り出しの際、インテインの両端それぞれに隣接している部分(この部分をエクステインと呼ぶ)同士が融合する。すなわち、「エクステイン-インテイン-エクステイン」という一つのタンパク質だったものが、「エクステイン-エクステイン」+「インテイン」の二つに分かれる。分割インテインと呼ばれるタイプのインテインの場合、N-インテインとC-インテインの二つに分かれており、「エクステイン-N-インテイン」+「C-インテイン-エクステイン」の二つのタンパク質が「エクステイン-N-インテイン/C-インテイン複合体-エクステイン」の状態を経て「エクステイン-エクステイン」+「N-インテイン/C-インテイン複合体」となる。本研究で用いたのは、この分割インテインである。
論文情報
掲載誌:ACS Synthetic Biology
論文タイトル:Versatile Design of Intracellular Protein-Responsive Translational Regulation System for Synthetic mRNA
DOI:https://doi.org/10.1021/acssynbio.1c00567
研究者プロフィール

位髙 啓史 (イタカ ケイジ) Keiji Itaka
東京医科歯科大学 生体材料工学研究所
生体材料機能医学分野 教授
・研究領域
mRNA・核酸医薬、遺伝子治療、DDS(Drug Delivery System)、バイオマテリアル、整形外科
東京医科歯科大学 生体材料工学研究所
生体材料機能医学分野 教授
・研究領域
mRNA・核酸医薬、遺伝子治療、DDS(Drug Delivery System)、バイオマテリアル、整形外科

中西 秀之 (ナカニシ ヒデユキ) Hideyuki Nakanishi
東京医科歯科大学 生体材料工学研究所
生体材料機能医学分野 プロジェクト助教
・研究領域
mRNA・核酸医薬、遺伝子治療、合成生物学
東京医科歯科大学 生体材料工学研究所
生体材料機能医学分野 プロジェクト助教
・研究領域
mRNA・核酸医薬、遺伝子治療、合成生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学 生体材料工学研究所
生体材料機能医学分野 位髙 啓史 (イタカ ケイジ)
E-mail:itaka.bif[@]tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp

