「認知症の原因タンパク質が脳炎症を起こす仕組みを解明」【岡澤均 教授】
「認知症の原因タンパク質が脳炎症を起こす仕組みを解明」
― 脳のミクログリアはタウ蛋白をウィルスと間違える? ―

岡澤 均(おかざわ ひとし) 難治疾患研究所/脳統合機能研究センター 神経病理学分野 教授(右上)
金 美花(じん めいふぁ) 難治疾患研究所 神経病理学分野 大学院生(左上)
塩飽 裕紀(しわく ひろき) 大学院医歯学総合研究科 精神行動医科学分野 助教(左下)
田中 ひかり(たなか ひかり) 難治疾患研究所 神経病理学分野 助教(右下)
ポイント
- アルツハイマー病などの神経変性疾患に関与するタウ蛋白質※1が脳炎症を誘発する分子メカニズムを解明しました。
- PQBP1を使って、脳内ミクログリア※2はタウ蛋白質を認識することを発見しました。
- タウ蛋白質と結合したPQBP1※3はcGAS-STING系※4の細胞内シグナルを誘導して、ミクログリアの炎症反応※5を誘発することを示しました。
- 上記の分子メカニズムは、エイズウィルスに対して自然免疫を担うマクロファージ※6が起こす反応と同一のものでした。
- 脳内ミクログリアに限定してPQBP1を抑制することで、タウ蛋白質による脳炎症を抑えることができることを示しました。
研究の背景
岡澤教授の研究グループは、1998年にポリグルタミン配列に対する結合蛋白質としてPQBP1という分子を発見しました。ハンチントン病や脊髄小脳失調症の原因蛋白質にはグルタミンが繰り返すポリグルタミン配列が含まれることが多く、しかも、ポリグルタミン配列中のグルタミンの繰り返し数が増えると病気を発症することが知られています。岡澤教授の研究グループは、これらの神経変性疾患の病態を担う候補分子としてPQBP1を発見しました。実際、PQBP1はハンチントン病や脊髄小脳失調症の原因蛋白質と結合することで、転写やDNA損傷修復機能が低下して発症につながることも確認できました(Okazawa et al, Neuron 2002; Fujita et al, Nature Commun 2013)。さらに、アルツハイマー病においても、別な病態経路からPQBP1の機能低下が起こり、これが神経細胞機能の低下につながることも分かりました(Tanaka et al, Mol Psychiatry 2018)。また、PQBP1に先天的な遺伝子変異があると、患者さんの知的機能が低下することも、ヨーロッパの多施設共同研究から解明されました(Kalscheuer et al, Nature Genet 2003)。 一方、アメリカのSanford-Burnham 医学研究所が、免疫系細胞のマクロファージにおいては、ヒト免疫不全ウィルスHIV(エイズウィルス)をマクロファージ細胞が検知する際の細胞内受容体としてPQBP1が機能していることを発見しました(Yoh et al, Cell 2015)。
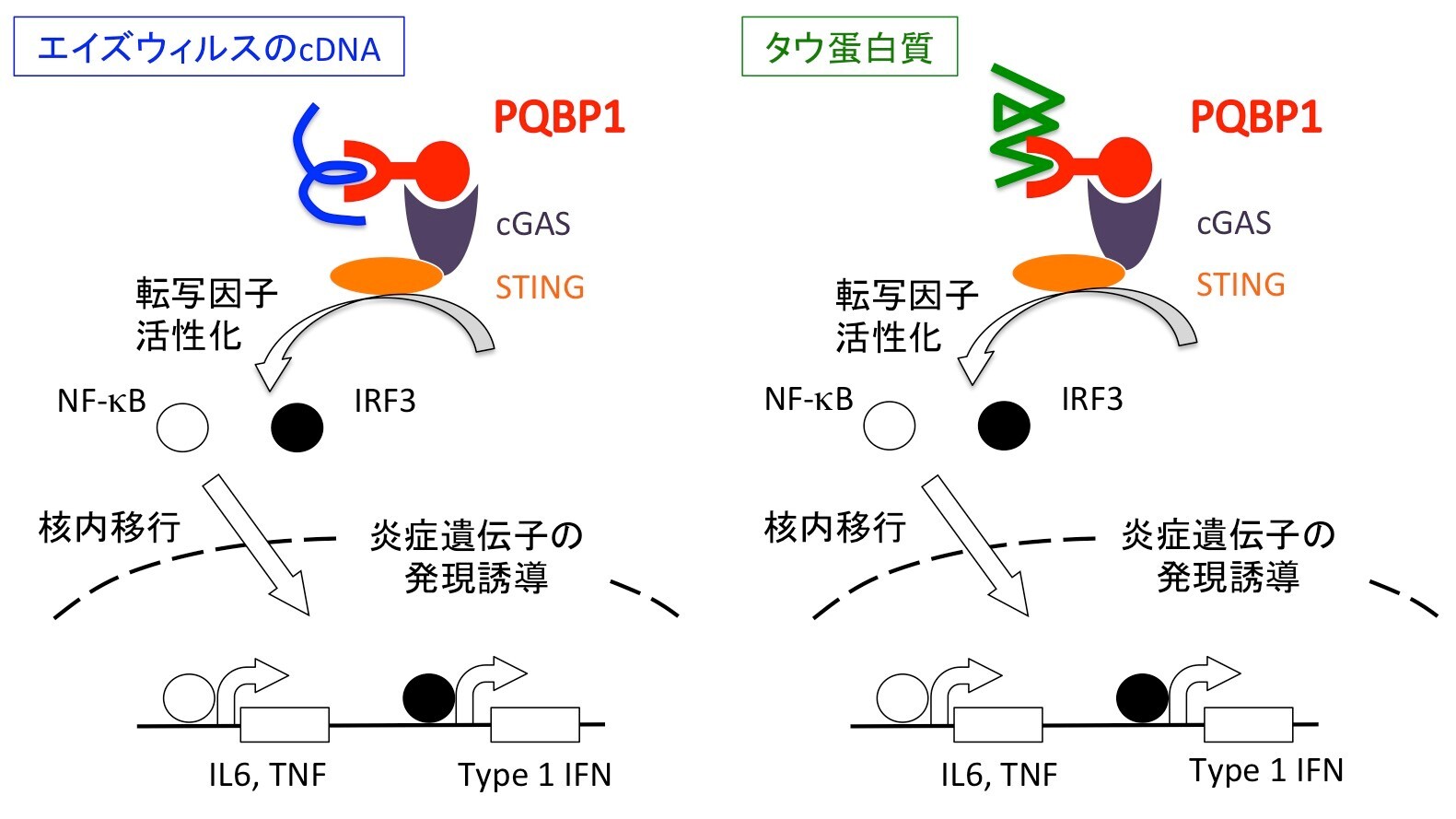
図1: ミクログリアにおいて、エイズウィルスへの反応とタウ蛋白質に対する反応は同じメカニズムを用いている
ミクログリアは、エイズウィルスcDNAを感知する細胞内受容体としてPQBP1を用いて、炎症性遺伝子の発現を誘導する(左図)。まったく同様な仕組みを用いて、ミクログリアはタウ蛋白質を感知して、炎症を惹起する(右図)。これは、あたかも自分由来の蛋白質であるタウ蛋白質を外来性病原体であるウィルスと『間違えて』反応しているようにも見える。
そこで、岡澤教授の研究グループは、マクロファージに相当するミクログリアが、複数の神経変性疾患蛋白質と結合することが知られているPQBP1を介して、タウ蛋白質に対して反応しているのではないかという仮説を立てて検証しました。実際に実験を行うと、想像したように、タウ蛋白質はPQBP1と結合することが物理的に証明されて、ミクログリアに取り込まれた後に、細胞の中でもタウ蛋白質はPQBP1と結合していました。また、ミクログリアの中のPQBP1を欠損させると、ミクログリアのタウ蛋白質に対する炎症反応は極端に低下することが、培養ミクログリアあるいは脳内ミクログリアにおいて観察できました。特に、タウ蛋白質を脳内に注入するとマウスは認知症の症状をきたしますが、ミクログリア特異的にPQBP1を欠損させたマウス※7 においては、脳炎症と同時に認知機能低下も大幅に改善されました。
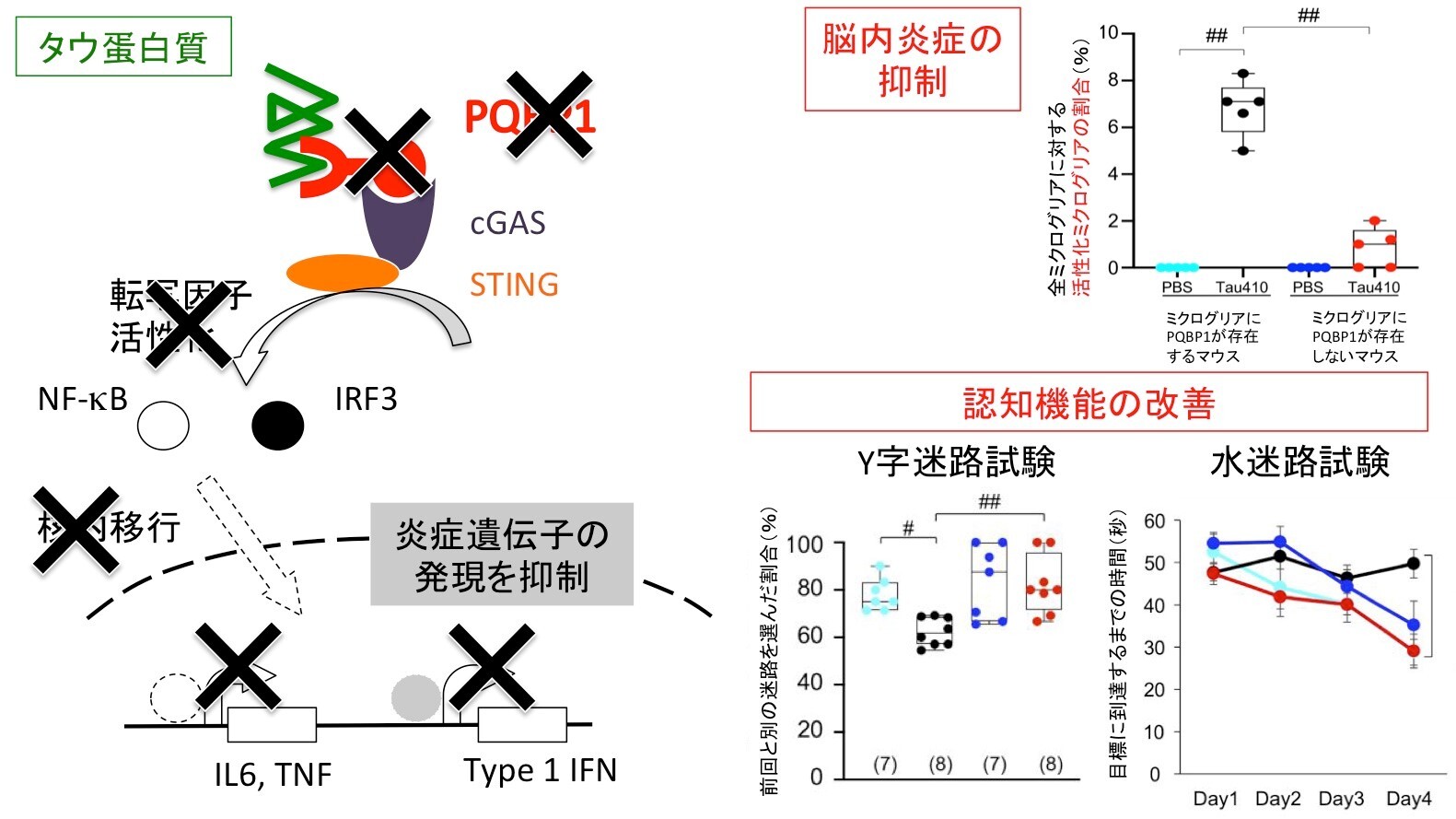
研究成果の概要と意義
一方、近年では、アルツハイマー病のもう一つの原因物質であるアミロイドが、病原体をトラップする自然免疫系の防御物質であるという仮説(Moir et al, Alzheimer’s & Dementia 2018) も提唱されています。近年、抗体などの獲得免疫系が進化する前から身体に備わっていた自然免疫系と、神経変性疾患との関係についての研究が急速に進歩しており、今回の研究成果が契機となって、ウィルス感染症と神経変性疾患が互いにどのように影響を与えるのかについての理解が進むことが期待されます。
また、今回の研究成果から、PQBP1のミクログリアにおける病態機能が解明されました。先行研究では、アルツハイマー病態下のニューロンにおけるPQBP1の機能が明らかになっています(Tanaka et al, Mol Psychiatry 2018)。したがって、脳のそれぞれの細胞でPQBP1機能を適切に調節することが、神経変性疾患病態からの回復、さらには生理的状態での脳機能活性化につながる可能性も生まれました。これらの知見が将来的に革新的な治療法に発展することも期待できます。
用語解説
※1 タウ蛋白質
タウ蛋白質は、細胞骨格蛋白質の一つであり、神経突起の伸長など重要な神経機能に関わっています。一方でアルツハイマー病や前頭側頭葉変性症の一部を含むタウオパチーと呼ばれる神経変性疾患では、神経細胞の内部で蓄積・凝集して細胞を障害すると考えられています。他にも、タウ蛋白質の凝集は、ハンチントン病やパーキンソン病の病態にも関与すると報告されています。近年、パーキンソン病の原因蛋白質であるアルファシヌクレインが、腸管の神経叢から脳に伝わってくるという現象が知られ、プリオン病のメカニズムと類似しているのではという議論がなされています。その議論の発展として、タウ蛋白質を含む神経変性疾患原因蛋白質は一般的にプリオン蛋白と同様に、神経細胞から細胞外に放出され、再び細胞に取り込まれて、伝搬していくという仮説が一般的になっています。
※2 ミクログリア
脳組織を構成する細胞は大きく分けて、ニューロン(神経細胞)とグリア細胞です。ミクログリアは、グリア細胞の一種であり、発生学的には単核球・マクロファージと共通していると考えられ、全身組織のマクロファージや樹状細胞と同様に、脳において自然免疫の中心的役割を果たしています。
※3 PQBP1
ポリグルタミン配列結合タンパク質1(Polyglutamine binding protein 1)。岡澤教授らがポリグルタミン配列をbaitとしてyeast two hybrid screening を行い初めて発見したタンパク質で(Imafuku et al., Biochem. Biophys. Res. Commun 1998; Waragai et al., Hum Mol Genet 1999)、ポリグルタミン病タンパク質あるいは他の正常タンパク質に結合します(Okazawa et al., Neuron 2002)。さらに、岡澤教授らおよび他の研究グループの報告により、PQBP1は、アルツハイマー病、ハンチントン病、脊髄小脳失調症など複数の神経変性疾患に関わり治療標的となること(Waragai et al., Hum Mol Genet 1999; Okazawa et al., Neuron 2002; Tanaka et al., Mol Psychiatry 2018)、遺伝性知的障害の原因遺伝子であること(Kalsheuer et al., Nat Genet 2003; Ito et al., Mol Psychiatry 2015)が明らかになり、さらに、樹状細胞のHIVウイルスcDNAに対する細胞内受容体として自然免疫を制御すること(Yeo et al., Cell 2015)も報告されました。また、分子機能面では、RNAの転写とスプライシングに関与することが知られています(Waragai et al., BBRC 2000; Okazawa et al., Neuron 2002 ; Mizuguchi et al., Nat Commun2014)
※4 cGAS-STING系
自然免疫では、病原体に特有な構造を認識することに始まります。細胞膜にはToll-like receptor (TLR)などのパターン認識受容体が存在しますが、細胞内にもパターン認識受容体があることがわかってきました、cGAS(cyclic GMP-AMP synthase)-STING(stimulator of interferon genes)は細胞内パターン認識受容体の代表格です。この際に、ZCCHC3、G3BP1さらにPQBP1などのco-sensorがcGASと協力して、病原体の特有構造を認識する例が近年報告されています。PQBP1は、エイズウイルスなどの病原体が感染して、逆転写酵素により細胞内でcDNAができると、cGASとともにcDNAを認識し、STINGを介した炎症遺伝子の発現誘導を起こすことが知られています。
※5 ミクログリアの炎症反応
ストレスや感染によって過剰に活性化したミクログリアは、TNF-αやIL−6などのサイトカイン産生を亢進させるにより神経炎症を引き起こすことが知られています。またこのようなミクログリアを介した神経炎症は、アルツハイマー病、パーキンソン病などの神経変性疾患の進行に関わるということが報告されています。
※6 マクロファージ
貪食細胞として知られる白血球の1種です。全身の組織に広く分布しており、体内に侵入した細菌などの病原体に対してパターン認識受容体などを介した防御反応を行い、抗体を用いる獲得免疫よりも進化的に古いタイプの免疫反応である自然免疫において主要な役割を果たしています。
※7 ミクログリア特異的PQBP1欠損マウス
今回の研究では、ミクログリア特異的に(ミクログリアにおいてのみ)、タモキシフェン誘導性にPQBP1を欠損させることができるコンディショナルノックアウトマウスを、新たに作成して実験に用いています。
論文情報
掲載誌:Nature Communications
論文タイトル:Tau activates microglia via the PQBP1-cGAS-STING pathway to promote brain inflammation
DOI:https://doi.org/10.1038/s41467-021-26851-2
研究者プロフィール

岡澤 均(オカザワ ヒトシ) Hitoshi Okazawa
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 教授、脳統合機能研究センター長
研究領域
神経内科学、神経科学、神経病理学、分子生物学

金 美花(ジン メイファ) Meihua Jin
東京医科歯科大学難治疾患研究所
神経病理学分野 大学院生
研究領域
神経科学、神経病理学、分子生物学

東京医科歯科大学 大学院医歯学総合研究科
精神行動医科学分野 助教
研究領域
神経科学、精神医学、分子生物学

東京医科歯科大学難治疾患研究所
神経病理学分野 助教
研究領域
神経科学、神経病理学、分子生物学
問い合わせ先
<研究に関すること>
東京医科歯科大学難治疾患研究所/脳統合機能研究センター
神経病理学分野 氏名 岡澤 均(オカザワ ヒトシ)
E-mail: okazawa.npat[@]mri.tmd.ac.jp
<報道に関すること>
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
E-mail:kouhou.adm[@]tmd.ac.jp

