「アルツハイマー病と前頭側頭葉変性症の共通病態を発見」【岡澤均 教授】
― 新たなシグナルを標的とする早期治療法の開発にむけて ―

岡澤 均(オカザワ ヒトシ)教授 難治疾患研究所 神経病理学分野 (右)
藤田 慶大(フジタ キョウタ)助教 同上 (左)
ポイント
| ● | 前頭側頭葉変性症においてタウタンパク質の異常リン酸化が生じることを示しました。 |
| ● | 異常リン酸化タウタンパク質はシナプスを障害していました。 |
| ● | タウタンパク質異常リン酸化の上流シグナルを明らかにしました。 |
| ● | 異常リン酸化タウタンパク質によるシナプス障害はアルツハイマー病と前頭側頭葉変性症に共通する病態と考えられました。 |
| ● | タウタンパク質と異常リン酸化シグナルを標的とする早期治療の可能性を示しました。 |
東京医科歯科大学・難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤 均教授の研究グループは、新規に作成した前頭側頭葉変性症(注1)のモデルマウスを用いて、アルツハイマー病に次ぐ認知症の原因である前頭側頭葉変性症において病態早期に生じるタウタンパク質リン酸化が、シナプス障害を通じて認知症状を引き起こしていることを明らかにしました。この研究は、東京大学・宮野悟教授、名古屋大学・貝淵弘三教授らとの共同研究として行われ、平成26年度から始まった文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)のもとで実施されたもので、一部は、脳科学研究戦略推進プログラム課題E、新学術領域研究『シナプス・ニューロサーキットパソロジーの創成』の支援を受けました。その研究成果は、国際科学誌Nature Communications(ネイチャー・コミュニケーションズ)に、2018年1月30日午前10時(英国時間)にオンライン版で発表されました。
研究の背景
アルツハイマー病、前頭側頭葉変性症、レヴィー小体型認知症の3大認知症は、高齢化社会の日本で大きな社会問題となっています。アルツハイマー病は、2025年には高齢者の5人に1人が罹患すると言われています。前頭側頭葉変性症とレヴィー小体型認知症は、アルツハイマー病に次いで頻度が高く、概ね、アルツハイマー病の2分の1から3分の1ほどの患者数があると言われています。これらの3大認知症には遺伝の影響が強い家族性認知症と遺伝的要素が目立たない孤発性認知症がありますが、家族性前頭側頭葉変性症の中では、タウ(tau)とプログラニュリン(PGRN)(注2)の遺伝子変異の頻度が比較的高いと言われています。アルツハイマー病ではアミロイド、レヴィー小体型認知症ではアルファシヌクレインが脳内の神経細胞の内あるいは外に蓄積して凝集します。一方、本研究が対象とした前頭側頭葉変性症では、タウタンパク質の凝集が見られるケースと見られないケースがあり、後者ではTDP43 というタンパク質が凝集している場合が多く、プログラニュリン遺伝子変異を伴う前頭側頭葉変性症も、これに相当します。
これらの3大認知症については、根本的な治療法(病態修飾治療法(注3): Disease Modifying Therapy:DMT とも言う)は確立されていません。また、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になっていません。例えば、アルツハイマー病では欧米の巨大製薬企業を中心にアミロイド凝集除去を目的としてアミロイド抗体を用いた多くの国際的臨床試験(日本を含む)が行われてきましたが、アミロイド除去には成功したものの、臨床症状の改善には至っていません。この事例は、どのような時期に如何なる不可逆的病態に至るかを明らかにすることが非常に重要であることを示しています。前頭側頭葉変性症とレヴィー小体型認知症では、治療開発はアルツハイマー病よりも遅れた状況にあります。
これらの3大認知症については、根本的な治療法(病態修飾治療法(注3): Disease Modifying Therapy:DMT とも言う)は確立されていません。また、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になっていません。例えば、アルツハイマー病では欧米の巨大製薬企業を中心にアミロイド凝集除去を目的としてアミロイド抗体を用いた多くの国際的臨床試験(日本を含む)が行われてきましたが、アミロイド除去には成功したものの、臨床症状の改善には至っていません。この事例は、どのような時期に如何なる不可逆的病態に至るかを明らかにすることが非常に重要であることを示しています。前頭側頭葉変性症とレヴィー小体型認知症では、治療開発はアルツハイマー病よりも遅れた状況にあります。
研究成果の概要
本研究において、岡澤グループは新たに作成した変異プログラニュリン遺伝子を持つノックインマウス(注4)より採取した大脳組織を用いて、経時的に網羅的リン酸化プロテオーム解析(注5)を行いました。得られた結果を検討した結果、予想外にも、TDP43 タンパク質の脳内凝集が見られる以前に、タウタンパク質の203番目アミノ酸(Ser203)のリン酸化の異常増加が変異プログラニュリンノックインマウスの脳内で検出されました。さらに岡澤グループが解析を進めたところ、この203番目セリンがリン酸化したタウタンパク質(pSer203 タウタンパク質)はヒト前頭側頭葉変性症患者脳でも確認され、pSer203 タウタンパク質は神経細胞のシナプスに局在していました。このような、異常リン酸化タウタンパク質のシナプスへの局在は、既にアルツハイマー病モデルでも報告されており、シナプスを障害して認知症状につながることが示唆されています(文献1-4)。そこで、タウタンパク質のAAV ノックダウンベクター(注6)を用いて変異プログラニュリンノックインマウスの遺伝子治療を行ったところ、減少していたシナプスの数が正常化して認知障害の症状も改善しました。
さらに、岡澤グループは、プログラニュリン遺伝子変異と、タウタンパク質のSer203 異常リン酸化の関係を調べました。まず、プログラニュリン遺伝子変異はプログラニュリンタンパク質の減少につながっていました。次に、プログラニュリンは、Tyro3(注7)という受容体型チロシンキナーゼ(注8)とGas6(注9)という分泌タンパク質との結合を阻害することが分かりました。また、Gas6 がTyro3に結合してこれを活性化すると、PKC, MAPK あるいはB-raf というリン酸化酵素(キナーゼ)によるTyro3 下流シグナルが活性化され、最終的にタウタンパク質のSer203 異常リン酸化につながることが明らかになりました(下図 左側)。これらのキナーゼに対する阻害薬あるいはAAV ノックダウンベクターを用いて、変異プログラニュリンノックインマウスの治療実験を行ったところ、いずれも減少していたシナプスの数が正常化して認知障害の症状も改善しました(下図 右側)。
さらに、岡澤グループは、プログラニュリン遺伝子変異と、タウタンパク質のSer203 異常リン酸化の関係を調べました。まず、プログラニュリン遺伝子変異はプログラニュリンタンパク質の減少につながっていました。次に、プログラニュリンは、Tyro3(注7)という受容体型チロシンキナーゼ(注8)とGas6(注9)という分泌タンパク質との結合を阻害することが分かりました。また、Gas6 がTyro3に結合してこれを活性化すると、PKC, MAPK あるいはB-raf というリン酸化酵素(キナーゼ)によるTyro3 下流シグナルが活性化され、最終的にタウタンパク質のSer203 異常リン酸化につながることが明らかになりました(下図 左側)。これらのキナーゼに対する阻害薬あるいはAAV ノックダウンベクターを用いて、変異プログラニュリンノックインマウスの治療実験を行ったところ、いずれも減少していたシナプスの数が正常化して認知障害の症状も改善しました(下図 右側)。
図の説明
左、アルツハイマー病と前頭側頭葉変性症は異常リン酸化タウタンパク質のシナプス障害において共通する。
右、アルツハイマー病との共通病態および前頭側頭葉変性症の特異的病態を標的とする新規治療開発の道筋を示した。
右、アルツハイマー病との共通病態および前頭側頭葉変性症の特異的病態を標的とする新規治療開発の道筋を示した。
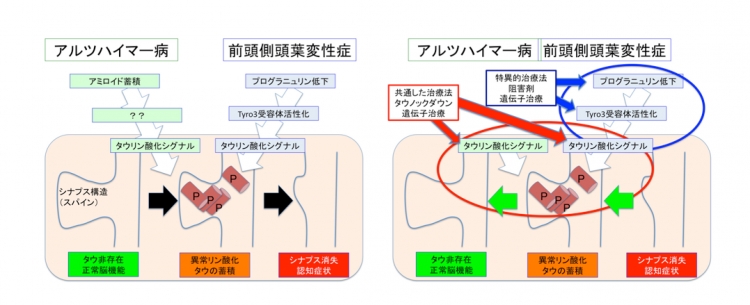
研究成果の意義
前頭側頭葉変性症はアルツハイマー病に次ぐ認知症の原因です。本研究において、岡澤グループは、前頭側頭葉変性症とアルツハイマー病に共通する病態、すなわちタウタンパク質異常リン酸化とそのシナプス局在、を発見しました。さらに本研究は、タウタンパク質異常リン酸化につながる新たなシグナルを解明しました。アルツハイマー病においては、アミロイド抗体療法の失敗の後に、タウタンパク質が新たな治療開発の標的分子として注目されています。本研究は、この戦略が前頭側頭葉変性症においても適応可能であることを示唆すると同時に、具体的な治療手法を複数提示しました。本研究は、治療標的分子として従来は知られていなかったTyro3, Gas6, B-raf らの分子を示し、それらを阻害する作用を持つ、既に非神経疾患に臨床使用されているVemurafenib などの薬剤や、AAV ノックダウンベクターを用いた遺伝子治療が、将来的な治療開発の選択肢であることを、具体的に証明しました。同時に、本研究成果は、現在の認知症研究の焦点となっている発症前の早期病態解明と早期治療法開発を明確に示した点でも、大きな意義を持つと考えられます。
用語の解説
注1:前頭側頭葉変性症
前頭葉症状、側頭葉症状に優位な症状を来す認知症の症候学的概念である前頭側頭葉型認知症(FTD)に対して、前頭葉、側頭葉に優位な脳萎縮・神経変性を示す変性疾患の病理学的概念(FTLD)。もともと、アミロイド陰性で細胞内タウタンパク質凝集(神経原線維変化)を持ち、前頭葉、側頭葉に優位な脳萎縮を示す『ピック病』などがプロトタイプとなった概念(FTLD-tau)であったが、タウタンパク質の凝集が見られないタイプがあることが知られるようになった。このタイプにはTDP43、FUS、p63などのタンパク質凝集が見られることから、それぞれの凝集タンパク質を指標に病理学的に診断分類されている(FTLD-TDP, FTLD-FUS, FTLD-UPSなど)。 一方、家系の遺伝学的解析から、Tau, Progranulin, CHMP2B, VCP, TDP43, C9orf72などの原因遺伝子が複数同定された。この結果、病理学的分類と遺伝子型分類の概ねの対応が明らかになっており、Progranulin, VCP, TDP43, C9orf72の遺伝子変異ではTDP43の凝集(封入体)が見られる。Tau遺伝子変異はタウの凝集、FUS遺伝子変異はFUSタンパク質凝集が見られるが、C9orf72の一部、CHMP2BはTDP43が見られず、CHMP2B遺伝子変異ではp63の封入体が見られる(FTLD-UPS)。
これらのFTLDは概ねはFTDとしての特徴が見られるが、言語障害、失語、人格障害、脱抑制などが目立つ症例が多い。このため、犯罪などの反社会的行動のためにマスコミを騒がすこともある。
注2:プログラニュリン
88kDのタンパク質であり、抗炎症作用、神経栄養作用があると考えられている。一方、タンパク分解酵素(MMP-9, -14, ADAMTS-7など)に分解されて8種類のグラニュリンになり、これらは逆に炎症作用を持つとされる。プログラニュリンの受容体としてはTNF受容体(TNFR)、Sortilin、EphA2などが報告されているが、議論が残っている。本研究では、TNFRとしての作用は支持されなかったが、Gas6がTyro3受容体に結合する際に、Gas6と結合して、Gas6-Tyro3結合を阻害することが示された。
注3:病態修飾治療法
疾患の原因となる病態機序を制御し、進行を抑制することを目的とした治療法。神経機能を補填することを目的とした症状改善療法 (symptomatic therapy)では、仮に治療開始後に症状が一過性に改善しても、病態進行による臨床症状の悪化は防ぎきれない。これに対して、疾患修飾治療法は、疾患の進行を抑え、場合によっては停止することが理論的には可能である。早期であれば、症状が改善して正常状態に戻ることも動物実験では示されている。
注4:ノックインマウス
ノックインベクターあるいはゲノム編集技術を用いて、胚細胞の染色体遺伝子の一部分を置換することにより、作成された遺伝子組み換えマウスのことを言う。トランスジェニックマウスのように、目的遺伝子の数(コピー数)が増えたり、人為的な遺伝値調節領域(エンハンサー、プロモーター)による過剰量の遺伝子発現が起きないため、より自然なマウスモデルと考えられている。
注5:網羅的リン酸化プロテオーム解析
生体内の全てのタンパク質の全てのリン酸化部位を対象に質量分析を用いた定量を行い、正常状態と疾患状態など、複数の条件下での変化などを、網羅的に捉える技術。
注6:AAVノックダウンベクター
アデノ随伴ウィルスは今日最も遺伝子治療に用いられているベクターである。無毒化したウィルスゲノムに発現させたい標的遺伝子を組み込む場合と、標的遺伝子を抑制(ノックダウン)するためにshRNA, siRNA, アプタマーなどを組み込む場合がある。
注7:Tyro3
TYRO3、AXL、MERと相同性があるもとからTAM受容体ファミリーと呼ばれる受容体型チロシンキナーゼの一つ。Gas6、Protein Sなどがリガンドとされているが、生理作用については分からないことが多い。脳において、特に神経変性病態での機能は報告はなく、この研究が初めてのものである。
注8:受容体型チロシンキナーゼ
タンパク質リン酸化酵素(キナーゼ)には、アミノ酸配列のセリン/スレオニンをリン酸化するもの(セリン/スレオニンキナーゼ)とチロシンをリン酸化するもの(チロシンキナーゼ)がある。また、細胞内局在の上では、細胞質、核に局在するものや、膜に一部が挿入された形で存在するもの(膜型キナーゼ)があり、後者の多くは、分泌タンパク質や小分子と結合する、あるいは隣接する別細胞の膜分子と結合することで、分子構造を変化させて自身のもつキナーゼ活性を上昇させる。これにより、基質となる次の分子をリン酸化して、膜上の変化を細胞内にシグナルとして伝える。
注9:Gas6
アポトーシスなどの細胞死に際して細胞表面にフォスファチジルセリンと共に表出され、マクロファージの膜にあるTAM受容体に結合して貪食作用に影響するとされる。また、Gas6-Tyro3の結合は、破骨細胞やSertoli細胞の貪食作用を活性化し、ジカウィルスの細胞内取り込みにも、ウィルス膜Gas6と細胞側TAM受容体が関連すると言われる。
注10:阻害薬
酵素の活性部位などにはまり込むなどして、酵素活性を阻害する小分子のこと。
文献
1. Ittner LM, et al. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell 142, 387-397 (2010).
2. Hoover BR, et al. Tau mislocalization to dendritic spines mediates synaptic dysfunction independently of neurodegeneration. Neuron 68, 1067-1081 (2010).
3. Haass C, Mandelkow E. Fyn-tau-amyloid: a toxic triad. Cell 142, 356-358 (2010).
4. Spires-Jones TL, Hyman BT. The intersection of amyloid beta and tau at synapses in Alzheimer's disease. Neuron 82, 756-771 (2014).
前頭葉症状、側頭葉症状に優位な症状を来す認知症の症候学的概念である前頭側頭葉型認知症(FTD)に対して、前頭葉、側頭葉に優位な脳萎縮・神経変性を示す変性疾患の病理学的概念(FTLD)。もともと、アミロイド陰性で細胞内タウタンパク質凝集(神経原線維変化)を持ち、前頭葉、側頭葉に優位な脳萎縮を示す『ピック病』などがプロトタイプとなった概念(FTLD-tau)であったが、タウタンパク質の凝集が見られないタイプがあることが知られるようになった。このタイプにはTDP43、FUS、p63などのタンパク質凝集が見られることから、それぞれの凝集タンパク質を指標に病理学的に診断分類されている(FTLD-TDP, FTLD-FUS, FTLD-UPSなど)。 一方、家系の遺伝学的解析から、Tau, Progranulin, CHMP2B, VCP, TDP43, C9orf72などの原因遺伝子が複数同定された。この結果、病理学的分類と遺伝子型分類の概ねの対応が明らかになっており、Progranulin, VCP, TDP43, C9orf72の遺伝子変異ではTDP43の凝集(封入体)が見られる。Tau遺伝子変異はタウの凝集、FUS遺伝子変異はFUSタンパク質凝集が見られるが、C9orf72の一部、CHMP2BはTDP43が見られず、CHMP2B遺伝子変異ではp63の封入体が見られる(FTLD-UPS)。
これらのFTLDは概ねはFTDとしての特徴が見られるが、言語障害、失語、人格障害、脱抑制などが目立つ症例が多い。このため、犯罪などの反社会的行動のためにマスコミを騒がすこともある。
注2:プログラニュリン
88kDのタンパク質であり、抗炎症作用、神経栄養作用があると考えられている。一方、タンパク分解酵素(MMP-9, -14, ADAMTS-7など)に分解されて8種類のグラニュリンになり、これらは逆に炎症作用を持つとされる。プログラニュリンの受容体としてはTNF受容体(TNFR)、Sortilin、EphA2などが報告されているが、議論が残っている。本研究では、TNFRとしての作用は支持されなかったが、Gas6がTyro3受容体に結合する際に、Gas6と結合して、Gas6-Tyro3結合を阻害することが示された。
注3:病態修飾治療法
疾患の原因となる病態機序を制御し、進行を抑制することを目的とした治療法。神経機能を補填することを目的とした症状改善療法 (symptomatic therapy)では、仮に治療開始後に症状が一過性に改善しても、病態進行による臨床症状の悪化は防ぎきれない。これに対して、疾患修飾治療法は、疾患の進行を抑え、場合によっては停止することが理論的には可能である。早期であれば、症状が改善して正常状態に戻ることも動物実験では示されている。
注4:ノックインマウス
ノックインベクターあるいはゲノム編集技術を用いて、胚細胞の染色体遺伝子の一部分を置換することにより、作成された遺伝子組み換えマウスのことを言う。トランスジェニックマウスのように、目的遺伝子の数(コピー数)が増えたり、人為的な遺伝値調節領域(エンハンサー、プロモーター)による過剰量の遺伝子発現が起きないため、より自然なマウスモデルと考えられている。
注5:網羅的リン酸化プロテオーム解析
生体内の全てのタンパク質の全てのリン酸化部位を対象に質量分析を用いた定量を行い、正常状態と疾患状態など、複数の条件下での変化などを、網羅的に捉える技術。
注6:AAVノックダウンベクター
アデノ随伴ウィルスは今日最も遺伝子治療に用いられているベクターである。無毒化したウィルスゲノムに発現させたい標的遺伝子を組み込む場合と、標的遺伝子を抑制(ノックダウン)するためにshRNA, siRNA, アプタマーなどを組み込む場合がある。
注7:Tyro3
TYRO3、AXL、MERと相同性があるもとからTAM受容体ファミリーと呼ばれる受容体型チロシンキナーゼの一つ。Gas6、Protein Sなどがリガンドとされているが、生理作用については分からないことが多い。脳において、特に神経変性病態での機能は報告はなく、この研究が初めてのものである。
注8:受容体型チロシンキナーゼ
タンパク質リン酸化酵素(キナーゼ)には、アミノ酸配列のセリン/スレオニンをリン酸化するもの(セリン/スレオニンキナーゼ)とチロシンをリン酸化するもの(チロシンキナーゼ)がある。また、細胞内局在の上では、細胞質、核に局在するものや、膜に一部が挿入された形で存在するもの(膜型キナーゼ)があり、後者の多くは、分泌タンパク質や小分子と結合する、あるいは隣接する別細胞の膜分子と結合することで、分子構造を変化させて自身のもつキナーゼ活性を上昇させる。これにより、基質となる次の分子をリン酸化して、膜上の変化を細胞内にシグナルとして伝える。
注9:Gas6
アポトーシスなどの細胞死に際して細胞表面にフォスファチジルセリンと共に表出され、マクロファージの膜にあるTAM受容体に結合して貪食作用に影響するとされる。また、Gas6-Tyro3の結合は、破骨細胞やSertoli細胞の貪食作用を活性化し、ジカウィルスの細胞内取り込みにも、ウィルス膜Gas6と細胞側TAM受容体が関連すると言われる。
注10:阻害薬
酵素の活性部位などにはまり込むなどして、酵素活性を阻害する小分子のこと。
文献
1. Ittner LM, et al. Dendritic function of tau mediates amyloid-beta toxicity in Alzheimer's disease mouse models. Cell 142, 387-397 (2010).
2. Hoover BR, et al. Tau mislocalization to dendritic spines mediates synaptic dysfunction independently of neurodegeneration. Neuron 68, 1067-1081 (2010).
3. Haass C, Mandelkow E. Fyn-tau-amyloid: a toxic triad. Cell 142, 356-358 (2010).
4. Spires-Jones TL, Hyman BT. The intersection of amyloid beta and tau at synapses in Alzheimer's disease. Neuron 82, 756-771 (2014).
論文情報
掲載誌:Nature Communications
論文タイトル:Targeting Tyro3 ameliorates a model of PGRN-mutant FTLD-TDP via tau-mediated synaptic pathology
論文タイトル:Targeting Tyro3 ameliorates a model of PGRN-mutant FTLD-TDP via tau-mediated synaptic pathology
問い合わせ先
研究に関すること
東京医科歯科大学 難治疾患研究所・脳統合機能研究センター
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat@mri.tmd.ac.jp
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat@mri.tmd.ac.jp
AMED事業に関すること
日本医療研究開発機構 脳と心の研究課
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm@amed.go.jp
〒100-0004 東京都千代田区大手町1-7-1
TEL:03-6870-2222 FAX:03-6870-2244
E-mail:brain-pm@amed.go.jp
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

