「発達期病態が脊髄小脳失調症の発症後予後に関与する」【岡澤均 教授】
― YAPdeltaCによる治療法開発にむけて ―

岡澤 均 (オカザワ ヒトシ)教授 難治疾患研究所 神経病理学分野(右)
藤田 慶大(フジタ キョウタ)助教 同上(左)
ポイント
| ● | 脊髄小脳失調症において発達期病態が予後を決める因子であることを示しました。 |
| ● | 脊髄小脳失調症においてYAPdeltaCが発達期病態に関わることを示しました。 |
| ● | YAPdeltaCはRORaの転写補助因子として小脳神経細胞成熟を制御することを解明しました。 |
| ● | YAPdeltaCの発達期発現量を調節することにより新規治療法の開発が期待できます。 |
東京医科歯科大学・難治疾患研究所/脳統合機能研究センター・神経病理学分野の岡澤 均教授の研究グループは、脊髄小脳失調症(注1)のモデルマウスを用いて、発症前のYAPdeltaCを介する発達期病態が発症後の予後の決定因子の1つであることを示しました。この研究は、シンガポール大学・マリウス・スドール博士らとの共同研究として行われ、新学術領域研究『シナプス・ニューロサーキットパソロジーの創成』および科学研究費補助金・基盤Aのもとで実施されたもので、一部は、平成26年度から始まった文部科学省『革新的技術による脳機能ネットワークの全容解明プロジェクト』(平成27年度から日本医療研究開発機構:AMEDへ移管)の支援を受けました。その研究成果は、国際科学誌Nature Communications(ネイチャー・コミュニケーションズ)に、2017年11月30日午前10時(英国時間)にオンライン版で発表されました。
研究の背景
脊髄小脳失調症1型は代表的な神経変性疾患の一つであり、アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症など他の神経変性疾患と同様に、根本的な治療法(病態修飾治療法(注2): Disease Modifying Therapy: DMTとも言う)は確立されていません。また、遺伝子変異によって引き起こされる病態についても、多くの知識が蓄積されてきているものの、どの時期からどのような病態が生じているのか、いつからどのような病態を標的に治療をすれば良いのか、については明確になっていません。例えば、アルツハイマー病ではアミロイド凝集除去を目的としたアミロイド抗体を用いた多くの臨床試験が行われてきましたが、アミロイド除去には成功したものの、臨床症状の改善には至っていません。この事例は、どのような時期に如何なる不可逆的病態に至るかを明らかにすることが非常に重要であることを示しています。
研究成果の概要
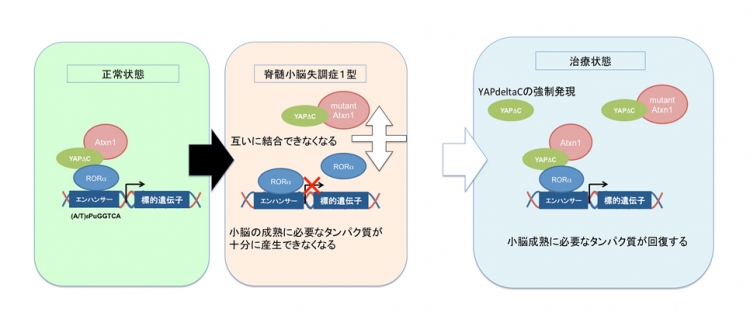
本研究では、先行研究(Hoshino et al, JCB 2006)で岡澤グループが発見した非典型的ネクローシス (TRIAD)(注3)における制御分子YAPdeltaC(注4)の脊髄小脳失調症1型における機能解明を目指して、YAPdeltaCのTet-ONマウス(注5)と Ataxin1-KIマウスを交配し、YAPdeltaCの時期特異的発現(注5)がAtaxin1-KIマウスの症状と生存期間にどのような影響を与えるかを検討しました。その結果、胎児期から生後8週までのYAPdeltaC発現が症状と生存期間を顕著に改善するものの、それ以後のYAPdeltaC発現は効果がほとんど見られないことが分かりました。
さらに、YAPdeltaCは正常型Ataxin1と協調して発達期の小脳神経細胞における遺伝子発現調節に重要な役割を果たすことが知られているRORalphaの機能を高める転写補助因子として働くこと、変異型Ataxin1はYAPdeltaCをRORalphaから切り離してしまうため、小脳神経細胞の成熟に必要な遺伝子発現を阻害することが明らかとなりました。YAPdeltaCを強制的に発現することでRORalphaとの結合を増やし、結果として小脳成熟に必要な遺伝子の発現量を回復することもわかりました。
さらに、YAPdeltaCは正常型Ataxin1と協調して発達期の小脳神経細胞における遺伝子発現調節に重要な役割を果たすことが知られているRORalphaの機能を高める転写補助因子として働くこと、変異型Ataxin1はYAPdeltaCをRORalphaから切り離してしまうため、小脳神経細胞の成熟に必要な遺伝子発現を阻害することが明らかとなりました。YAPdeltaCを強制的に発現することでRORalphaとの結合を増やし、結果として小脳成熟に必要な遺伝子の発現量を回復することもわかりました。
研究成果の意義
アルツハイマー病では、発症前の治療開始の効果を検討する臨床試験が米国で行われており、日本においても同様な臨床試験が計画されています。本研究は、脊髄小脳失調症モデルマウスにおいてYAPdeltaCを用いて発達期の小脳成熟関連遺伝子の発現量を回復させることが発症後予後の改善につながることを示しました。したがって、遺伝子診断が可能な脊髄小脳失調症では、発症前にYAPdeltaCの量を増やすことで、予防的治療あるいは病態修飾治療法を開発できる可能性があります。本研究は、アルツハイマー病のみでなく、神経変性疾患一般に、発症前の早期治療が必要であることを示した一例と考えられ、同時に、その際の治療標的分子を示した点で、大きな意義を持つと考えられます。
用語の解説
注1:脊髄小脳失調症
小脳失調症状を主体とする遺伝性神経変性疾患を指す。常染色体優性遺伝形式のものに限って言う場合が多い。常染色体劣性の場合は脊髄小脳変性症ということが多い。小脳症状に加え、病理的な変性の広がりに対応して、錐体路徴候、運動ニューロン障害、などが見られる。孤発性の小脳失調症は大半が自律神経症状を主兆の一つとする多系統変性症である。脊髄小脳失調症1型は、原因遺伝子Ataxin-1の第8エキソン内において、グルタミンをコードするCAGリピート配列が異常に伸長している。これにより、異常伸長したポリグルタミン鎖をもつ変異型Ataxin-1タンパク質が産生・蓄積する。
注2:病態修飾治療法
疾患の原因となる病態機序を制御し、進行を抑制することを目的とした治療法。神経機能を補填することを目的とした症状改善療法 (symptomatic therapy)では、仮に治療開始後に症状が一過性に改善しても、病態進行による臨床症状の悪化は防ぎきれない。これに対して、疾患修飾治療法は、疾患の進行を抑え、場合によっては停止することが理論的には可能である。早期であれば、症状が改善して正常状態に戻ることも動物実験では示されている。
注3:非典型的ネクローシス (TRIAD)
一般的な細胞死の形態として知られるアポトーシスやネクローシスとは異なる、新たな細胞死の形態として、岡澤グループが報告した (Hoshino et al., 2006)。TRIAD (transcriptional repression-induced atypical cell death)は、RNA polymerase II特異的阻害剤であるalpha-amanitinによる細胞死の研究より発見され、アポトーシスのような形態学的・生化学的特徴は持たず、オートファジー細胞死のようなオートファゴゾームの増加・拡張はない。ネクローシスの典型像と考えられているネクロプトーシスでは、RIP1/3を介するシグナル経路の活性化が知られているが、TRIADではRIP1/3シグナル活性化がなく、一方、小胞体の顕著な拡張が形態学的特徴であり、Hippo経路活性化とYAP/YAPdeltaC機能低下が生化学的特徴である(Mao et al., 2016)。
注4:YAPdeltaC
YAP (yes-associated protein)の神経型アイソフォームで、岡澤グループが2006年に報告した(Hoshino et al., 2006)。3つのアイソフォーム (ins13, ins25, ins61)が存在し、YAP同様WWドメイン(タンパク質との結合部位で、特徴としてPPXYモチーフをもつ)はもつが、C末端のp73へのtransactivation domainが欠損している。多くの転写因子は単独ではなく、複数の転写因子などによる複合体形成が必要である。YAPは、これら転写因子の機能を補助する転写共役因子である。YAPdeltaCは、TRIADに対して、ドミナントネガティブ様に細胞死を抑制することを、私達のグループが以前報告している。
注5:Tet-ONマウス・時期特異的発現
特定の遺伝子の発現を、任意の時期・場所において制御できるようしたトランスジェニックマウスの実験系である。リバーステトラサイクリン制御性トランス活性化因子 (rtTA)がテトラサイクリン誘導体であるドキシサイクリンと結合すると、テトラサイクリン応答エレメント(TRE)というエンハンサーに結合して、その下流にある標的遺伝子の発現を誘導する。CMVプロモーター合わせて用いる。ドキシサイクリン投与によって発現を制御できため、時期特異的な発現が可能である。
小脳失調症状を主体とする遺伝性神経変性疾患を指す。常染色体優性遺伝形式のものに限って言う場合が多い。常染色体劣性の場合は脊髄小脳変性症ということが多い。小脳症状に加え、病理的な変性の広がりに対応して、錐体路徴候、運動ニューロン障害、などが見られる。孤発性の小脳失調症は大半が自律神経症状を主兆の一つとする多系統変性症である。脊髄小脳失調症1型は、原因遺伝子Ataxin-1の第8エキソン内において、グルタミンをコードするCAGリピート配列が異常に伸長している。これにより、異常伸長したポリグルタミン鎖をもつ変異型Ataxin-1タンパク質が産生・蓄積する。
注2:病態修飾治療法
疾患の原因となる病態機序を制御し、進行を抑制することを目的とした治療法。神経機能を補填することを目的とした症状改善療法 (symptomatic therapy)では、仮に治療開始後に症状が一過性に改善しても、病態進行による臨床症状の悪化は防ぎきれない。これに対して、疾患修飾治療法は、疾患の進行を抑え、場合によっては停止することが理論的には可能である。早期であれば、症状が改善して正常状態に戻ることも動物実験では示されている。
注3:非典型的ネクローシス (TRIAD)
一般的な細胞死の形態として知られるアポトーシスやネクローシスとは異なる、新たな細胞死の形態として、岡澤グループが報告した (Hoshino et al., 2006)。TRIAD (transcriptional repression-induced atypical cell death)は、RNA polymerase II特異的阻害剤であるalpha-amanitinによる細胞死の研究より発見され、アポトーシスのような形態学的・生化学的特徴は持たず、オートファジー細胞死のようなオートファゴゾームの増加・拡張はない。ネクローシスの典型像と考えられているネクロプトーシスでは、RIP1/3を介するシグナル経路の活性化が知られているが、TRIADではRIP1/3シグナル活性化がなく、一方、小胞体の顕著な拡張が形態学的特徴であり、Hippo経路活性化とYAP/YAPdeltaC機能低下が生化学的特徴である(Mao et al., 2016)。
注4:YAPdeltaC
YAP (yes-associated protein)の神経型アイソフォームで、岡澤グループが2006年に報告した(Hoshino et al., 2006)。3つのアイソフォーム (ins13, ins25, ins61)が存在し、YAP同様WWドメイン(タンパク質との結合部位で、特徴としてPPXYモチーフをもつ)はもつが、C末端のp73へのtransactivation domainが欠損している。多くの転写因子は単独ではなく、複数の転写因子などによる複合体形成が必要である。YAPは、これら転写因子の機能を補助する転写共役因子である。YAPdeltaCは、TRIADに対して、ドミナントネガティブ様に細胞死を抑制することを、私達のグループが以前報告している。
注5:Tet-ONマウス・時期特異的発現
特定の遺伝子の発現を、任意の時期・場所において制御できるようしたトランスジェニックマウスの実験系である。リバーステトラサイクリン制御性トランス活性化因子 (rtTA)がテトラサイクリン誘導体であるドキシサイクリンと結合すると、テトラサイクリン応答エレメント(TRE)というエンハンサーに結合して、その下流にある標的遺伝子の発現を誘導する。CMVプロモーター合わせて用いる。ドキシサイクリン投与によって発現を制御できため、時期特異的な発現が可能である。
論文情報
掲載誌:Nature Communications
論文タイトル:Developmental YAPdeltaC determines adult pathology in a model of spinocerebellar ataxia type 1
論文タイトル:Developmental YAPdeltaC determines adult pathology in a model of spinocerebellar ataxia type 1
問い合わせ先
研究に関すること
東京医科歯科大学 難治疾患研究所・脳統合機能研究センター
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat@mri.tmd.ac.jp
神経病理学分野 岡澤 均(オカザワ ヒトシ)
TEL:03-5803-5847 FAX:03-5803-5847
E-mail:okazawa.npat@mri.tmd.ac.jp
報道に関すること
東京医科歯科大学 総務部総務秘書課広報係
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp
〒113-8510 東京都文京区湯島1-5-45
TEL:03-5803-5833 FAX:03-5803-0272
E-mail:kouhou.adm@tmd.ac.jp

