認知症の原因タンパク質が脳炎症を起こす仕組みを解明 (2021)
2025年には高齢者の5人に1人が認知症に罹患すると言われており、その原因となるアルツハイマー病、前頭側頭葉変性症、あるいはパーキンソン病に関連するレビー小体型認知症などが大きな問題となっている。また、異常蛋白質の蓄積・凝集によって発症するハンチントン病などの神経変性疾患も認知症の原因となり得る。
これらの複数の神経変性疾患に共通して、タウという蛋白質が病態に関与することが知られている。例えば、アルツハイマー病と前頭側頭葉変性症の一部では、タウ蛋白質が神経細胞の中で蓄積・凝集して神経細胞死を誘発すると同時に、タウ蛋白質は神経細胞から細胞外に放出されて、脳の炎症を誘発する、あるいは脳の離れた場所の神経細胞に取り込まれるなどして悪影響を与えると考えられている。
脳には、全身組織の免疫系の司令塔と言われるマクロファージに相当するミクログリアという免疫細胞が存在するが、ミクログリアがタウ蛋白質に対して、どのような分子メカニズムを用いて反応しているかは、十分に解明されていなかった。
これらの複数の神経変性疾患に共通して、タウという蛋白質が病態に関与することが知られている。例えば、アルツハイマー病と前頭側頭葉変性症の一部では、タウ蛋白質が神経細胞の中で蓄積・凝集して神経細胞死を誘発すると同時に、タウ蛋白質は神経細胞から細胞外に放出されて、脳の炎症を誘発する、あるいは脳の離れた場所の神経細胞に取り込まれるなどして悪影響を与えると考えられている。
脳には、全身組織の免疫系の司令塔と言われるマクロファージに相当するミクログリアという免疫細胞が存在するが、ミクログリアがタウ蛋白質に対して、どのような分子メカニズムを用いて反応しているかは、十分に解明されていなかった。
当研究グループは、1998年にポリグルタミン配列に対する結合蛋白質としてPQBP1という分子を発見した。ハンチントン病や脊髄小脳失調症の原因蛋白質にはグルタミンが繰り返し出現するポリグルタミン配列が含まれることが多く、しかも、ポリグルタミン配列中のグルタミンの繰り返し数が増えると病気を発症することが知られている。当研究グループは、これらの神経変性疾患の病態を担う候補分子としてPQBP1を発見した。実際、PQBP1はハンチントン病や脊髄小脳失調症の原因蛋白質と結合することで、転写やDNA損傷修復機能が低下して発症につながることも確認できた(Okazawa et al, Neuron 2002; Fujita et al, Nature Commun 2013)。さらに、アルツハイマー病においても、別な病態経路からPQBP1の機能低下が起こり、これが神経細胞機能の低下につながることも分かった(Tanaka et al, Mol Psychiatry 2018)。また、PQBP1に先天的な遺伝子変異があると、患者さんの知的機能が低下することも、ヨーロッパの多施設共同研究から解明された(Kalscheuer et al, Nature Genet 2003)。一方、アメリカのSanford-Burnham 医学研究所が、免疫系細胞のマクロファージにおいては、ヒト免疫不全ウィルスHIV(エイズウィルス)をマクロファージ細胞が検知する際の細胞内受容体としてPQBP1が機能していることを発見した(Yoh et al, Cell 2015)。
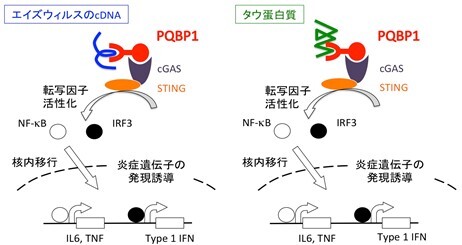
ミクログリアにおいて、エイズウィルスへの反応とタウ蛋白質に対する反応は同じメカニズムを用いている:
ミクログリアは、エイズウィルスcDNAを感知する細胞内受容体としてPQBP1を用いて、炎症性遺伝子の発現を誘導する(左図)。まったく同様な仕組みを用いて、ミクログリアはタウ蛋白質を感知して、炎症を惹起する(右図)。これは、あたかも自分由来の蛋白質であるタウ蛋白質を外来性病原体であるウィルスと『間違えて』反応しているようにも見える。
そこで当研究グループは、マクロファージに相当するミクログリアが、複数の神経変性疾患蛋白質と結合することが知られているPQBP1を介して、タウ蛋白質に対して反応しているのではないかという仮説を立てて検証を行った。実際に実験を行うと、想像したように、タウ蛋白質はPQBP1と結合することが物理的に証明され、ミクログリアに取り込まれた後に、細胞の中でもタウ蛋白質はPQBP1と結合していた。また、ミクログリアの中のPQBP1を欠損させると、ミクログリアのタウ蛋白質に対する炎症反応は極端に低下することが、培養ミクログリアあるいは脳内ミクログリアにおいて観察できた。特に、タウ蛋白質を脳内に注入するとマウスは認知症の症状をきたすが、ミクログリア特異的にPQBP1を欠損させたマウスにおいては、脳炎症と同時に認知機能低下も大幅に改善された。
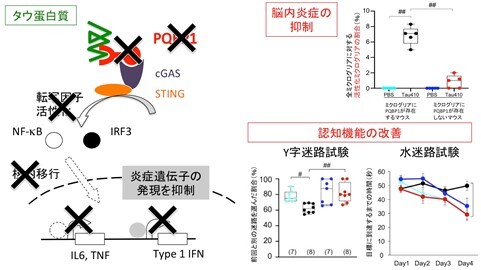
ミクログリアPQBP1抑制によるタウ関連神経変性疾患の脳内炎症のコントロール:
左図のように、ミクログリアのPQBP1を欠損すると、ミクログリアがタウ蛋白質に対して起こす炎症反応を抑えることができる。PQBP1機能抑制は、タウ蛋白質の脳投与によって誘発される脳内炎症の抑制(右上図)ならびに認知機能低下の改善(右下図)につながる。Y字迷路試験でも水迷路試験でも、タウ蛋白質を脳内に注入すると(黒丸)、未投与の状態(水色丸)より成績が悪くなる。しかし、PQBP1のない状態では、タウ蛋白質を脳内に注入しても成績は悪くならない(赤丸)。つまり、ミクログリアのPQBP1を欠損すると(赤丸)、未投与の状態(水色)とほぼ同等の認知機能を示す。
本研究では、ウィルス感染症と神経変性疾患が、それぞれの代表的疾患病態(エイズとタウ関連疾患)において、同じ分子メカニズムを介してミクログリア炎症を引き起こしていることが明らかになった。ウィルス感染症と神経変性疾患は、ともに細胞内封入体を作ることがある、スローウィルス感染症の臨床症状が神経変性疾患と共通している、日本脳炎後にパーキンソン病様の症状になることがある、など共通性に関する断片的な知識が蓄積してはいるが、両者の詳細な関係はよくわかっておらず、今回の研究のように、原因物質レベルでウィルス感染症と神経変性疾患の分子メカニズム(ミクログリアの感知システム)が共通していることを示したのは、初めてのケースかもしれない。
一方、近年では、アルツハイマー病のもう一つの原因物質であるアミロイドが、病原体をトラップする自然免疫系の防御物質であるという仮説(Moir et al, Alzheimer’s & Dementia 2018) も提唱されている。近年、抗体などの獲得免疫系が進化する前から身体に備わっていた自然免疫系と、神経変性疾患との関係についての研究が急速に進歩しており、今回の研究成果が契機となって、ウィルス感染症と神経変性疾患が互いにどのように影響を与えるのかについての理解が進むことが期待される。
また、今回の研究成果から、PQBP1のミクログリアにおける病態機能が解明された。先行研究では、アルツハイマー病態下のニューロンにおけるPQBP1の機能が明らかになっている(Tanaka et al, Mol Psychiatry 2018)。したがって、脳のそれぞれの細胞でPQBP1機能を適切に調節することが、神経変性疾患病態からの回復、さらには生理的状態での脳機能活性化につながる可能性も生まれた。これらの知見が将来的に革新的な治療法に発展することも期待される。
一方、近年では、アルツハイマー病のもう一つの原因物質であるアミロイドが、病原体をトラップする自然免疫系の防御物質であるという仮説(Moir et al, Alzheimer’s & Dementia 2018) も提唱されている。近年、抗体などの獲得免疫系が進化する前から身体に備わっていた自然免疫系と、神経変性疾患との関係についての研究が急速に進歩しており、今回の研究成果が契機となって、ウィルス感染症と神経変性疾患が互いにどのように影響を与えるのかについての理解が進むことが期待される。
また、今回の研究成果から、PQBP1のミクログリアにおける病態機能が解明された。先行研究では、アルツハイマー病態下のニューロンにおけるPQBP1の機能が明らかになっている(Tanaka et al, Mol Psychiatry 2018)。したがって、脳のそれぞれの細胞でPQBP1機能を適切に調節することが、神経変性疾患病態からの回復、さらには生理的状態での脳機能活性化につながる可能性も生まれた。これらの知見が将来的に革新的な治療法に発展することも期待される。
発表論文
Jin, M., Shiwaku, H., Tanaka, H., Obita, T., Ohuchi, S., Yoshioka, Y., Jin, X., Kondo, K., Fujita, K., Homma, H., Nakajima, K., Mizuguchi, M. & Okazawa, H. (2021)
Tau activates microglia via the PQBP1-cGAS-STING pathway to promote brain inflammation.
Nat. Commun. 15 November 2021, 12 (1), 6565. doi: 10.1038/s41467-021-26851-2
Tau activates microglia via the PQBP1-cGAS-STING pathway to promote brain inflammation.
Nat. Commun. 15 November 2021, 12 (1), 6565. doi: 10.1038/s41467-021-26851-2

