神経変性が加速する分子メカニズムを解明 ―老化・変性の加速媒介分子を標的とする認知症治療の実用化へ期待― (2021)
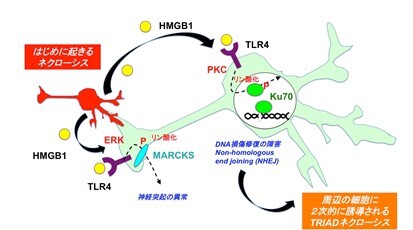
(図1)HMGB1-TLR4-Ku70を介して、神経細胞死が周辺に伝搬するときの分子メカニズム
その結果、アルツハイマー病患者の死後脳を網羅的解析したプロテオームデータを改めて見直すと、Ku70というDNA損傷修復分子が異常にリン酸化を受けていることが分かった。リン酸化Ku70は損傷DNAへの移動と損傷DNAへの結合が低下しており、結果としてDNA損傷修復機能低下が低下していた(図1)。さらに、Ku70リン酸化が細胞外HMGB1に由来する出来事であることを、HMGB1とその受容体との結合を阻害する、新たなヒトHMGB1モノクローナル抗体を作成し、HMGB1抗体投与を受けたアルツハイマー病モデルマウスを用いて確認した。 これは例えるなら、コロナウィルスが1人の患者から3人の患者に感染すると病気の患者数が爆発的に増加するように、HMGB1を介して細胞死が1個の神経細胞から3個の神経細胞に伝搬すると、脳内の細胞死が加速的に増加することを意味している。HMGB1抗体投与マウスではKu70リン酸化が起こらず、神経細胞のDNA損傷、細胞死、さらにアミロイド細胞外凝集、認知機能障害の全てが抑制されていた(図2、3)。
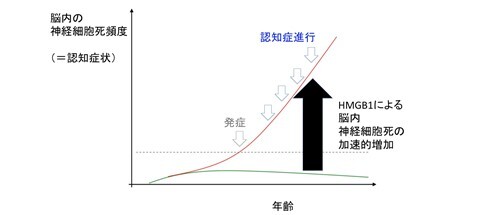
(図2)HMGB1による神経細胞死の伝搬・加速のイメージ
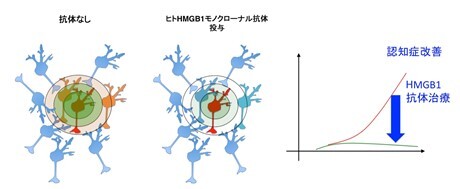
(図3)HMGB1抗体治療は神経細胞死加速を抑制する
また、ネクローシスには様々なタイプがあることが現在までに知られているが、アルツハイマー病患者脳とモデルマウスで起きているネクローシスは、TRIADネクローシスであり、他のネクローシス(necropotosis, paraptosis, pyroptosis など)ではないことを確認し、さらに、TRIADネクローシスは、細胞老化(senescence)の形質を併せ持っていることを発見した。つまり、TRIADネクローシスは神経細胞老化の終末形として起きる現象でもあり、『神経変性疾患では、老化細胞死そのものが通常より促進されている』ということになる(図4)。「HMGB1 とアルツハイマー病の関係」「老化ニューロン細胞死の本態としてのTRIADネクローシス」を初めて発見したのは我々のグループが最初であるが、続いてテキサス大学のグループもタウ・オリゴマーがグリア細胞からのHMGB1を介して脳老化を促進するという興味深い報告を発表している(Gaikwad et al, Cell Reports 2021)。したがって、この図式は、今後、より多くの神経変性疾患に一般化する可能性がある。
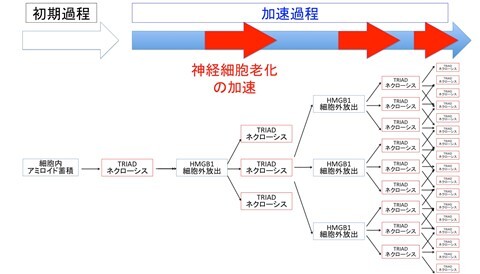
(図4)TRIADネクローシスとHMGB1による神経細胞死加速・老化加速
今回の研究では、アルツハイマー病において加齢とともに神経細胞死が加速的に増加するメカニズムを解明し、それを仲介する最重要因子がHMGB1であることを同定した。さらに、HMGB1で誘導されるTRIAD細胞死が、老化の最終形としての細胞死と同一であることも明らかとなった。前者は、HMGB1抗体治療等のアルツハイマー病あるいは他の認知症を含む神経変性疾患全般を対象とする根本治療へ発展することが期待される。我々の研究グループは日本医療研究開発機構の支援を受けて、実用化を目指した研究開発を開始している。一方、後者は、神経変性と老化の関係という、重要な科学的テーマに発展することが期待できる。
発表論文
HMGB1 signaling phosphorylates Ku70 and impairs DNA damage repair in Alzheimer’s disease pathology.
Commun. Biol. 11 October 2021, 4 (1), 1–23. doi: 10.1038/s42003-021-02671-4

