ペプチド中分子、ヘプタ・ヒスチジンによるタウ凝集阻害 (2021)
社会の高齢化が進む日本では、神経変性に起因する認知症はより大きな問題となっている。既に高齢者のほぼ5人に1人が認知症に罹患していると言われ、その半分以上は、神経変性による認知症の代表格であるアルツハイマー病が原因である。タウタンパク質は、アルツハイマー病の海馬や大脳の神経細胞の内部に蓄積し細胞を障害することが知れているが、さらに、前頭側頭葉変性症、進行性核上性麻痺(PSP)などのタウオパチーと呼ばれる変性性認知症の病態を担うことでも知られている。また、タウタンパク質の凝集は、ハンチントン病の病態にも関与することが報告されている。 我々は、これまでに、DNA損傷に対する修復機能低下が神経変性共通病態であることを、前頭側頭葉変性症、ハンチントン病など複数の神経変性疾患において、世界に先駆けて報告してきた (Qi et al. Nature Cell Biol 2007; Enokido et al. J Cell Biol 2010; Fujita et al. Nature Commun 2013; Ito et al. EMBO Mol Med 2015; Taniguchi et al. Hum Mol Genet 2016; Homma et al, Life Sci Alliance 2021) 。 特に、ハンチントン病においては、同病の原因タンパク質である変異型ハンチンチンがKu70というDNA損傷修復タンパク質と結合して、 Ku70の持つDNA損傷修復機能を妨げることを明らかにした(Enokido et al. J Cell Biol 2010)。 さらに、1分子蛍光解析装置MF20を用いて化合物ライブラリーをスクリーニングし、Ku70 と変異型ハンチンチンの結合を阻害する分子として、ヘプタ・ヒスチジンを発見した(Imamura et al, Sci Rep 2016)。この際、ヘプタ・ヒスチジンは、変異型ハンチンチンがKu70タンパク質の表面の凹みにはまり込むことを、それよりも先に凹みに入ることによって邪魔していたが、同時に、ヘプタ・ヒスチジンが凝集性の高いタンパク質と同じような振る舞いをすることが分かった。そこで本研究では、ヘプタ・ヒスチジンを用いた治療開発の対象疾患拡大のため、凝集性の高いタウタンパク質の凝集への作用を検討した。
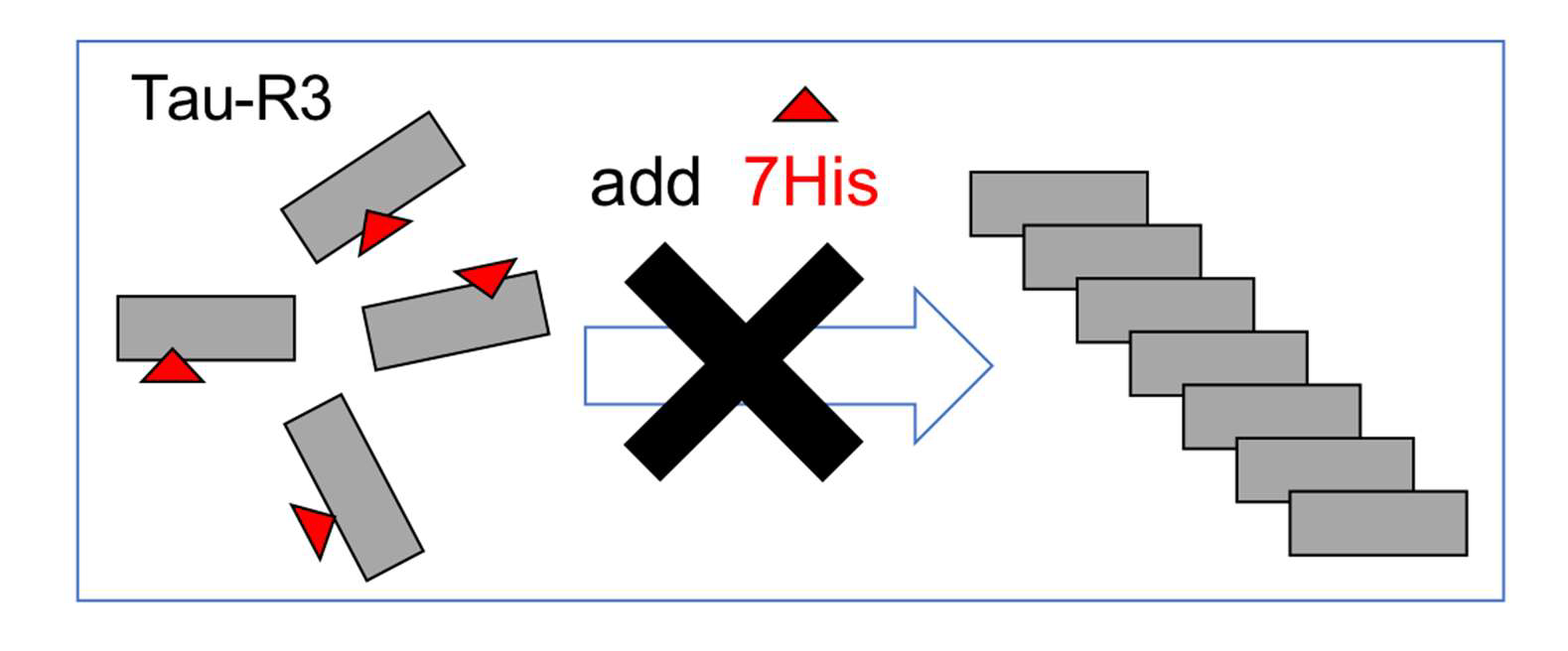
ヘプタ・ヒスチジンはタウタンパク質の凝集(重合)を阻害する
本研究では、動的光散乱法、電子顕微鏡凝集解析、NMR化学シフトなどの方法を用いて、様々な角度からヘプタ・ヒスチジンがタウタンパク質の凝集(重合)を阻害することを確認した。現状の問題点は、ペプチドの脳移行効率が高くないこと、消化管からの吸収効率、ペプチドの半減期などが挙げられるが、様々な工夫をすることで、これらの問題点の解決が可能となると考えられる。 また、認知症の治療は、がんの治療と同様に、多剤併用療法や、さらには複数の異なるモダリティの治療法を組み合わせた形に発展することが予想される。今回の成果は、そのような複合的治療や、それぞれの患者さんに適した治療薬を選ぶ個別治療につながっていくことが期待される。
発表論文
Kondo, K., Ikura, T., Tanaka, H., Fujita, K., Takayama, S., Yoshioka, Y., Tagawa, K., Homma, H., Liu, S., Kawasaki, R., Huang, Y., Ito, N., Tate, S. & Okazawa, H. (2021)
Hepta-Histidine Inhibits Tau Aggregation.
ACS Chem. Neurosci. 28 July 2021, 12 (16), 3015–3027. doi: 10.1021/acschemneuro.1c00164
Hepta-Histidine Inhibits Tau Aggregation.
ACS Chem. Neurosci. 28 July 2021, 12 (16), 3015–3027. doi: 10.1021/acschemneuro.1c00164

